油松遗传结构与地理阻隔因素的相关性
2013-09-19孟翔翔狄晓艳王孟本朱世忠赵天梁
孟翔翔,狄晓艳,王孟本,* ,朱世忠,赵天梁
(1.山西大学黄土高原研究所,太原 030006;2.山西省林业调查规划院,太原 030001)
油松是我国特有树种,其自然分布范围广阔,介于31°—44°N和101°30'—124°25'E之间,呈非连续或岛屿状分布格局[1-2]。天然地理屏障可能会阻碍种群间基因交流,导致种群间遗传分化增大[3-4]。核DNA遗传标记研究显示,油松的遗传变异主要存在于种群内,种群间已具有一定的遗传分化[5]。
关于山脉屏障对植物遗传分化的作用,已有人做了大量研究工作,但结果却不尽相同。已有研究表明,山脉是美国短叶松(Pinus banksiana)[6]、中国青杨(populus cathayana)[7]、海岸松(Pinus pinaster)[8]基因交流和迁移的重要屏障,从而引起其遗传谱系产生隔离;但山脉对欧洲水青冈(Fagus sylvatica)[9]和水曲柳(Fraxinus mandshurica)[10]种群遗传分化却没有显著作用。研究同时表明,东西走向山脉的阻隔作用是欧洲大陆第四纪冰期前后植物类群的差异大于北美大陆的重要因素[11];东北-西南走向的山脉阻碍了白木香(Aquilaria sinensis)谱系间的基因交流,而对于走向与白木香扩张方向一致的山脉,其却不阻碍白木香谱系间的基因交流[12]。
秦岭是中国重要的南北自然分界线,呈东西向横亘于中国中部,横跨甘肃、陕西、河南三省。它既是我国亚热带与暖温带气候的分界线,也是常绿阔叶林与落叶阔叶林的分界线[13]。贺兰山位于阿拉善高原与银川平原之间,大致呈南-北走向,是我国西北干旱区与半干旱区的分界线,也是温带荒漠与温带荒漠草原的分界线[14]。
在第四纪冰期气候波动的影响下,松科植物(如油松)可能发生了与欧洲和北美相似的向南退缩和向北扩展的过程[15-16],其线粒体为母系遗传,更容易反映群体分化的模式[4,17-19]。基于此,本研究以分布于秦岭、贺兰山和晋陕两省的10个天然油松种群为研究对象,采用线粒体DNA序列测定技术,对种群的单倍型进化关系以及种群的聚类特点等进行研究,以探究地理阻隔对油松遗传结构的影响。此项研究对深入认识油松遗传结构的形成机制具有一定意义,同时可为进一步探讨中国北方植物区系现存分布格局形成机制提供有益参考。
1 材料和方法
1.1 实验材料
本研究选取了来自秦岭、贺兰山和晋陕两省的10个天然油松种群共100个个体的针叶样品。每个种群取样10个,个体之间距离大于100 m。所采针叶置于硅胶中迅速干燥,密封于塑料口袋带回实验室,-20℃下保存备用。油松采样地点概况[5]见图1和表1。
1.2 方法
1.2.1 DNA提取
采用改进的CTAB(十六烷基三甲基溴化铵)法[20],从硅胶干燥的针叶中提取总DNA。
1.2.2 PCR扩增及测序
分别采用线粒体nad1内含子(f-gAT Cgg CCA TAA Atg TAC TCC,r-CCC CAT ATA TAT TCC Cgg AgC[21])和matR内含子(f-CgA CAg AAg CAC gAA ATT CC,r-ACC CgA CgA TAA CTA gCT TC[22])引物序列进行扩增。PCR 反应为 25 μl,其中含有 1×PCR buffer,总 DNA 30—50 ng,dNTPs 0.2 mmol/L,taq 酶 1 U,引物 0.4 μM;反应条件为:94 ℃预变性 4 min,94 ℃变性 30 s,54 ℃(nad1)/58℃ (matR)退火45 s,72℃延伸1 min,30个循环,最后延伸5 min。扩增产物经0.8%的琼脂糖凝胶电泳后,用Gel Extraction Kit纯化试剂盒(bio-tec OMEGA,USA)按推荐步骤进行纯化,纯化产物送往上海立菲生物科技有限公司进行测序。
1.2.3 数据处理:
采用MEGA 5.1中的ClustalX软件对所得序列进行比对(并进行适当手工校正),以得到不同序列(即不同单倍型)。同时采用MEGA 5.1中的相应模块对多态性位点、简约信息位点、各碱基含量、核苷酸多样性进行计算;对单倍型间和种群间的Kimura双参数遗传距离进行计算;并构建种群邻接聚类图。采用NETWORK 4.6.1.1软件 (http://www.fluxus-engineering.com)[23]构建单倍型网络关系图。采用PHYLIP 3.69软件中的最大简约法(MP)构建单倍型聚类图。采用ARLEQUIN软件中的AMOVA对种群间的遗传分化是否显著进行检验。
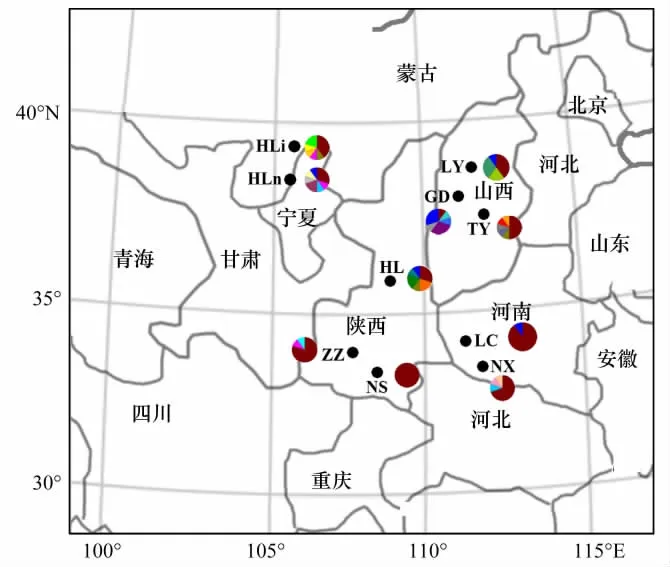
图1 10个天然油松种群的地理位置(黑点)及其单倍型分布概况(饼状图)Fig.1 Geographic location(black dots)of the 10 natural populations of Pinus tabulaeformis,and their mitotype distribution(pie chart)Hli等为种群代号(详见表1);不同颜色代表不同的单倍型
2 结果
2.1 线粒体DNA序列变异与单倍型
比对后的10个天然油松种群的100个个体线粒体DNA的nad1片段长度为1093—1280 bp,校正后长度为1366 bp,共包括168个多态性位点,其中34个简约信息位点,134个单变位点。线粒体matR片段长度为475—477 bp,校正后长度为478 bp,共包括4个多态性位点,其中1个简约信息位点,3个单变位点,核苷酸 T、C、A、G平均比例分别为 25.83%(25.44%—26.58%)、23.94%(23.17%—24.16%)、22.17%(21.92%—22.98%)、28.06%(27.01%—28.41%),A+T含量(48%)略低于C+G含量(52%)。序列变异含有碱基缺失/插入和碱基替换等,共得到27个单倍型(表1),其中单倍型h1为所用种群所共有,占所有个体数的54%,是分布最广的单倍型;单倍型h3分布于HLn,HL和TY种群中,单倍型h6分布于HLn、HLi和ZZ种群,单倍型h9分布于HLn和NX种群,单倍型h27分布于HLn、LY、GD、LC和HL5个种群中,其余22个单倍型仅存在于单个种群中。由此可见,两个种群(LC和NS)仅有共有单倍型,而其余种群则分别具有1—4个独有单倍型。
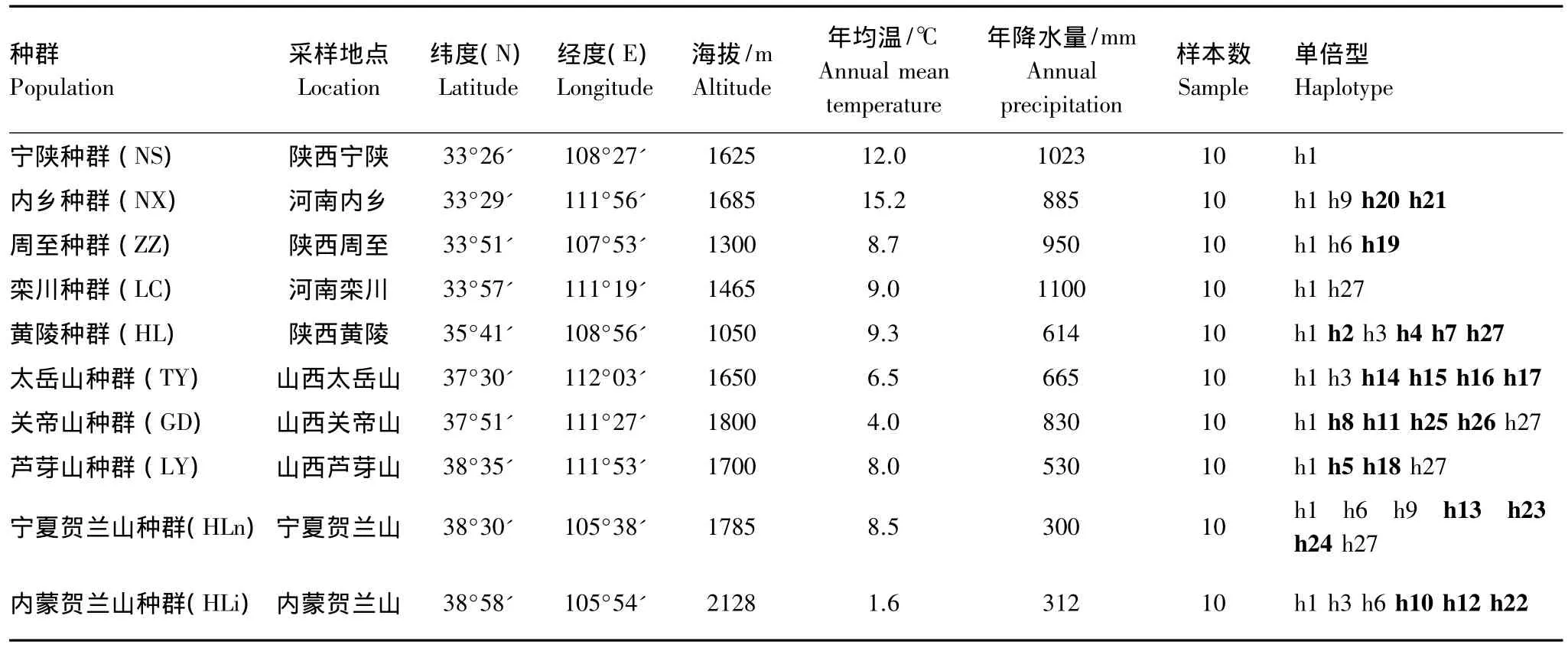
表1 供试油松种群的地理位置及其单倍型类型Table 1 Geographic location of the populations of Pinus tabulaeformis,and their haplotypes
就位于秦岭或贺兰山两侧的种群而言,秦岭南侧的NS和NX种群与秦岭北侧的ZZ和LC种群有一个共有单倍型,贺兰山东西两侧的HLn和HLi种群具有两个共有单倍型。秦岭南侧NX种群和北侧ZZ种群分别具有两个和一个独有单倍型;贺兰山东侧种群(HLn)和西侧种群(HLi)均具有3个独有单倍型。相比之下,晋陕种群(即油松分布区中心种群HL、TY、GD和LY)则分别具有2—4个独有单倍型。由此可见,秦岭种群或贺兰山种群的独有单倍型平均数目(分别为3/4和6/2)明显小于分布区中心种群(13/4)。
2.2 单倍型间的进化关系
如图2所示,27个单倍型且可合并为12个单倍型(其中h1—h14合并为h1,h25—h27合并为h25),其分布大致呈三叶草形,h25位于交汇中心,主要涉及GD与LY,LC,HL和HLn种群;h22和h23独立为一支,分别涉及HLi和HLn种群;h1,h16、h17和h20、h21为一支,其中h16和h17为TY种群的独有单倍型,h20和h21为NX种群的独有单倍型;h18,h19和h24形成第三支,分别为LY,ZZ和HLn种群的独有单倍型。由此可知,各种群单倍型之间的关系比较复杂。尽管如此,从图2仍然可以看出,位于贺兰山东西两侧种群的独有单倍型(h22和h23)紧邻且独成一支。位于秦岭南北两侧种群的独有单倍型(h20,h21与h19)之间仅存在三个进化节点,说明其关系较近。同时可以看出,位于贺兰山东侧种群的独有单倍型(h23)与晋陕种群的某些独有单倍型(h25和h15)的关系也比较近。位于秦岭北侧种群的独有单倍型(h19)与晋陕种群的独有单倍型(h18、h25和h15)的关系同样较近。
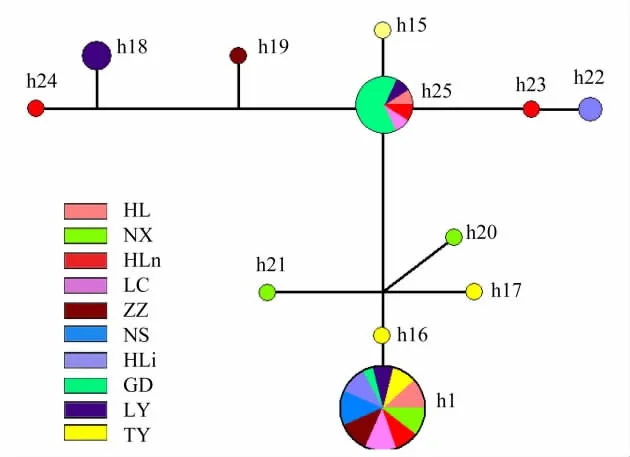
图2 油松种群27个单倍型的网络关系图Fig.2 Network relationship chart of the 27 haplotypes from Chinese pine populationsh代表单倍型,h1包括单倍型h1—14,h25包括h25—27,圆圈大小代表单倍型频率,不同颜色代表不同的种群;图例解释见表1
从图3同时可以看出,这些单倍型可大致聚为3组。其中单倍型h1-h15(除h7之外)为第一组,单倍型h16-h24为第二组,单倍型h25,h26,h27和h7为第三组。图3中的第一组单倍型(除h15)和第三组单倍型(除h7)在图2中各自为一个单倍型(h1和h25),同样表明第一组或第三组各个单倍型有着更近的亲缘关系。然而,在第一组中,单倍型h9,h13和h3,h10分别存在于贺兰山东西两侧种群之中(其中h13和h10分别为独有单倍型);h9和h6分别存在于秦岭的南北两侧种群之中。在第二组中,则显示出与图2相类似的结果,即h18,h19和h24为一亚组,h22和h23为一亚组;h16、h20和h21为一亚组。总体来看,在秦岭南北两侧和贺兰山东西两侧的3对种群9个独有单倍型中,有8个独有单倍型的关系较近(h19与h20,h19与h21,h13与h10,h24与h22,h22与h23)。与此同时,位于秦岭北侧种群的独有单倍型(h19)与晋陕种群的独有单倍型(h17和h18)的关系也比较近。位于贺兰山东侧种群的独有单倍型(h23和h24)与晋陕种群的某些独有单倍型(h16、h17和h18)的关系同样较近。
以上分析说明,油松种群单倍型间的亲缘关系比较复杂。秦岭、贺兰山和晋陕3组种群之间不仅具有共有单倍型,多数种群且具有各自的独有单倍型。但是,位于秦岭或贺兰山两侧种群的独有单倍型之间的关系有时(如图2所示)甚或往往(如图3所示)较近。而且秦岭北侧或贺兰山东侧种群的独有单倍型与油松分布区中心种群的某些独有单倍型的关系亦较近。这意味着山脉地理屏障与油松的遗传分化没有明显关系。
2.3 种群遗传多样性和遗传距离
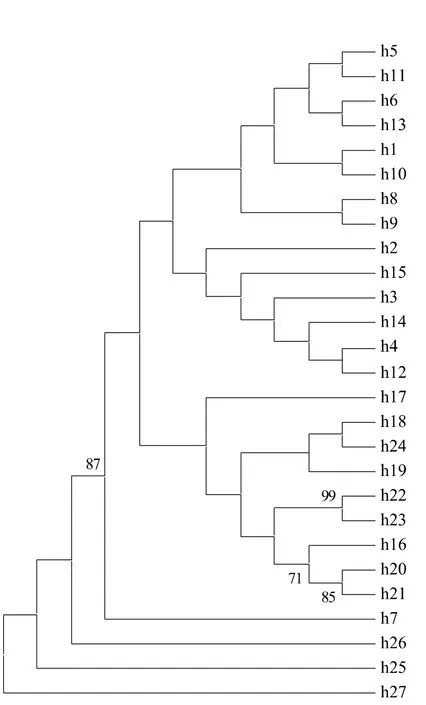
图3 油松27个单倍型的最大简约(MP)聚类图Fig.3 Cluster result of 27 mtDNA haplotypes of Pinus tabulaeformis using maximum parsimony(MP)method
油松种群线粒体nad1和matR序列分析表明,总体水平(100个个体)的单倍型多样性为0.7120,核苷酸多样性为0.0050(表2)。种群内单倍型多样性和核苷酸多样性分别为0—0.9111和0—0.0176。其中NX种群核苷酸多样性最高,其次为TY、LC、ZZ种群,而NS种群核苷酸多样性最低。AMOVA分析表明(表3),所有种群的90.16%的遗传变异分布于种群内,9.84%的遗传变异分布于种群间。但是种群间遗传分化仍然很显著。对秦岭、贺兰山和晋陕3组种群而言,秦岭种群间或晋陕种群间遗传分化极显著,而贺兰山种群间遗传分化则不显著。
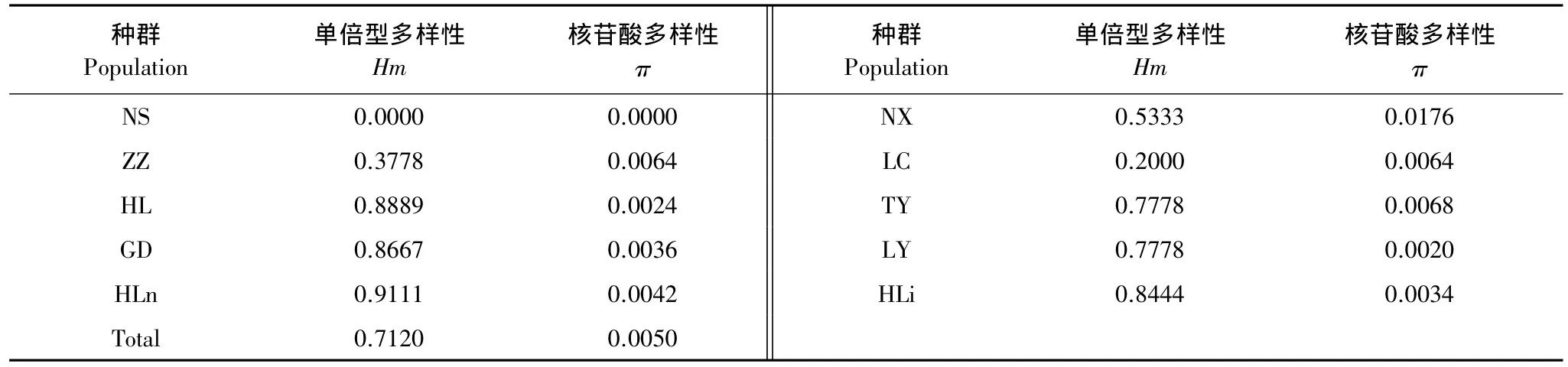
表2 油松种群的单倍型多样性(Hm)和核苷酸多样性(π)Table 2 Haplotype diversity(Hm)and nucleotide diversity(π)for 10 nature populations of Pinus tabulaeformis
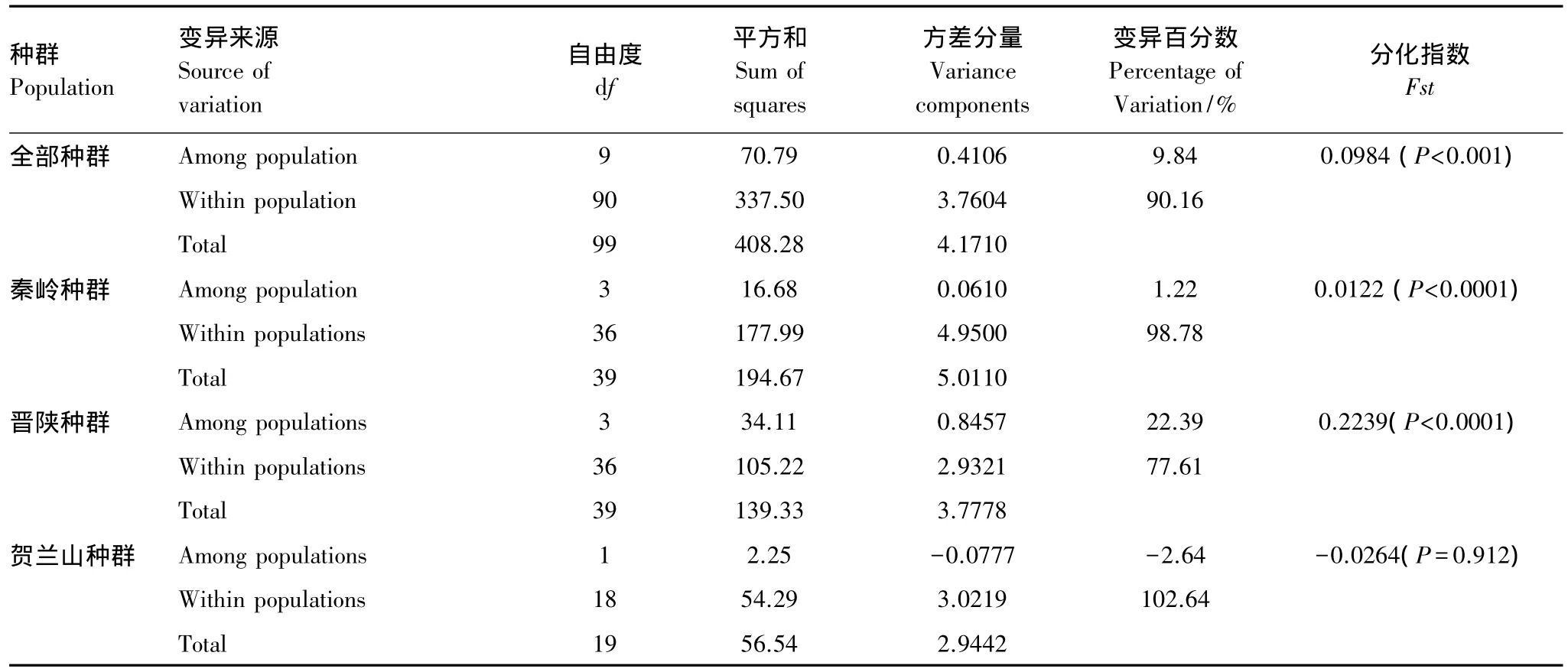
表3 基于线粒体序列的天然油松种群的分子方差分析(AMOVA)Table 3 Analysis of molecular variance(AMOVA)of mitotypes in the populations of Pinus tabulaeformis
从种群之间的遗传距离(表4)可知,NX种群与其他种群之间的遗传距离均比较大,其次为TY种群。如图4所示,若以0.0015为临界值,可将供试种群分为6组,即HLi和HLn各为一组,LY、GD和LC为一组,HL、NS和ZZ为一组,NX和TY各为一组。说明油松种群间的聚类关系比较复杂。很显然,这种聚类关系与油松单倍型间的复杂进化关系密切相关。
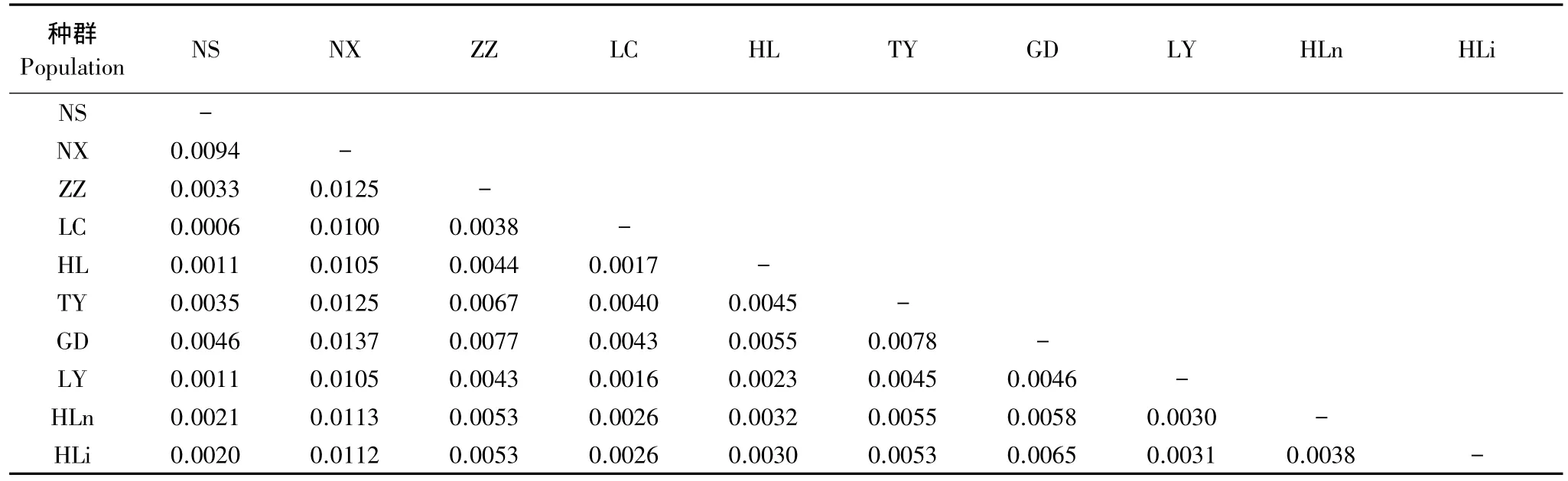
表4 油松种群间的遗传距离Table 4 Genetic distance among the 10 populations of Pinus tabulaeformis
尽管秦岭南、北两侧种群(NS与ZZ)或贺兰山东、西两侧种群(HLi与HLn)的聚类关系较近,但是由于NX和TY各分为一组,而LC归为另一组,秦岭南、北两侧种群与油松分布区中心种群之间表现出复杂的聚类关系。同样由于TY单独为一组,HLi与HLn各为一组,贺兰山东西两侧种群与油松分布区中心种群之间亦表现出比较复杂的关系。这从另一个侧面说明,位于秦岭南北两侧或贺兰山东西两侧种群之间的遗传分化与山脉屏障的存在没有明显关系。
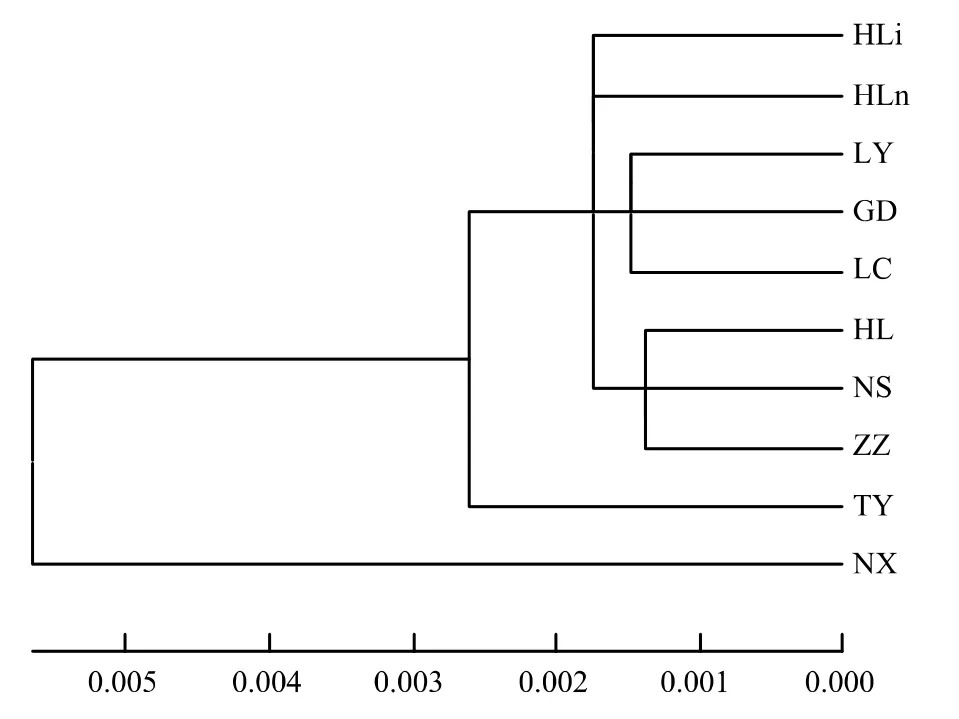
图4 基于Kimura双参数距离的油松天然种群的邻接聚类图Fig.4 Neighbor-joining tree based on Kimura 2-parameter distance in populations of Pinus tabulaeformis
3 讨论
遗传多样性是物种适应环境的基础。遗传多样性的高低可以在一定程度上反映物种的进化过程、进化潜力,以及物种对环境的适应能力。松科植物线粒体基因具有母系遗传特性,不经历重组,能更直接地反映植物的进化特征。对mtDNA序列的分析显示,在供试油松种群中共检测到27个单倍型。单倍型h1为各种群所共有,可能为一个古老单倍型。除h3,h6,h9和h27这4个单倍型为2—5种群共有之外,其余22个单倍型分别为8个种群所独有。整体而言,油松具有较高的单倍型多样性(0.7120)和核苷酸多样性(0.0050)。尽管遗传多样性主要存在于种群内(90.16%),种群间遗传分化仍然很显著(Fst=0.0984,P<0.001)。这与已有研究结果[5,24-25]相一致。由此可见,油松种群在长期的进化过程中的确产生了明显分化。
山脉尤其是东西走向的山脉,在第四冰期时对种群的分子进化可能起到重要作用[26]。山脉主要是通过阻碍花粉和种子传播,从而影响基因流,导致种群间的遗传分化。种群遗传分化程度通常用遗传分化指数(Fst)表示。本研究显示,与晋陕种群的遗传分化指数(0.2239)相比,秦岭种群的遗传分化指数(0.0122)和贺兰山种群的遗传分化指数(-0.0264)均较小(尽管秦岭种群或晋陕种群的遗传分化显著,而贺兰山种群的遗传分化不显著)(表3)。这意味着山脉屏障与油松的遗传分化没有多大关系。
贺兰山种群的遗传分化指数为负值,且种群内变异超过了100%(102.64%)。根据叶莹莹等的对类似结果的分析[27],可以认为贺兰山两侧的两个油松种群间无遗传分化。这同样说明贺兰山对其两侧油松种群的遗传分化几乎没有任何影响。
就单倍型而言,尽管秦岭南、北侧或贺兰山东、西侧种群各有自己的独有单倍型,但与晋陕种群相比,其独有单倍型的平均数较小。尽管各种群单倍型之间的关系错综复杂,但是从单倍型的网络关系和最大简约聚类图中仍然可以比较清楚地看出,位于秦岭南北两侧或贺兰山东西两侧种群的独有单倍型之间关系往往比较接近(如图2中h19与h20和h21;h22与h23;图4中h19与h20,h19与h21;h13与h10,h22与h24,尤其是h22与h23)。已有油松谱系地理学研究也表明,太白山种群和宁陕种群之间没有明显遗传分化[4]。这些分析说明,油松的遗传结构与其分布区山脉屏障的存在没有明显关系。
[1] Xu H C.Chinese Pine(Pinus tabulaeformis Carr).Beijing:China Forestry Press,1993:18-40.
[2] Xu H C.Geographic Variation and Provenance Selection of Pinus tabulaeformis Carr.Beijing:China Forestry Press,1992:37-56.
[3] Cun Y Z,Wang X Q.Plant recolonization in the Himalaya from the southeastern Qinghai-Tibetan Plateau:Geographical isolation contributed to high population differentiation.Molecular Phylogenetics and Evolution,2010,56(3):972-982.
[4] Chen K M,Abbott R J,Milne R I,Tian X M,Liu J Q.Phylogeography of Pinus tabulaeformis Carr.(Pinaceae),a dominant species of coniferous forest in northern China.Molecular Ecology,2008,17(19):4276-4288.
[5] Wang M B,Hao Z Z.Rangewide genetic diversity in natural populations of Chinese pine(Pinus tabulaeformis).Biochemical Genetics,2010,48(7/8):590-602.
[6] Godbout J,Jaramillo-Correa J P,Beaulieu J,Bousquet J.A mitochondrial DNA minisatellite reveals the postglacial history of jack pine(Pinus banksiana),a broad-range North American conifer.Molecular Ecology,2005,14(11):3497-3512.
[7] Lu Z X,Wang Y H,Peng Y H,Korpelainen H,Li C Y.Genetic diversity of Populus cathayana Rehd populations in southwestern China revealed by ISSR markers.Plant Science,2006,170(2):407-412.
[8] González-Martínez S C,Gómez A,Carrión J S,Agúndez D,Alía R,Gil L.Spatial genetic structure of an explicit glacial refugium of maritime pine(Pinus pinaster Aiton)in southeastern Spain.Phylogeography of Southern European Refugia,2007,(PartⅢ):257-269.
[9] Magri D,Vendramin G G,Comps B,Dupanloup I,Geburek T,Gömöry D,Latalowa M,Litt T,Paule L,Roure J M,Tantau L,van der Knaap W O,Petit R J,de Beaulieu J L.A new scenario for the Quaternary history of European beech populations:palaeobotanical evidence and genetic consequences.New Phytologist,2006,171(1):199-221.
[10] Hu L J,Uchiyama K,Shen H L,Saito Y,Tsuda Y,Ide Y.Nuclear DNA microsatellites reveal genetic variation but a lack of phylogeographical structure in an endangered species,Fraxinus mandshurica,across North-east China.Annals of Botany,2008,102(2):195-205.
[11] Ying T S.Areography of the gymnosperms of China(1)-distribution of the pinaceae of China.Acta Phytotaxonomica Sinica,1989,27(1):27-38.
[12] Jia W J,Li E X,Yang B Y,Liu D X.Studied on genetic diversity of Aquilaria sinensis.Journal of Tropical and Subtropical Botany,2010,18(2):159-164.
[13] Ying T S.An analysis of the flora of Qinling Mountain range:Its nature,characteristics,and origins.Acta Phytotaxonomica Sinica,1994,32(5):389-410.
[14] Di Q Z,Tian L S,Li Z J.The characteristics of Helan Mountain flora of spermatophytes.Acta Botanica Boreali-Occidentalia Sinica,1988,8(4):242-254.
[15] Yu G,Chen X D,Ni J,Cheddadi R,Guiot J,Han H,Harrison S P,Huang C,Ke M,Kong Z,Li S,Li W,Liew P,Liu G,Liu J,Liu Q,Liu K B,Prentice I C,Qui W,Ren G,Song C,Sugita S,Sun X,Tang L,van Campo E,Xia Y,Xu Q,Yan S,Yang X,Zhao J,Zheng Z.Palaeovegetation of China:a pollen data-based synthesis for the mid-Holocene and last glacial maximum.Journal of Biogeography,2000,27(3):635-664.
[16] Qian H,Ricklefs R E.Large-scale processes and the Asian bias in species diversity of temperate plants.Nature,2000,407(6801):180-182.
[17] Brown K R,Zobel D B,Zasada J C.Seed dispersal,seedling emergence and early survival of Larix laricina(DuRoi)K.Koch in the Tanana Valley,Alaska.Canadian Journal of Forest,18(3):306-314.
[18] Wagner D B.Nuclear chloroplast and mitochondrial DNA polymorphisms as biochemical markers in population genetic analysis of forest trees.New Forests,1992,6(1/4):373-390.
[19] Ennos R A.Estimating the relative rates of pollen and seed migration among plant populations.Heredity,1994,72(3):250-259.
[20] Doyle J J.A rapid DNA isolation procedure for small quantities of fresh leaf material.Phytochemical Bulletin,1987,19:11-15.
[21] Song B H,Wang X Q,Wang X Y,Sun L J,Hong D Y,Peng P H.Maternal lineages of Pinus densata,a diploid hybrid.Molecular Ecology,2002,11(6):1057-1063.
[22] Jaramillo-Correa J P,Beaulieu J,Bousquet J.Variation in mitochondrial DNA reveals multiple distant glacial refugia in black spruce(Picea mariana)a transcontinental North American conifer.Molecular Ecology,2004,13(9):2735-2747.
[23] Bandelt H J,Forster P,Röhl A.Median-joining networks for inferring intraspecific phylogenies.Molecular Biology and Evolution,1999,16(1):37-48.
[24] Wang M B,Gao F Q.Genetic variation in Chinese Pine(Pinus tabulaeformis),a woody species endemic to China.Biochemical Genetics,2009,47(1/2):154-164.
[25] Li C,Chai B F,Wang M B.Genetic diversity of Pinus tabulaeformis,populations in North China.Bulletin of Botanical Research,2006,26(1):98-102.
[26] Shen L,Chen X Y,Li Y Y.Glacial refugia and postglacial recolonization patterns of organisms.Acta Ecologica Sinica,2002,22(11):1983-1990.
[27] Ye Y Y,Xu M Y,Guo B Y,Wu C W.Genetic structure and sequence analysis of four populations of Mytilus coruscus in the coastal waters of southeast China sea using 16s rRNA.Oceanologia et Limnologia Sinica,2013,43(2):376-381.
参考文献:
[1] 徐化成.油松.北京:中国林业出版社,1993:18-40.
[2] 徐化成.油松地理变异和种源选择.北京:中国林业出版社,1992:37-56.
[11] 应俊生.中国裸子植物分布区的研究(1)——松科植物的地理分布.植物分类学报,1989,27(1):27-38.
[12] 贾文杰,李恩香,杨柏云,刘东晓.白木香遗传多样性研究.热带亚热带植物学报,2010,18(2):159-164.
[13] 应俊生.秦岭植物区系的性质、特点和起源.植物分类学报,1994,32(5):389-410.
[14] 狄维忠,田连恕,李智军.贺兰山种子植物区系的特征.西北植物学报,1988,8(4):242-254.
[26] 沈浪,陈小勇,李媛媛.生物冰期避难所与冰期后的重新扩散.生态学报,2002,22(11):1983-1990.
[27] 叶莹莹,徐梅英,郭宝英,吴常文.我国东南沿海厚壳贻贝(Mytilus coruscus)4个群体线粒体16S rRNA序列及遗传结构分析.海洋与湖沼,2013,43(2):376-381.
