黄芩生品和炮制品中总黄酮提取工艺的研究
2013-09-19张素敏王晓闻贾治勇张正超
张素敏,王晓闻,贾治勇,张正超
(山西农业大学 食品科学与工程学院,山西 太谷030801)
黄芩又名山茶根,为唇形科多年草本植物,它是一种传统的中药材。黄芩性寒、味苦,具有清热燥湿,泻火解毒,凉血安胎等功效,所以一般临床上常用于暑温胸闷呕吐、湿热、黄疸、肺炎、痢疾、胎动不安、高血压等的治疗。黄芩中的主要活性物质是黄酮类化合物[1~3]。所谓黄芩生品就是指原材料只是经过除杂质、清洗以及干燥而不经过其他任何加工而得到的产品;黄芩炮制的方法有很多种,可以用蒸、煮、炒等方法得到炮制品[4],本文选用的炮制方法是将黄芩在温水中浸泡1h后,隔水蒸至上气时,取出晾干而得。
天然黄酮类化合物主要来自于植物中,是植物生长中的一种次级代谢产物,因其具有调节心脑血管系统、保护肝脏、抗炎、抗病毒以及可清除自由基、抗氧化、抗癌防癌等生理活性特点,已经被广泛的应用于食品、药品、化妆品等产业中[5~8]。因此如何从植物中提取出黄酮类物质以及如何提高提取率是目前国内外学者的研究重点。传统的提取黄酮的方法是以水为溶剂进行提取,这种方法存在收率低,生产周期长等问题[9]。本文采用乙醇为溶剂来提取黄酮,并对提取工艺进行优化,为黄芩中总黄酮提取的工业化生产提供理论依据。
1 材料与仪器
1.1 材料
药材:黄芩生品和炮制品(购于朔州);
试剂:芦丁(上海生化试剂二厂 生化试剂);95%乙醇(北京化工厂 分析纯);亚硝酸钠(天津市天大化工实验厂 分析纯);硝酸铝(北京化工厂 分析纯);氢氧化钠(北京化工厂 分析纯)。
1.2 仪器
电热恒温水浴锅(北京化玻联医疗器械有限公司);WFJ-2100型可见分光光度计(龙尼柯上海仪器有限公司);分析天平;烧杯;三角瓶;漏斗;移液管等。
2 试验方法
2.1 芦丁标准曲线的制作
准确称取芦丁标准试剂50mg,用30%乙醇溶解,定容至100mL,配制成浓度为0.5g·L-1的芦丁标准溶液。
分别取1.0mL、2.0mL、3.0mL、4.0mL、5.0mL、6.0mL 芦丁标准溶液于50mL容量瓶中,各加入5%NaNO2溶液1.5mL,摇匀,放置5 min后各加入10%Al(NO3)3溶液1.5mL,6min后再各加入1mol·L-1的NaOH溶液5.0mL,混匀,用30%乙醇稀释至刻度,10min后以30%乙醇溶液为参比溶液在500nm处比色测定[10],绘制的标准曲线见图1。
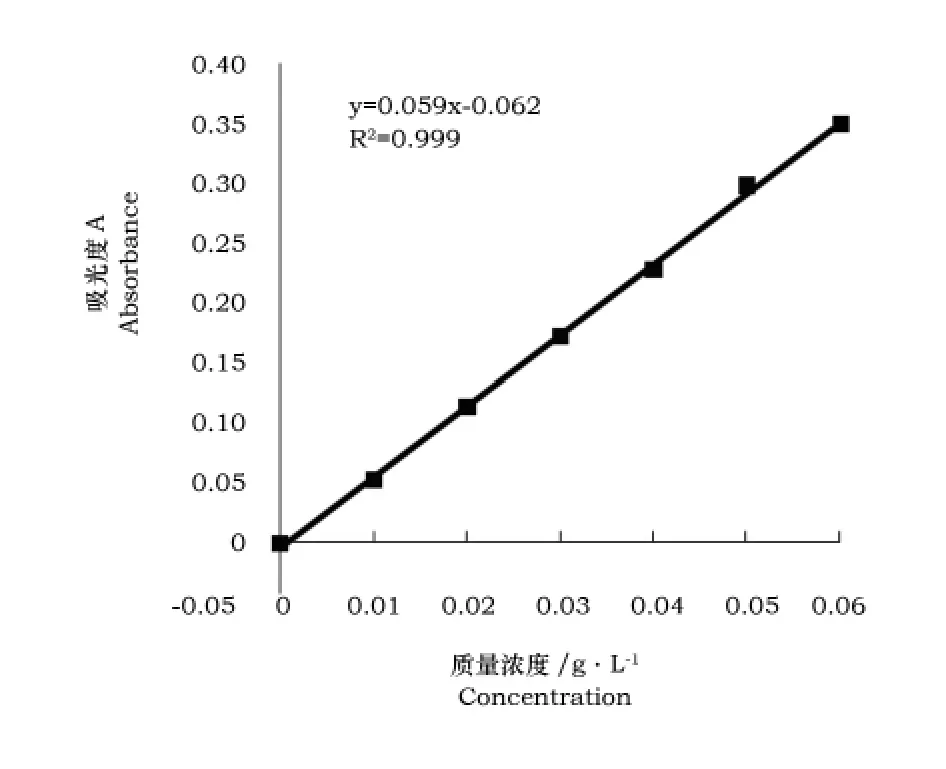
图1 芦丁标准曲线图Fig.1 Standard curve of rutin
2.2 黄芩中总黄酮的提取及其得率的测定
准确称取5g干燥黄芩置于圆底烧瓶中,加入一定量的乙醇溶液,在恒温水浴箱中加热回流2 h,趁热过滤,滤液定容至250mL的容量瓶中(即为待测的样液)。
取样品液2mL,移至50mL容量瓶中,加入5%NaNO2溶液1.5mL,摇匀,放置5min后加入10%Al(NO3)3溶液1.5mL,6min后再加入1 mol·L-1的NaOH溶液5.0mL,混匀,用30%乙醇稀释至刻度,10min后以30%乙醇溶液为参比溶液在500nm处测定吸光度。

式中:C-根据回归方程计算得到的芦丁浓度/g·L-1;V1-提取液体/mL;V2-稀释后提取液体积/mL;V3-待测液体积/mL;W-黄芩质量/g。
2.3 黄芩中总黄酮提取的单因素试验
2.3.1 不同乙醇浓度对总黄酮得率的影响
分别准确称取5g干燥黄芩生品置于5个圆底烧瓶中,加入浓度分别为55%,60%,65%,70%,75%的乙醇溶液60mL。在70℃恒温水浴箱中加热回流2h,趁热过滤,滤液定容至250mL的容量瓶中。炮制品试验方法同上。
2.3.2 不同提取时间对总黄酮得率的影响
分别准确称取5g干燥黄芩生品置于5个圆底烧瓶中,加入浓度为60%的乙醇溶液60mL,在70℃恒温水浴箱中分别加热回流1h、1.5h、2h、2.5h、3h。趁热过滤,滤液定容至250mL的容量瓶中。炮制品试验方法同上。
2.3.3 不同提取温度对总黄酮得率的影响
分别准确称取5g干燥黄芩生品置于5个圆底烧瓶中,加入浓度为60%的乙醇溶液60mL,分别在50℃,60℃,70℃,80℃,90℃恒温水浴箱中加热回流2h。趁热过滤,滤液定容至250mL的容量瓶中。炮制品试验方法同上。
2.3.4 不同料液比对总黄酮得率的影响
分别准确称取5g干燥黄芩生品置于5个圆底烧瓶中,分别加入浓度为60%的乙醇溶液50 mL,60mL,70mL,80mL,90mL使得料液比分别为1∶10、1∶12、1∶14、1∶16、1∶18,在70℃恒温水浴箱中加热回流2h。趁热过滤,将滤液进行旋转蒸发,浓缩到一定体积待测含量。炮制品试验方法同上。
3 结果与分析
3.1 黄芩中总黄酮提取的单因素试验结果
3.1.1 不同乙醇浓度下总黄酮量的得率
从图2可以看出,在实验浓度范围内随着乙醇浓度的升高,两种黄芩的总黄酮的得率都是先升高后降低,黄芩生品在乙醇浓度达到65%时,炮制品黄芩在乙醇浓度达到60%时,总黄酮得率达到最大值。主要原因是乙醇的浓度不同,极性也不同,随着乙醇浓度的升高,一些脂溶性物质的溶出增加,影响了总黄酮的浸出。
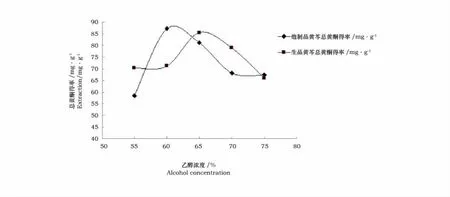
图2 乙醇浓度对提取量的影响Fig.2 Effect of ethanol concentration on the extraction capacity
3.1.2 不同提取时间下总黄酮的得率
从图3可以看出,随着提取时间的延长,总黄酮的得率先升后降,黄芩生品在2.5h时达到最大值,黄芩炮制品在2h时达到最大值。原因是时间过短,黄酮类物质还未充分溶出,时间在2.5h和2h时,总黄酮溶出已达到平衡,再延长提取时间,一些热敏性组分被破坏或提取时间过长溶剂挥发导致乙醇质量分数降低,使提取物质提取量下降。而炮制品提前达到最大值,有可能是因为炮制品黄芩是被处理过的,总黄酮物质容易溶出。
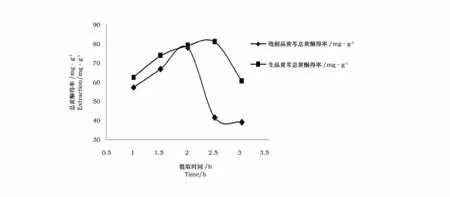
图3 提取时间对提取量的影响Fig.3 Effect of extraction time on the extraction capacity
3.1.3 不同提取温度下总黄酮的得率
从图4可以看出,随着温度的升高,黄芩生品中总黄酮的得率在50~70℃之间急剧上升,温度升高到80℃后缓慢下降,这说明70~80℃是黄芩生品总黄酮提取的最佳温度,相应黄芩炮制品总黄酮提取的最佳温度是65~75℃。当各自的温度继续升高后,分子运动速度加快,黄酮物质更容易从细胞中转移到溶液中,但温度过高,一些总黄酮物质被氧化破坏,总黄酮得率降低。
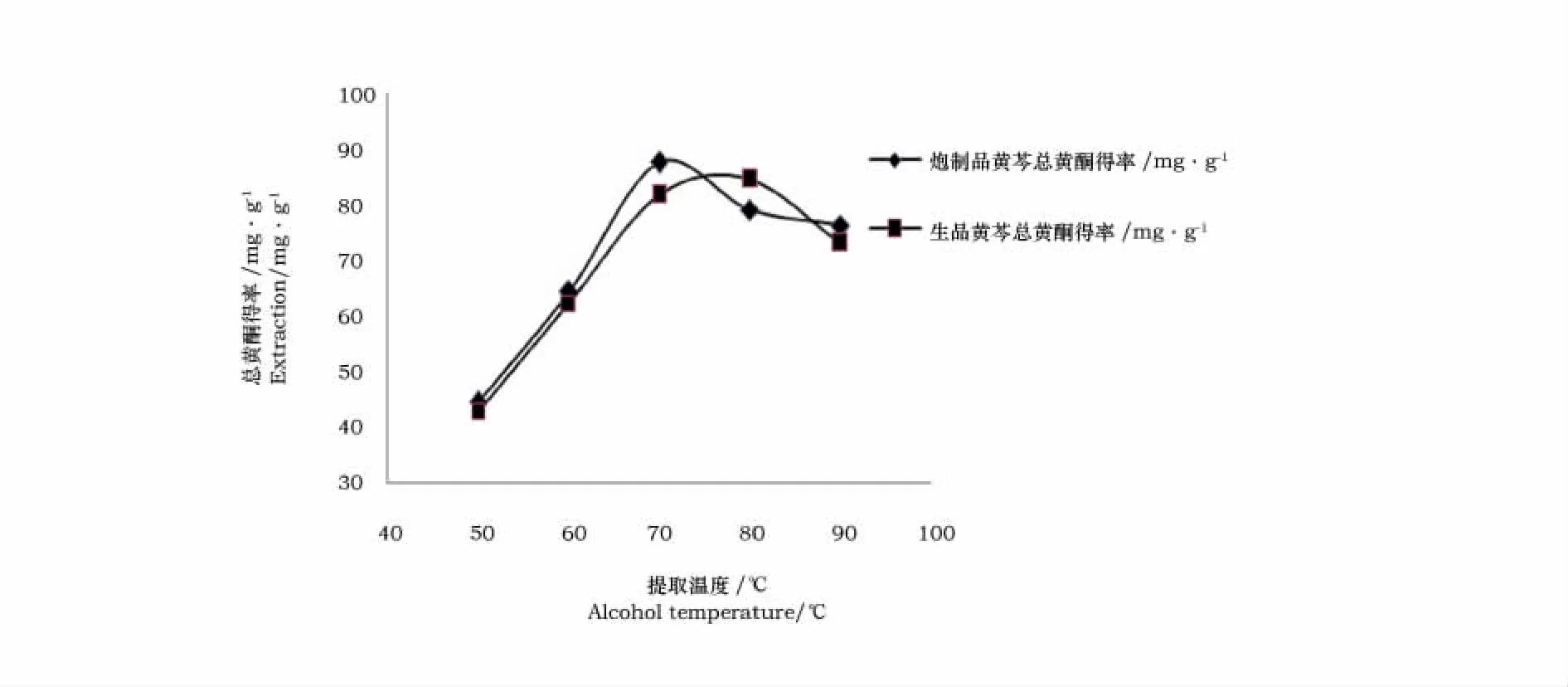
图4 提取温度对提取量的影响Fig 4 Effect of extraction temperature on the extraction capacity
3.1.4 不同的料液比下总黄酮的得率
从图5可以看出,黄芩生品和炮制品总黄酮得率都随着溶剂量的增加而增大。一般来说,溶剂体积越大,有效成分浸出越完全,得率越大,但在一定的乙醇体积下已将类黄酮基本溶出,再增大乙醇体积,黄酮物质的溶出量变化不大。会造成溶剂和能源的浪费,并且给后续的浓缩工作带来困难。因此,从降低成本角度综合考虑,确定黄芩生品和炮制品提取用乙醇体积为80mL即料液比为1∶16比较合适。
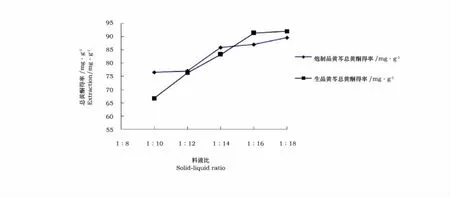
图5 料液比对提取量的影响Fig.5 Effect of solid-liquid ratio on the extraction capacity
3.2 黄芩中提取总黄酮的正交试验
3.2.1 黄芩生品提取总黄酮的正交试验设计
在单因素结果的基础上,选择因素和水平设计正交实验,见表1。
3.2.2 黄芩生品提取总黄酮的正交试验结果
由表2可见,实际最佳因素组合为A2B3C1D2,而理论最佳因素组合为A2B3C3D2,后经过验证试验确定最优组合为A2B3C1D2,即提取温度75℃,提取时间3h,乙醇质量分数65%,料液比1∶16。在此条件下,得率最高,可达92.48mg·g-1。各因素对提取的影响顺序依次为:乙醇浓度>提取时间>提取温度>料液比。
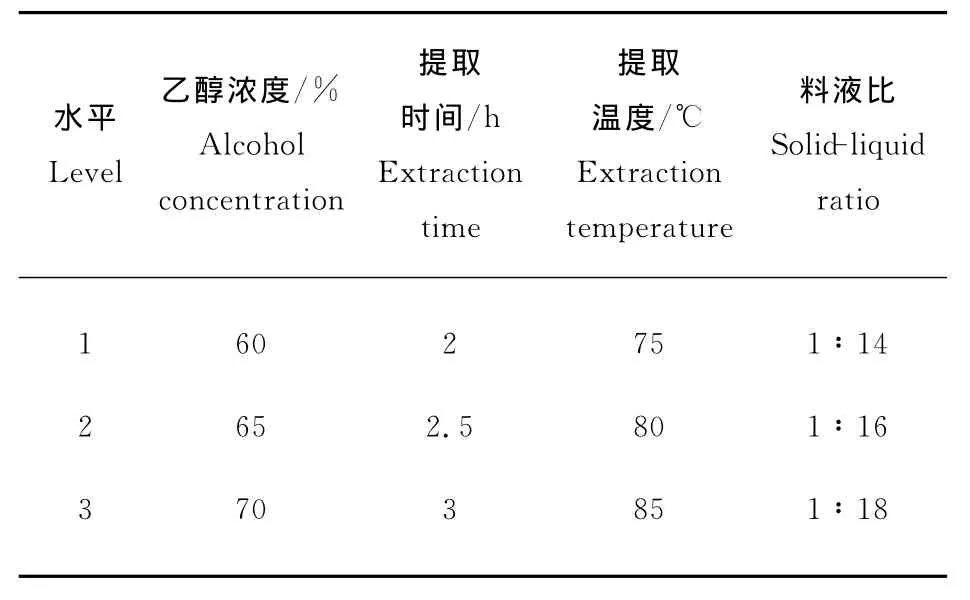
表1 因素水平表Table 1 The table of levels and factors

表2 正交试验设计与结果L9(34)Table 2 The orthogonal test design and results L9(34)
3.2.3 黄芩炮制品提取总黄酮的正交试验设计
在单因素结果的基础上,选择因素和水平设计正交实验,见表3。
3.2.4 黄芩炮制品提取总黄酮的正交试验结果
由表4可见,黄芩炮制品提取总黄酮的最佳因素组合为A1B2C2D2,即提取温度70℃,提取时间2h,乙醇浓度55%,料液比为1∶16。在此条件下提取量最高,可达90.97mg·g-1。各因素对提取的影响顺序依次为:提取时间>提取温度>乙醇浓度>料液比。

表3 因素水平表Table 3 The table of levels and factors
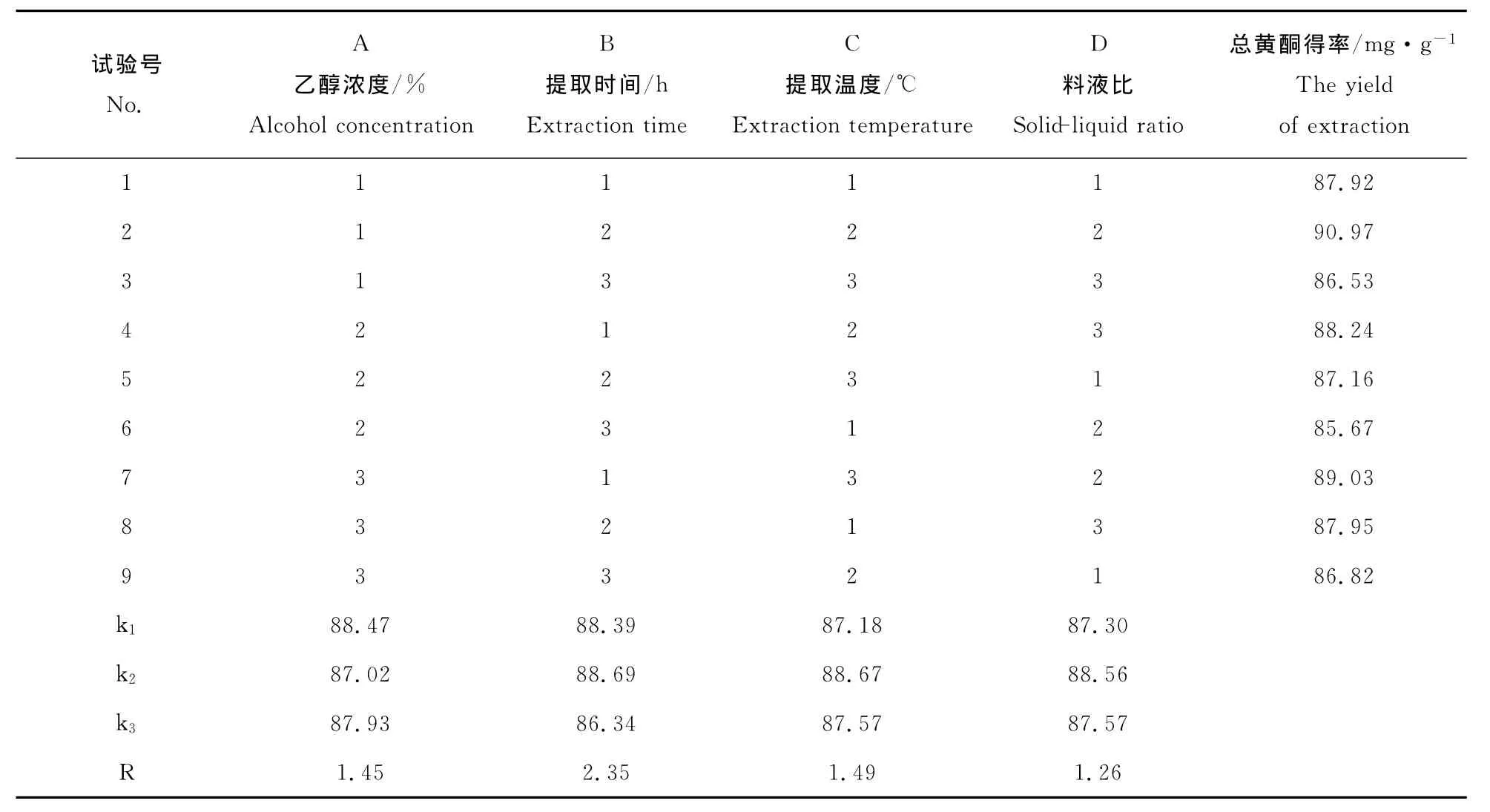
表4 正交试验设计与结果L9(34)Table 4 The orthogonal test design and results L9(34)
4 结论
本研究采用醇提的方法来提取黄芩生品和黄芩炮制品中的总黄酮。总黄酮的得率受到提取温度、提取时间、乙醇浓度、料液比的影响。通过单因素和正交试验确定了黄芩生品总黄酮的最佳提取工艺条件。在最佳提取工艺的条件下,黄芩生品中总黄酮的得率可达92.48mg·g-1,黄芩炮制品中总黄酮的得率可达90.97mg·g-1。说明黄芩富含黄酮类物质,用醇提法提取黄酮的效率也较高。这就为黄酮的提取工艺提供了理论依据,并为以后将天然黄酮类物质应用在医药等领域奠定了理论基础。
[1]徐珊,王乐,孟庆刚.黄芩抗病毒药理作用研究述评[J].中华中医药学刊,2007,25(7):55-57.
[2]王军民,韩丽琴,董顺福.黄芩中金属元素与总黄酮的含量测定[J].中国药房,2007,18(21):1641-1642.
[3]冯志强,韩坚,谢智勇,等.黄芩提取物中黄酮类成分血浆蛋白结合率的测定[J].中国药理学通报,2012,28(2):286-289.
[4]管美英.黄芩的炮制学研究[J].现代中药研究与实践,2003,17(1):63-64.
[5]杨洋.生姜黄酮的提取及抗氧化活性研究[J].食品科学,2002,23(4):45-50.
[6]汪秋安.天然黄酮类化合物的生理功能及其应用[J].香料香精化妆品,1999,20(1):28-33.
[7]刘淑梅,韩淑英,崔国金,等.甜荞麦叶总黄酮降糖降脂作用及机制[J].第四军医大学学报,2003,24(19):1815-1817.
[8]朱沛沛,李宁宁,梁晶,等.黄酮类化合物的组份及生物活性研究进展[J].饮料工业,2012,15(3):13-15.
[9]梁英,韩鲁佳,任成才,等.黄芩黄酮浸提工艺优化研究[J].中成药,2008,30(7):1068-1070.
[10]丁利君,吴振辉,蔡创海,等.金银花中黄酮类物质最佳提取工艺的研究[J].食品科学,2002,23(2):62-65.
