6个酿酒葡萄品种抗寒性比较
2013-09-19马小河唐晓萍董志刚赵旗峰李晓梅王敏任瑞
马小河,唐晓萍,董志刚,赵旗峰,李晓梅,王敏,任瑞
(山西省农业科学院 果树研究所,山西 太谷030801)
山西省地处黄土高原东部,境内土层深厚、海拔高、昼夜温差大、日照充足、降雨适中,具有生产优质葡萄的独特自然资源优势。从上世纪90年代后期开始,伴随我国葡萄种植和葡萄酒产业新一轮大发展,怡园酒庄、戎子酒庄、格瑞特酒业等葡萄酒生产企业相继落户山西,此外,太谷、灵石、长治等市县区域内的葡萄酒庄也在紧锣密鼓地筹建中。从基地建设成本、资源开发利用、浆果糖分积累等诸多因素综合考虑,新建酒庄葡萄基地多数规划在山地丘陵区,在有效降低生产成本,合理开发土地、旅游资源并收获优质原料的同时,也一定程度增加了葡萄遭遇冷、冻害天气的机率。因此,酿酒葡萄的品种选择及其抗寒性鉴定评价工作就显得尤为重要。
本试验以现阶段山西省6个主要酿酒葡萄品种为材料,应用电导法和恢复生长法相结合,对各品种间的抗寒性差异进行了比较、分析和评价,为酿酒葡萄栽培引种、规划布局工作提供借鉴;同时研究酿酒葡萄枝条丙二醛、脯氨酸含量在低温胁迫过程中的变化规律,探讨其与抗寒性的关系,为葡萄抗寒种质筛选和抗寒品种选育工作提供理论依据。
1 材料与方法
1.1 材料
试验材料由国家果树种质太谷葡萄资源圃提供,供试品种为赤霞珠、梅露辄、品丽珠、霞多丽、西拉和贵人香,2002年5月定植。采样日期为2011年10月20日(葡萄冬剪时),所选植株生长势、管理水平一致,架式为单篱架,栽植密度1.5m×2.5 m。每个品种随机选取5株树,采集粗度一致、充分成熟的1年生枝若干。将采集的枝条洗净,去离子水冲洗3次,截成20cm左右的小段,晾干、封蜡后,在4℃冰箱中贮存备用。
1.2 方法
1.2.1 冷冻处理
试验于2011年12月~2012年1月在山西省农业科学院果树研究所中心实验室进行。将每个品种枝条分成7份,其中1份作为对照(4℃),进行芽段萌发试验和相关理化指标的测定,其余6份按如下步骤进行低温处理。取其中1份放在超低温冰箱,降温至目的温度后,保持24h,之后逐步升温至4℃,保持2h后,开始相关指标的测定,升、降温度幅度均为5℃·h-1。试验设定4℃(对照)、-10℃、-15℃、-20℃、-25℃、-30℃和-40℃7个温度处理。
1.2.2 相对电导率测定
避开芽眼,将葡萄枝条剪成1~2mm的薄片,称取2g放入25mL刻度试管,每个处理重复3次。加20mL蒸馏水,真空泵抽气15min,摇匀后,在室温下静置8h,测定浸出液电导率值E1;将试管封口后,沸水浴15min,冷却至室温后,测定终电导率E2,同时测定蒸馏水的电导率E0。计算各品种处理相对电导率,计算公式[1]为,相对电导率/%=(E1-E0)×100/(E2-E0)。
1.2.3 恢复生长法
将对照和低温处理后的枝条,剪成5cm左右的芽段扦插于加热沙床,沙床温度25~28℃,30d后调查芽段萌发情况。芽段萌发率(%)=(萌发芽段总数/扦插芽段总数)×100。
1.2.4 相关抗寒理化指标测定
酿酒葡萄枝条丙二醛、脯氨酸含量的测定分别参照李合生[2]和乔富廉[3]的方法。丙二醛含量测定采用硫代巴比妥酸(TBA)显色法,脯氨酸含量测定采用酸性茚三酮显色法。
1.2.5 分析方法
试验所得数据用Excel软件进行整理,用SPSS16.0软件进行logistic方程拟合[4]、差异显著性和相关性分析。
2 结果与分析
2.1 低温胁迫中枝条相对电解质渗出率的变化
由图1可见,酿酒葡萄枝条电解质渗出率随温度的降低总体呈上升趋势,电解质渗出率变化近似呈“S”形曲线分布。温度开始下降时电解质渗出率缓慢增大,随着温度的继续下降,电解质渗出率增加很快,-30℃以后,电解质渗出率变化又趋于平缓。6个品种不同低温处理的电解质渗出率运用Logistc方程“S”曲线拟合后,相关系数R在0.9593~0.9990之间(图1),在抗寒性研究中,枝条电解质渗出率遵循Logistic方程的变化规律,拟合结果可靠,精确度较高。由公式t=lna/b[4]计算得到酿酒葡萄品种的半致死温度,结果见表1。根据半致死温度,得出供试品种的抗寒性顺序:霞多丽﹥赤霞珠﹥贵人香﹥西拉﹥梅露辄﹥品丽珠。
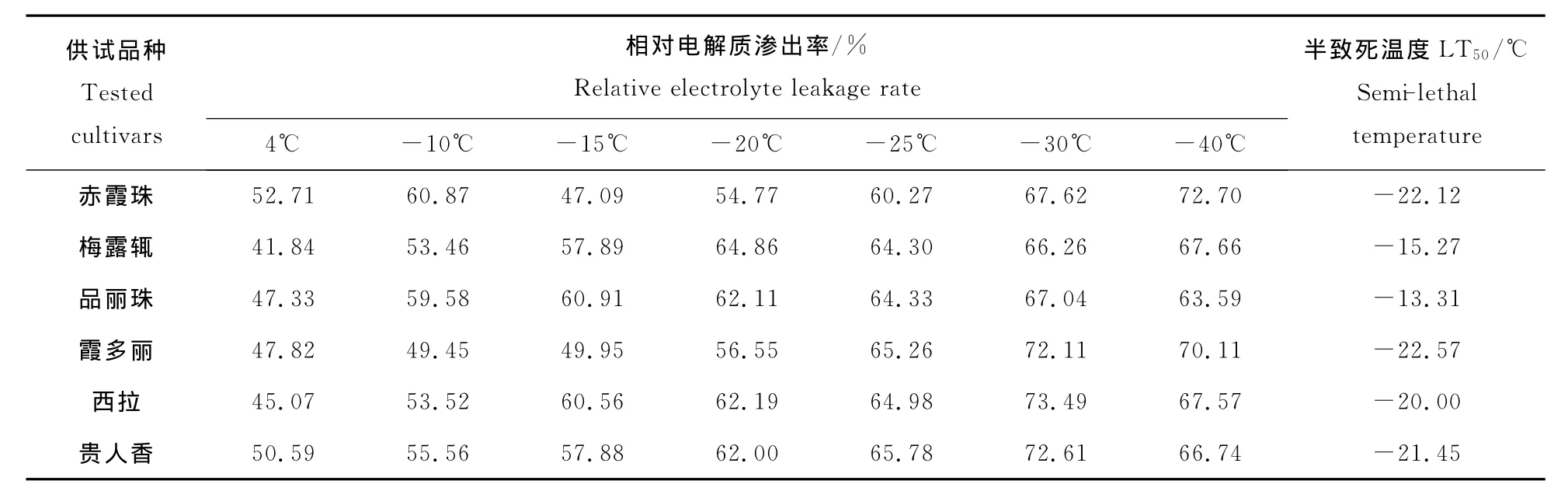
表1 枝条相对电解质渗出率变化与半致死温度(LT50)Table 1 Change of relative leakage rate of electrolyte of different cultivars under different low temperatures and semilethaltemperatures(LT50)
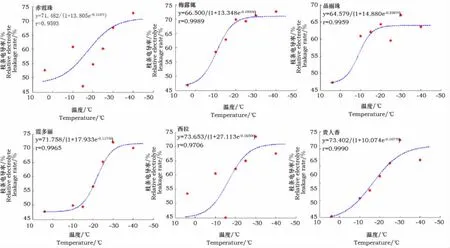
图1 不同温度下酿酒葡萄电解质渗出率拟合Logistic方程曲线Fig.1 Logistic equation indicating the relationship between the leakage ratio of electrolyte and low temperature
2.2 低温胁迫后芽段萌发率调查
枝条、芽段的萌发能力能够很直观地反映植物遭受冻害的严重程度。为检验Logistc方程拟合得到的半致死温度是否真实反映供试品种的抗寒能力差异,进行了酿酒葡萄枝条低温胁迫后芽段萌发率的调查统计。由表2可以看出,未经低温处理的各品种枝条芽段萌发率在90.67%~97.33%之间,说明供试枝条芽段的成熟度与营养物质积累均维持较高水平。-15℃处理后,各品种芽段受低温影响,萌发率出现大幅下降(47.33%~54.00%),霞多丽、贵人香枝段萌发率较高,梅露辄、品丽珠枝段萌发率较低,但品种间差异不显著。供试品种芽段在-20℃处理后,萌发率均下降到10%以下,枝段、芽体遭受严重伤害。赤霞珠、霞多丽的枝段萌发率均为8.67%,与其他品种差异显著,抗寒性表现好;梅露辄、品丽珠芽段萌发率分别为2.67%和3.33%,抗寒性表现差。以-20℃低温后枝段的萌发率来评价酿酒葡萄品种的抗寒力大小,抗寒性排序为:霞多丽 赤霞珠﹥西拉﹥贵人香﹥梅露辄﹥品丽珠,这一结果与根据半致死温度得到的品种抗寒性排序基本一致。

表2 低温胁迫对酿酒葡萄芽段萌发率的影响Table 2 Effects of low temperature stress on the germination rate of grapewine buds
2.3 低温胁迫中枝条相关抗寒理化指标的变化
2.3.1 低温胁迫下酿酒葡萄枝条丙二醛含量变化
由图2可见,梅露辄、西拉、霞多丽丙二醛含量在低温胁迫中变化剧烈,呈现“降—升—降”趋势,梅露辄、西拉丙二醛含量一直维持较高水平。品丽珠、赤霞珠、贵人香枝条的丙二醛含量变化较平缓。-20℃时,贵人香丙二醛含量为2.149μmol·g-1FW,与 梅 露 辄 (3.858μmol·g-1FW)、西 拉(3.606μmol·g-1FW)存在显著差异(P<0.05),其他品种间差异不显著。-20℃时枝条丙二醛含量与相对电解质渗出率显著正相关(R=0.843*),丙二醛含量与酿酒葡萄品种抗寒性的关系密切。

图2 低温胁迫下酿酒葡萄枝条丙二醛含量变化Fig.2 MDA content change of grapewine shoots under low temperature stress

图3 低温胁迫下酿酒葡萄枝条脯氨酸含量变化Fig.3 Proline content change of grapewine shoots under low temperature stress
3 结论与讨论
3.1 酿酒葡萄枝条抗寒性的比较
应用电导法配以Logistic方程估算植物组织的低温半致死温度,比较抗寒性差异,在多种植物
2.3.2 低温胁迫下酿酒葡萄枝条脯氨酸含量变化
由图3可见,酿酒葡萄脯氨酸含量低温胁迫中大体呈现“先升后降”的趋势。-10℃时脯氨酸含量相比对照无明显变化,-20℃时大幅增加,出现峰值,随着温度的继续降低,脯氨酸含量又总体大幅下降。低温胁迫中,赤霞珠、品丽珠脯氨酸含量增幅较大,分别为对照的5.86和5.27倍。梅露辄增幅很小,脯氨酸含量(74.12μg·g-1FW)仅为对照的1.379倍,显著低于其他品种(P<0.05)。-20℃时,各品种脯氨酸含量与根据电导法推测得到的品种抗寒性排序基本一致,但脯氨酸含量与相对电解质渗出率相关性未达显著水平。上得到应用,并取得良好效果[5~7]。在对葡萄属野生种、葡萄根系、品种的抗寒性研究中[8~11],此方法也得到广泛应用。本实验应用电导法和恢复生长法,对现阶段山西省主要酿酒葡萄品种的抗寒性进行了比较。根据电导法计算得到的半致死温度结合低温胁迫后芽段萌发率的调查结果,推断6个酿酒葡萄品种中,霞多丽、赤霞珠抗寒性较好,西拉、贵人香居中,梅露辄、品丽珠最差。这一结果与Mills[12]采用差热分析法(DTA)对部分酿酒葡萄抗寒性的研究结果基本一致。与许宏[8]应用电导法对相关酿酒葡萄的抗寒性排序基本吻合,但本试验中品种平均电解质渗出率比许宏[8]的研究结果偏低,Logistic方程拟合得到半致死温度偏高,这些差异可能是由试验材料、低温持续时间、薄片浸泡、煮沸的时间长短等原因引起。由此可见,应用电导法可以简单、快捷地分析葡萄品种间的抗寒性大小,但Logistic方程拟合得到半致死温度受试验取材、实验条件等多方面因素制约,与品种实际可忍受的低温极限值存在一定差异。
3.2 丙二醛、脯氨酸含量与抗寒性的关系
研究发现,植物处于逆境(干旱、SO2、低温)条件下,细胞内自由基的产生和清除平衡遭到破坏,自由基的增加首先会导致细胞膜系统的伤害,造成膜脂过氧化。膜脂过氧化最重要的产物丙二醛(MDA)可以扩散到其它部位,破坏体内多种反应的正常进行[13]。通过测定MDA含量的变化能够反映植物细胞发生膜质过氧化的剧烈程度和植物对逆境条件反应的强弱[14]。王华[15]、高志红[5]的研究表明,低温胁迫下MDA含量变化与抗寒性关系密切,MDA含量可以作为杏花、果梅种质抗寒鉴定的指标。供试酿酒葡萄丙二醛含量在低温胁迫中变化趋势略有差别,但丙二醛含量总体上表现为抗寒性较好的品种丙二醛含量较低,抗寒性较差的品种丙二醛含量维持在较高水平,这些结果与艾琳[16]对几种鲜食葡萄抗寒性研究中丙二醛含量的变化结果基本一致。不同温度处理时丙二醛含量差异显著性和相关性分析显示,在邻近半致死温度(-20℃)时,丙二醛含量与相对电解质渗出率显著正相关(R=0.843*),丙二醛可作为葡萄抗寒种质筛选、鉴定时一个比较可靠的理化指标。
脯氨酸在植物体内发挥重要的生理作用,许多研究表明,当植物组织遭受各种逆境胁迫后,体内游离脯氨酸含量会发生很大变化,因而把脯氨酸看作抗性氨基酸,并且认为它可作为抗性生理鉴定指标。牛立新等[17]研究认为,葡萄枝叶组织中游离脯氨酸含量随秋冬季温度的降低而升高,但不同种类游离脯氨酸含量及其变化与不同葡萄种类的抗寒性强弱关系较小,而与不同种类的冷冻锻炼有关。本试验中脯氨酸含量的动态变化大体呈现“先升后降”趋势,-30℃时脯氨酸含量的降低可能是由于枝条遭受严重冻害,细胞内相应的酶系统和代谢活动遭到破坏而导致。低温胁迫过程中,-20℃时酿酒葡萄脯氨酸含量与品种抗寒性排序比较吻合,但脯氨酸含量与相对电解质渗出率的相关性未达显著水平。因此,在葡萄抗寒性研究中,采用脯氨酸含量作为独立的鉴定指标还需要进行更加深入的研究,进一步得到试验数据的支持。
[1]郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2007:141-142.
[2]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-137.
[3]乔富廉.植物生理学实验分析测定技术[M].北京:中国农业科学技术出版社,2002:101-102.
[4]盖钧镒.试验统计方法[M].北京:中国农业出版社,2000:211-218.
[5]高志红,章镇,韩振海.果梅种质枝条抗寒性鉴定[J].果树学报,2005,22(6):709-711.
[6]周广生,梅方竹,周竹青,等.小麦不同品种耐湿性生理指标综合评价及其预测[J].中国农业科学,2003,36(11):1378-1382.
[7]王飞,李嘉瑞,陈登文.用电导法配合Logistic方程确定杏花期的抗寒性[J].西北农业大学学报,1997,25(5):59-63.
[8]许宏,王孝娣,邹英宁,等.葡萄砧木及酿酒品种抗寒性比较[J].中外葡萄与葡萄酒,2003(6):20-23.
[9]郭修武,傅望衡,王光洁.葡萄根系抗寒性的研究[J].园艺学报,1989,16(1):17-22.
[10]贺普超,牛立新.我国葡萄属野生种抗寒性的研究[J].园艺学报,1989,16(2):81-88.
[11]王文举,张亚红,牛锦凤,等.电导法测定鲜食葡萄的抗寒性[J].果树学报,2007,24(1):34-37.
[12]Lynn J Mills,John C Ferguson,Markus Keller.Cold-Hardiness evaluation of grapevine buds and cane tissues[J].Am J Enol Vitic,2006,57(2):194-200.
[13]陈贵,胡文玉,谢甫绨,等.提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J].植物生理学通讯,1991,27(1):44-46.
[14]曾韶西,王以柔,刘鸿先.低温下黄瓜幼苗子叶硫氢基(SH)含量变化与膜脂过氧化[J].植物学报,1991,33(1):50-54.
[15]王华,王飞,陈登文,等.低温胁迫对杏花SOD活性和膜脂过氧化的影响[J].果树科学,2000,17(3):197-201.
[16]艾琳.鲜食葡萄抗寒性研究[D].乌鲁木齐:新疆农业大学,2003.
[17]牛立新,贺普超.葡萄枝叶脯氨酸含量与其抗寒性关系的探讨[J].北方园艺,1989(6):16-17.
