越橘花色苷对血管内皮细胞微波辐射损伤的保护作用
2013-09-19朱文赫徐俊杰姜艳霞芦晓晶吕士杰
朱文赫,张 巍,李 妍,徐俊杰,姜艳霞,罗 军,芦晓晶,吕士杰
(吉林医药学院生物化学与分子生物学教研室,吉林 吉林 132013)
随着微波(频率300MHz~300GHz)技术的发展,微波在通讯家用电器工业和军事等领域的应用越来越广泛,人们受微波辐射的机会越来越多,潜在的危害不容忽视[1-3]。因此,研究辐射损伤防治手段,寻找积极有效的防治药物已成为一个急待解决的问题。从自然资源中寻找并提取有效的预防和治疗辐射的药物成分,从而研究开发抗辐射作用的药物是目前的主要研究方向[4]。越橘又称蓝莓果,属于杜鹃花科(Ericaceae)越橘属(Vaccinium.spp)多年生落叶或常绿灌木,在全世界广泛分布[5]。越橘果实中的主要成分花色苷是一种天然的抗氧化剂,具有抗氧化、清除自由基等多种功能[6],不仅抗氧化效果显著,且对人体无任何毒副作用。国内外有关越橘保护毛细血管、抗氧化、延缓脑神经衰老、增强记忆力、消除体内炎症和抗癌作用等方面的研究[7]报道较多。然而关于越橘提取物对微波辐射损伤保护作用的研究尚未见报道。为充分利用越橘植物资源,本研究提取野生种越橘中花色苷,对其抗微波辐射作用进行研究,旨在为越橘的综合利用和开发提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器 人脐静脉内皮细胞
EVC 304由吉林医药学院生物化学教研室保存,长白山野生笃斯越橘为8月份采收,于-80℃冰箱中保存备用;小牛血清购于杭州四季青公司,RPMI-1640培养液购于美国Gibco公司,MY8C-1型微波功率源(频率为2 450MHz)购于南京汇研微波系统工程有限公司,550酶标仪购于美国Bio-Rad公司;UV-4802型紫外可见分光光度计购于上海UNICO仪器有限公司,RE-52AA旋转蒸发器购于上海亚荣生化仪器厂,SHZ-D型循环水式多用真空泵购于巩义市予华仪器有限责任公司,TGL-16G台式高速离心机购于上海安亭科学仪器厂。
1.2 越橘花色苷的制备 越橘花色苷制备参照文献[8]的方法,取出冷冻保存的长白山笃斯越橘,研磨至匀浆状,按1∶5比例加入95%乙醇和1.5mol·L-1HCl(85∶15)作为溶剂进行微波辅助提取,用真空抽滤去残渣,采用旋转蒸发仪浓缩花色苷提取液。采用pH示差法[9]测定花色苷质量分数,取1.0mL样品提取液,分别用pH 1.0和4.5的缓冲液定容至10mL,室温下放置15min,以蒸馏水作参比,用分光光度计在450~700nm波长间扫描最大吸收峰,并测定在最大吸收峰处和700nm处的吸光度(A)值,计算花色苷的质量分数。花色苷质量分数C(mg·g-1)=A×V×n×M/(ε× m)A =(Amax-A700)pH1.0-(Amax-A700)pH4.5Amax分别为pH 1.0和4.5时花色苷在最大吸收峰处的A值;V为提取液总体积(mL);n为稀释倍数;M 为矢车菊-3-葡萄糖苷(Cy-3-Glu)的相对分子质量(449);ε为Cy-3-Glu的消光系数(29 600),m为样品质量(g)。
1.3 EVC 304细胞增殖抑制率的测定 将人脐静脉内皮细胞EVC 304培养于含10%小牛血清的DMEM培养液中,置于37℃、5%CO2饱和湿度的细胞培养箱中培养。每2d更换培养液1次,待细胞长满至培养瓶底,以0.25%胰酶消化传代。取对数生长期细胞进行实验,调整细胞密度为1×105mL-1,接种于96孔孔板,每组设5个复孔。分成对照组、微波辐照组和花色苷组,花色苷组细胞分别加入25、50和100mg·L-1花色苷,24h后,微波辐照组和花色苷组细胞以强度为20mW·cm-2的2 450MHz微波辐射20min,对照组细胞不做任何处理。分别于6、12、18和24h进行MTT实验。弃掉培养液,每孔加入200μL新配制的终浓度为0.5g·L-1MTT溶液,37℃孵育4h,小心吸弃孔内液体,每孔再加入DMSO 150μL,振荡10min,选择490nm在酶标仪检测各孔A值,按公式计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.4 流式细胞术检测细胞周期 将培养的EVC 304细胞以1×105mL-1的密度接种于6孔板,每
组设3个复孔,分成对照组、微波辐射组和花色苷组,花色苷组细胞分别加入浓度为25、50和100mg·L-1花色苷,24h后,微波辐照组和花色苷组细胞以强度为20mW·cm-2的2 450MHz微波辐射20min,对照组不做任何处理。微波辐射作用后24h,收集细胞,PBS洗2次,75%冷乙醇固定,上机前离心弃乙醇,PBS洗2次,重新悬浮于1mL PBS,加入 RNase(100mg·L-1)10μL,5g·L-1碘化乙啶(PI)染色剂10μL,避光染色20min,采用流式细胞术检测细胞周期变化。
1.5 EVC304细胞的caspase-3活性检测 将对数生长期的细胞分成对照组、微波辐射组和花色苷组,处理方法同1.4所述。培养24h收集细胞,以细胞裂解液裂解,10 000r·min-1离心15min,取上清,用Bradford法测定蛋白浓度。向上清中加入caspase-3底物,37℃孵育60min,测定A405值,根据标准曲线计算caspase-3的活性。
1.6 统计学分析 采用SPSS 13.0统计软件进行数据处理。细胞增殖抑制率以(±s)%表示,各细胞周期细胞比例和caspase-3活性均以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 越橘花色苷的鉴定 紫外分光光度仪测定所提取的越橘花色苷的最大吸收波长为520nm,符合花色苷类物质在可见光区520~560nm范围内有最大吸收光谱的特点。在最优提取条件下花色苷的产量达到了0.402mg·g-1(湿重)。越橘花色苷的吸收光谱见图1。
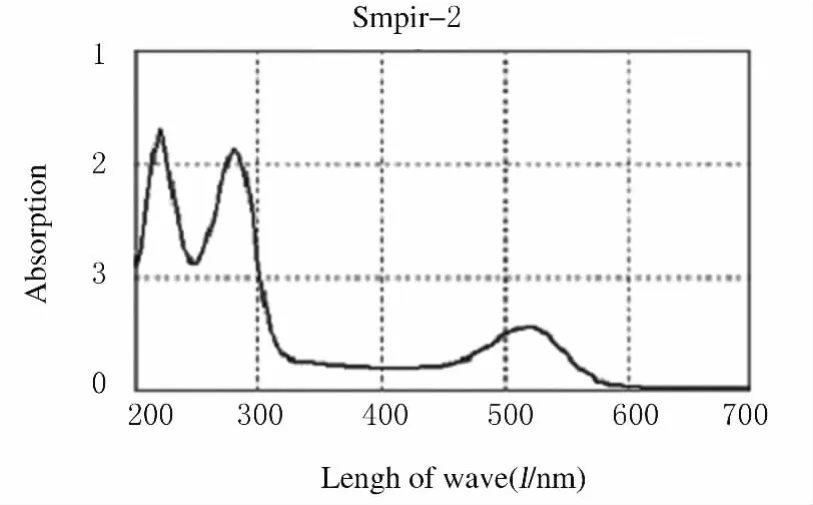
图1 越橘花色苷的吸收光谱图Fig.1 Absorption spectrum of Bilberry anthocyanidin
2.2 各组EVC304细胞增殖抑制率 微波辐射后6~24h,受辐射后的各组细胞增殖活性均受到不同程度损伤,20mW·cm-2微波辐射在24h内使细胞增殖抑制率变化为8.4%~58.6%。而在25、50和100mg·L-1的浓度范围内,越橘花色苷能够有效地提高细胞的增殖活性,并呈现一定的剂量-效应关系。在100mg·L-1的浓度时,EVC304细胞增殖活性显著提高,24h细胞增殖抑制率降至30.5%。见表1。对照组细胞呈扁平状,长梭形、多角形或椭圆形镶嵌状排列,细胞边界清晰,大小均匀,细胞丰满,胞核居中,无重叠生长现象。微波辐射组细胞出现收缩、变圆、体积变小,细胞间隙增宽,大部分细胞有破碎、脱落的现象。不同剂量花色苷组细胞形态比微波辐射组有所改善。见图2。
2.3 各组EVC304细胞周期和细胞凋亡率 经过微波辐射后,EVC304细胞表现为S期细胞比例降低,G2/M期细胞比例增多,凋亡细胞比例增加。
表1 不同时间各组EVC304细胞增殖抑制率Tab.1 Inhibitory rates of proliferation of EVC304cells at different time in various groups [η/(±s)%]
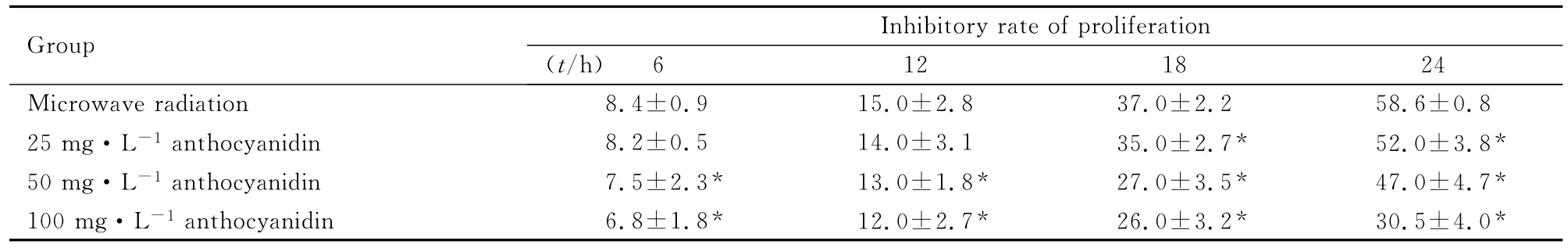
表1 不同时间各组EVC304细胞增殖抑制率Tab.1 Inhibitory rates of proliferation of EVC304cells at different time in various groups [η/(±s)%]
* P<0.05 vs microwave radiation group.
Group Inhibitory rate of p.2 58.6±0.8 25mg·L-1 anthocyanidin 8.2±0.5 14.0±3.1 35.0±2.7* 52.0±3.8*50mg·L-1 anthocyanidin 7.5±2.3* 13.0±1.8* 27.0±3.5* 47.0±4.7*100mg·L-1 anthocyanidin 6.8±1.8* 12.0±2.7* 26.0±3.2* 30.5±4.0 6 12 18 24 Microwave radiation 8.4±0.9 15.0±2.8 37.0±2 roliferation(t/h)*
25、50和100mg·L-1花色苷组G1/G0期细胞比例高于对照组和微波辐射组(P<0.05)。而微波辐射后加入不同浓度的越橘花色苷对损伤的EVC304具有明显的修复作用,25、50和100mg·L-1花色苷组细胞凋亡率明显下降,与微波辐射组比较差异有统计学意义(P<0.05)。见表2。

图2 各组EVC304细胞形态学(×400)Fig.2 Morphology of EVC 304cells in various groups(×400)
表2 各组EVC304细胞周期和凋亡率Tab.2 Cell cycle and apoptotic rates of EVC304cells in various groups [η/(±s)%]

表2 各组EVC304细胞周期和凋亡率Tab.2 Cell cycle and apoptotic rates of EVC304cells in various groups [η/(±s)%]
* P<0.05 vs control group;△P<0.05 vs microwave radiation group.
Group Percentage of EVC304cells G1/G0 S G2/M Apoptosis ratio 61.7±1.1 20.4±2.2 14.5±2.8 2.9±0.2 Microwave radiation 56.8±1.5* 15.2±1.7* 13.1±2.7 14.9±2.3*25mg·L-1 anthocyanidin 66.1±2.1*△ 14.2±1.6* 13.6±1.3* 6.1±1.3*△50mg·L-1 anthocyanidin 66.3±1.4*△ 15.3±1.2* 14.1±2.6△ 4.2±1.9*△100mg·L-1 anthocyanidin 68.4±1.9*△ 13.3±1.4*△ 14.5±0.8△ 3.5±0.8 Control△
2.4 各组EVC304细胞caspase-3活性 EVC304细胞经过微波辐射后,由于细胞发生凋亡,caspase-3 活性变为 0.458,明 显高于对照 组(0.245) (P<0.05)。而微波辐射后加入25、50和100mg·L-13个浓度的越橘花色苷,细胞的 caspase-3 活 性 分 别 降 至 0.407、0.388 和0.285,与微波辐射组比较明显下降(P<0.05)。
3 讨 论
花色苷是越橘果实中的主要成分,具有抗氧化、抗突变、预防心血管疾病、抗疲劳、抗衰老和抗辐射等功能,在食品和医药方面显示出潜在的应用潜力[10-11]。目前,美国和日本将越橘提取物做成锭剂胶囊和颗粒等保健食品,北欧一些国家将野生越橘制成药品,且很多药品均已商品化。虽然我国有丰富的越橘资源,但是缺少高附加值的越橘产品,因此对越橘花色苷的功能产品的开发极具市场应用价值。提取是分离纯化和利用花色苷的重要环节,本研究为了提高花色苷的产量,选择了微波辅助提取法,在最优提取条件下使得花色苷的产量达到了0.402mg·g-1(湿重)。微波具有选择性高、加热效率高和对植物细胞破壁能力强等特点,在分析方面体现了操作简便、快速和高效的优点,在实际生产过程中具有安全、节能的潜力。
越橘花色苷具有抗辐射作用[12-14],但是关于这方面的具体研究并不多。本研究探讨了越橘花色苷对血管内皮细胞EVC 304辐射损伤的保护作用,为越橘花色苷今后作为抗辐射药物的研究奠定了基础。本研究结果表明:20mW·cm-2强度微波辐射EVC 304细胞20min,微波辐射作用后24h,细胞的增殖活性受到明显的抑制,增殖抑制率达到58.6%。而花色苷组细胞增殖活性明显提高,100mg·L-1的浓度时,微波辐射对EVC 304细胞增殖抑制率为30.5%,说明越橘花色苷对细胞辐射损伤具有一定的保护作用。倒置显微镜下观察细胞形态,结果显示:辐射损伤组细胞出现收缩、变圆和体积变小,细胞间隙增宽,大部分细胞出现破碎、脱落的现象。不同剂量的花色苷组细胞形态比微波辐射组有所改善。
本实验观察微波辐射后EVC 304细胞周期的变化发现:微波辐射后凋亡是细胞死亡的主要形式,而花色苷组细胞的凋亡率明显下降,G2/M期细胞比例高于微波辐射组,但并不明显。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡[15-16]。caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中caspase-3为关键的执行分子,在凋亡信号传导的许多途径中发挥功能[17-19]。在凋亡的早期阶段被激活,可裂解相应的胞质胞核底物,执行凋亡功能。本研究实验结果表明:微波辐射组细胞的caspase-3活性升高,说明细胞发生了凋亡,而微波辐射组与花色苷组比较细胞活性明显降低,进一步说明越橘花色苷对辐射损伤细胞有保护作用,但是对微波辐射的保护机制尚需进一步的深入研究。
综上所述,花色苷是越橘果实的主要成分,通过微波辅助的方法能够提高花色苷的提取产率,为进一步深入研究其活性奠定了物质基础。此外,对EVC304细胞的辐射保护作用也证明了越橘花色苷在辐射保护中的作用,结合提取工艺,可为越橘花色苷的开发利用提供理论依据。
[1]Lu HH,Zhou J,Xiong SB,et al.Effects of low-intensity microwave radiation on Tribolium castaneum physiological and biochemical characteristics and survival[J].Insect Physiol,2010,56(9):1356-1361.
[2]Kesari KK, Behari J. Microwave exposure affecting reproductive system in male rats [J]. Appl Biochem Biotechnol,2010,162(2):416-428.
[3]Monika AG,Sarah H,Hugues BM.Community structure of ericoid mycorrhizas and root-associated fungi of Vaccinium membranaceum across an elevation gradient in the Canadian Rocky Mountains[J].Fungal Ecol,2012,5(1):36-45.
[4]Srinivasan M,Sudheer AR,Rajasekaran KN,et al.Effect of curcumin analog on gamma-radiation-induced cellular changes in primary culture of isolated rat hepatocytesinvitro[J].Chem Biol Interact,2008,176(1):1-8.
[5]樊梓鸾,王振宇,程翠林,等.5种野生浆果的抗氧化和抗细胞增殖活性 [J].食品科学,2010,31(17):148-152.
[6]李颖畅,孟宪军.蓝莓叶黄酮提取物抗氧化活性的研究 [J].营养学报,2008,30(4):427-429.
[7]Kong JM,Chia LS,Goh NK,et al.Analysis and biological activities of anthocyanins [J]. Phytochemistry,2003,64(5):923-933.
[8]朱文赫,徐俊杰,张 巍,等.长白山笃斯越橘中花色苷不同提取工艺的研究 [J].食品研究与开发,2012,33(4):59-62.
[9]Fuleki T,Francis FJ.Quantitative methods for anthocyanins I extraction and determineation of total anthocyanins in cranberryies[J].J Food Sci,1968,33(1):72-77.
[10]姜艳霞,芦晓静,徐俊杰,等.越橘花色苷对宫颈癌细胞凋亡及抗氧化能力的影响 [J].上海中医药杂志,2011,45(9):62-65.
[11]李颖畅,李冰心,孟良玉,等.圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性 [J].食品科学,2012,33(9):105-109.
[12]Remberg SF,Wold AB,Kvaal K,et al.An approach towards rapid optical measurements of antioxidant activity in blueberry cultivars [J].J Appl Bot Food Qual,2012,80(1):36-39.
[13]Bowen-Forbes CS,Zhang YJ, Nair MG. Anthocyanin content, antioxidant, anti-inflammatory and anticancer properties of blackberry and raspberry fruits [J].J Food Compos Anal,2010,23(6):554-560.
[14]Zafra-Stone S, Yasmin T, Bagchi M, et al. Berry anthocyanins as antioxidants in human health and disease prevention[J].Mol Nutrit Food Res,2007,51(6):675-683.
[15]李 超,伏圣博,刘华玲,等.细胞凋亡研究进展 [J].世界科技研究与进展,2007,29(3):45-53.
[16]Rothstein EC,Lucchesi PA.Redox control of the cell cycle:A radical encounter [J].Antioxid Redox Signal,2005,7(5/6):701-703.
[17]Shaughnessy DT, Setzer RW, DeMarini DM. The antimutagenic effect of vanillin and cinnamaldehyde on spontaneous mutation in Salmonella TA104is due to a reduction in mutations at GC but not AT sites[J].Mutat Res,2001,55(1):480-481.
[18]Alkhalaf M,El-Mowafy A,Renno W.Resveratrol induced apoptosis in human breast cancer cells is mediated primarily through the caspase-3-dependent pathway [J].Arch Med Res,2008,39(2):162-168.
[19]Somasekharan SP,Koc M, Morizot A,et al.TRAIL promotes membrane blebbing,detachment and migration of cells displaying a dysfunctional intrinsic pathway of apoptosis[J].Apoptosis,2013,18(3):324-336.
