番茄突变体jai1-1高效筛选—再生体系的建立
2013-09-19范锡麟王少岭肖应辉王志龙
范锡麟,王少岭,肖应辉,王志龙
(湖南省作物种质创新与资源利用重点实验室/湖南农业大学农学院,长沙410128)
番茄是茄科(Solanaceae)番茄属(Lycopersicon)植物,其分布广泛,营养丰富,是一种重要的经济作物。一方面由于各种病虫害的发生,不同程度地影响着番茄的品质和产量,甚至造成巨大的经济损失[1];另一方面,番茄基因组较小、遗传背景清楚、突变体材料丰富、易于遗传转化,是果实发育生物学研究的模式植物。研究发现,COI1基因编码一个F-box蛋白,是茉莉酸甲酯(MeJA)的受体,与Skp1-Cullin-Rbx1相互作用构成SCF复合物,参与植物胚胎发育、性别决定[2]、植物与病原菌的互作[3]、自交不亲和性[4]、细胞凋亡[5,6]、光信号途径及植物激素信号转导。拟南芥中COI突变体coi1-1对Me-JA不敏感,表现为花粉活力降低而导致雄性不育,并对病原菌的侵染易感,研究还发现COI1基因的异位表达能部分恢复花粉育性[7,8];而番茄 COI1相似基因JAI1的突变体jai1-1表现为腺毛发育不全,花粉活力降低并表现出雌性不育,对棉叶螨敏感以及依赖于JA的基因表达的功能缺陷[9]。通过比对分析番茄、大豆、拟南芥和水稻中COI1同源基因的蛋白序列,发现其有很高的同源性,这暗示了COI1基因在进化上的保守性。实验室已克隆得到了大豆、番茄、拟南芥和水稻中的COI1同源基因,并构建了一整套用于研究COI1功能及信号通路的相关植物表达载体,通过农杆菌介导的方法转化番茄jai1-1突变体,希望从第三方的角度来了解基因在植物进化中的共性和特异性。本实验拟建立番茄突变体jai1-1的高效筛选—再生体系,以提高农杆菌介导的遗传转化效率,为后续番茄的遗传育种和功能研究奠定基础。
1 材料与方法
1.1 实验材料
番茄野生型JAI1和含有突变体jai1-1的F2种子均由本实验室提供。
1.2 方法
1.2.1 种子消毒
用浓度75%酒精消毒1 min,无菌水冲洗2次。再将种子用浓度为10%(m/v)的Ca(ClO)2溶液灭菌20 min。无菌水冲洗4~5次,无菌滤纸吸干后接种于1/2 MS固体培养基中。
1.2.2 培养条件
将接种好的种子和子叶及下胚轴置于组培室中,26℃恒温培养,光照强度为2 000~2 500 lx,光周期为14 h。
1.2.3 jai1-1突变的筛选
待种子萌发至约1 cm时,转移至含有不同浓度JA(茉莉酸)的1/2 MS固体培养基中进行筛选,5 d后选取根部能正常生长的种子重新接回不添加任何激素的1/2 MS固体培养基中,作为进一步实验的材料,其他种子直接种植于营养土中。
1.2.4 愈伤组织的诱导及不定芽的分化
以番茄幼嫩子叶和下胚轴作为实验材料。在第1片真叶长出前,切去番茄子叶的尖端和底部,将子叶二分,切成约0.5 cm×0.5 cm的外植体,子叶上表皮朝下倒置接种于诱导培养基中[10];下胚轴中段切成约1 cm的长度,接种于不同激素组合的诱导培养基中(表1),每个培养皿接种10个,每种培养基接 3 个重复,每隔两周进行一次继代培养[11,12],30 d后观察并记录实验结果。
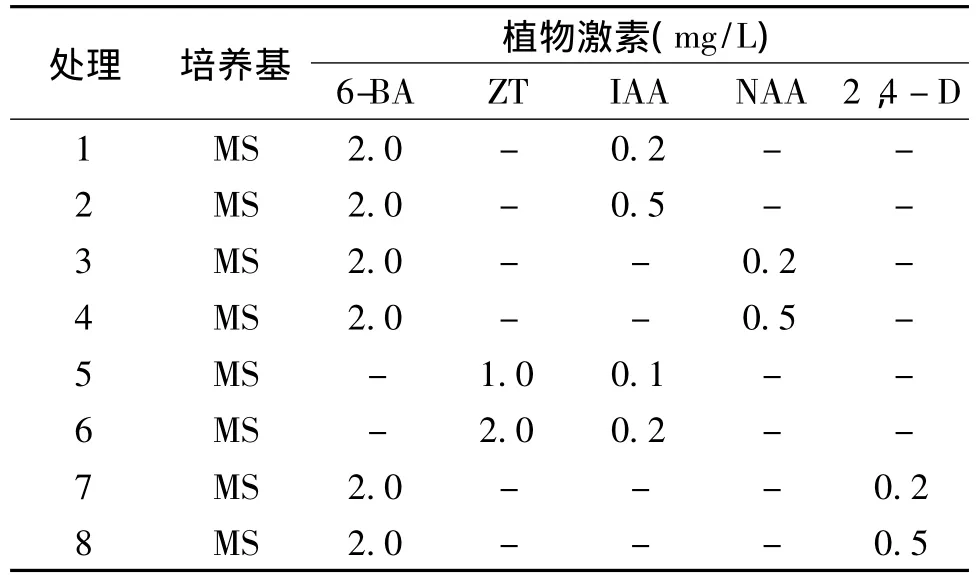
表1 不同处理的诱导培养基激素组合
1.2.5 不定根的诱导
待幼芽长至2.0~3.0 cm,3~4片叶时,选取长势良好,生长健壮的芽体,切除基部愈伤组织及培养基,转接至添加有不同激素组合的生根培养基中诱导生根(表5),每瓶接种4~5个幼芽,一周后观察并记录实验结果。
1.2.6 试管苗移栽
待试管苗根系发达,长至6~8 cm高时,打开瓶口,保湿后置于组培室中。5~7 d后取出试管苗,洗去根部残余培养基后移栽到装有营养土的花钵中,浇适量水待其正常生长成植株。
1.2.7 基因型鉴定
采用CTAB法提取经组织培养形成植株的番茄叶片DNA,设计基因特异性引物PCR,鉴定不同浓度MeJA对jai1-1突变体的筛选效果[9]。
F1:5'- GTGGAGACGATATGTTGAGACTAA-3'
F2:5'- CCATGGAGTCCATCACCTAACAGT-3'
F3:5'- GTGGTCAGATCAGAGCCCTCTATT-3'
分别以F1、F2和F1、F3为引物,以基因组DNA为模板进行PCR扩增。10 μL PCR反应体系:DNA 1 μL,上游引物(10 μM)1 μL,下游引物(10 μM)1 μL,10 × Buffer 1 μL,dNTPs 0.2 μL,rTaq 0.1 μL,ddH2O 5.7 μL。
反应程序为:95℃预变性5 min;每个循环条件为:95℃变性 30 s,56℃退火 30 s,72℃延伸 45 s,共进行35个循环;72℃终延伸10 min;反应结束于16℃保存。PCR产物用1%琼脂糖电泳检测。
2 结果与分析
2.1 不同MeJA浓度对jai1-1突变体的筛选
由于番茄jai1-1突变体表现为雌性不育而不能正常结实,因此只能从F2群体中分离得到。以JAI1种子作为对照组,在不添加MeJA的1/2 MS固体培养基中,全部种子都能正常生长;以F2群体种子作为实验组,一部分不经过MeJA处理,发现其能够正常生长;另一部分用不同浓度MeJA处理,发现只有极少数种子对MeJA不敏感,其生长不受影响,表现出与对照组一致的生长状态,其基因型应为jai1-1;而大部分种子的生长都受到明显抑制,具体表现为下胚轴和子叶较正常组短小,胚根基部呈紫红色,生长缓慢,其基因型应为JAI1和JAI1/jai1-1。其中,实验组在含100 μM/L MeJA的筛选培养基中,抑制效果最为明显,后将其转移至诱导培养基中,发现愈伤组织的诱导和不定芽的分化都明显低于其他组合。
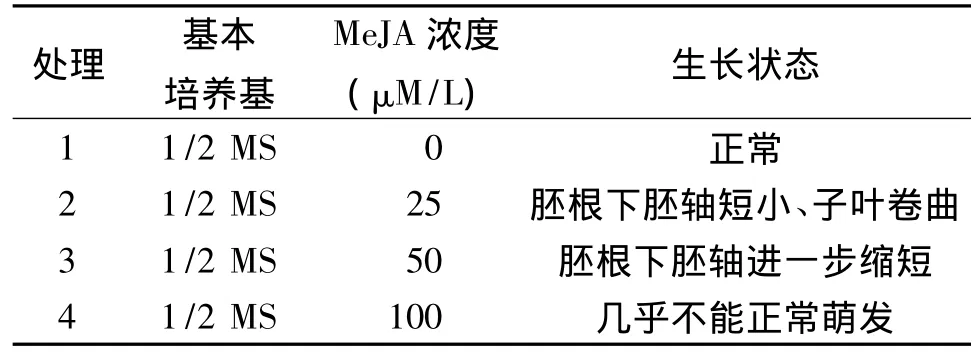
表2 不同MeJA浓度对jai1-1的筛选效果
2.2 不同诱导培养基对愈伤组织诱导的影响
JAI1和jai1-1 两个番茄品种的子叶和下胚轴在表1所列的诱导培养基中都能诱导出愈伤组织。下胚轴在7 d左右可形成愈伤组织,且下胚轴诱导的愈伤组织增殖旺盛,生长快。实验发现,下胚轴诱导的愈伤组织表现出明显的极性,形态学上端的愈伤组织出现早,生长快,分裂旺盛;形态学下端的只形成少量愈伤组织,且生长缓慢,几乎不进行增殖分化。其中,处理7和处理8中诱导的愈伤组织生长最快,组织致密,呈白色或乳白色,经继代培养后只进行分裂增殖并逐渐褐化,丧失进一步的分裂生长能力。其他激素组合的培养基中诱导的愈伤组织生长相对较慢,组织较稀疏,经继代后表面逐渐形成绿色颗粒状突起,进一步分化出不定芽并形成完整的植株。
2.3 不同激素组合及不同外植体对不定芽分化的影响

表3 不同激素组合诱导子叶不定芽分化率的比较
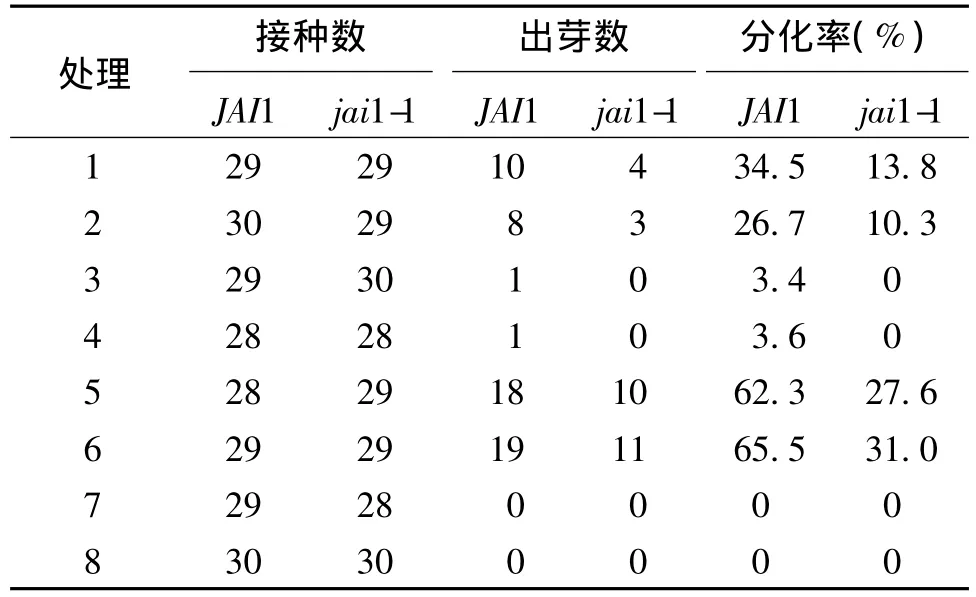
表4 不同激素组合诱导下胚轴不定芽分化率的比较
实验发现,不同类型番茄外植体对不定芽的分化有显著影响。其中,下胚轴诱导的愈伤组织比子叶生长的快,但不定芽分化率低(表3和表4)。其中部分芽体生长慢,畸形芽比例高,失去进一步的分化能力。含2,4-D(处理7和处理8)培养基中诱导的愈伤组织经继代后表面形成白色的致密组织,生长极其缓慢,无法分化出不定芽。继代时将2,4-D变换为IAA或NAA,愈伤组织逐渐褐化死亡,无不定芽的分化。有研究认为2,4-D能强烈抑制胚胎发生的基因程序表达[13,14],降低内源IAA的含量,抑制不定芽的分化。在含有ZT和IAA以及6-BA和IAA组合的培养基中,愈伤组织的诱导率都接近100%,且6-BA和IAA的激素组合形成愈伤的速度较ZT和IAA组合快,但后期的分化率较低,并表现为明显的时序性,即先形成大量愈伤,再在愈伤组织表面形成绿色组织,进一步形成芽原基直至分化出不定芽。而ZT和IAA组合愈伤组织的诱导和不定芽的分化几乎是同步的,在形成少量愈伤组织的同时就会诱导不定芽的分化,且芽体生长速度快,畸形芽比例低。而下胚轴不定芽的诱导表现出明显的极性,形态学上端不定芽分化早,生长快;形态学下端愈伤生长缓慢,几乎不诱导形成不定芽。相同条件下子叶诱导不定芽的效率明显高于下胚轴,且分化系数较高,芽体生长较快,畸形芽比例较低。另外,激素诱导愈伤组织和不定芽分化也表现出一定的基因型依赖性[15,16]。jai1-1子叶和下胚轴诱导愈伤的生长速度明显慢于JAI1,芽体数量、分化率也明显低于JAI1。在继代培养过程中有的芽体因畸形芽比例偏高而无法正常生长,因此,不定芽分化过程中,保证芽体数量和芽体的正常生长是关键。实验结果表明,对于JAI1,处理5和处理6中诱导不定芽的分化率无明显差别;而对于jai1-1,子叶和下胚轴诱导不定芽分化的最佳培养基为MS+ZT 2.0 mg/L+IAA 0.2 mg/L。
2.4 不同激素组合对生根的影响
在添加有NAA的培养基中生根迅速,5~6 d后可见愈伤组织基部膨大长出幼根,10 d左右不定根数目增多,并很快长出侧根,幼苗生长旺盛。而在添加有IAA的培养基中生根相对较慢,不定根数目较少,根细且长,幼苗生长相对缓慢。且JAI1和jai1-1在添加有NAA 0.1 mg/L和NAA 0.2 mg/L的两种生根培养基中的生根效果无明显差异(表5)。
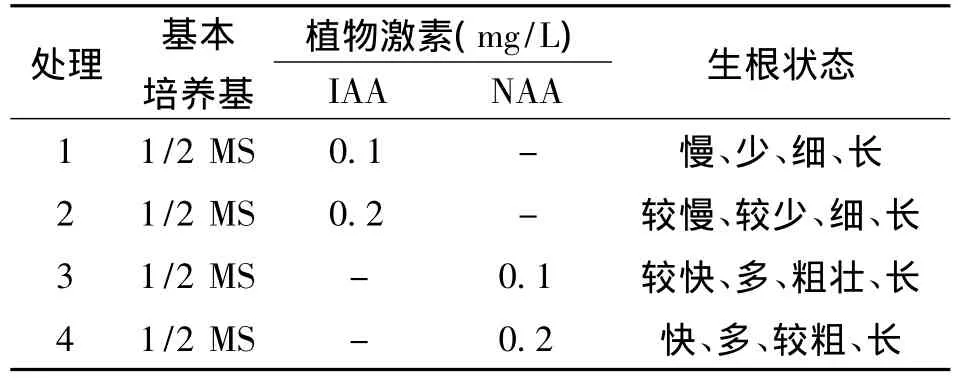
表5 不同激素组合诱导生根的效果比较
2.5 PCR检测结果
PCR产物经1%琼脂糖凝胶电泳检测(图1),1 号为空白对照;5,9,11,13,14 和19 号番茄基因组DNA只能扩增出大小约为500 bp的条带,应为JAI1;2,16和20号只能扩增出大小约为750 bp的条带,应为 jai1-1;6,7,8,10,12,15,17,21 和 22 号则能扩增出500 bp和750 bp大小的两条带,应为JAI1/jai1-1杂合子,这与实验预期完全相符;而3号和4号未扩增出目的条带,可能是提取的DNA质量较差所致。结果发现,经MeJA筛选后的材料全部表现为jai1-1基因型,且表现为JAI1和JAI1/jai1-1基因型的都是经MeJA筛选敏感而直接种植于营养土中的材料。说明通过这种方法建立起了番茄突变体jai1-1的高效筛选—再生体系。

图1 PCR产物经1%琼脂糖凝胶电泳检测
3 结论与讨论
实验发现,番茄愈伤组织在继代培养过程中往往容易发生褐化,为防止愈伤组织褐化,保持旺盛的增殖分化能力,应缩短继代时间的间隔。也可在继代培养时加入一定浓度的聚乙烯吡咯烷酮(PVP)、抗坏血酸或活性炭[17]。有研究认为黑暗或弱光处理也能显著降低褐化程度,但会影响不定芽的分化和光的形态建成。
实验结果表明,ZT和IAA的激素组合诱导子叶和下胚轴产生不定芽的分化率明显高于6-BA和IAA的组合,在相同条件下子叶诱导不定芽的分化率明显高于下胚轴。相同条件下,jai1-1不定芽的诱导率又明显低于JAI1。原因可能是jai1-1是突变体,JAI1基因编码的蛋白COI1是茉莉酸甲酯MeJA的受体,其可能因JA信号转导途径的缺陷而表现出对某些激素的超敏或者不敏感[18,19]。实验发现,1/2 MS+50 μM/L MeJA是突变体jai1-1筛选的有效培养基。野生型JAI1和突变体jai1-1在MS+6-BA 2.0 mg/L+IAA 0.2 mg/L诱导愈伤组织的效果最好;JAI1在MS+ZT 1.0 mg/L+IAA 0.1 mg/L诱导分化不定芽的效率最高,而jai1-1则以MS+ZT 2.0 mg/L+IAA 0.2 mg/L为佳;1/2 MS+NAA 0.1 mg/L是两者诱导生根的理想培养基。实验还发现,JAI1和JAI1/jai1-1与jai1-1的比例严重偏离3∶1的理论值,大致上为8∶1~12∶1,这可能与受精作用及胚胎发育的缺陷有关。在植株发育成苗的过程中,jai1-1突变体生长较慢,植株瘦小细长,叶片小且薄,植株能够正常开花但不能正常结实,有极少数能够正常结实的其果实也比野生型小很多,且没有正常的种子。以本实验探索得到的番茄最佳离体再生体系为基础,可以将COI基因引入到番茄育种中,提高番茄品种对生物胁迫和非生物胁迫的抗性。下一步将以jai1-1突变体为材料,对番茄茉莉酸甲酯受体基因COI以及JA的信号转导途径进行深入研究。
[1] 王 富,李文丽.番茄黄化曲叶病毒病综合防控技术[J].中国果菜,2009,10(7):31 -32.
[2] Killian DJ,Harvey E,Johnson P,et al.SKP -1,a homolog of Skp1 and a membei of the SCF(SEL -10)complex,regulation sex-determination and LIN-12/Notch signaling in C.elegans[J].Dev Biol,2008,322(2):322 -331.
[3] Trujillo M,Ichimura K,Casais C,et al.Negative regulation of PAMP-triggered immunity by an E3 ubiqutin ligase triplet in Arabidopsis[J].Curr Biol,2008,18(18):1396-1401.
[4] Strickler SR,Tantikanjana T,Nasrallah JB.Regulation of the S-Locus Receptor Kinase and self-Incompalility in Arabidopsis thaliana [J].Department of Plant Biology,2013,3(2),315 -322.
[5] Yao TT,Ndoja A.Regulation of gene expression by the ubiquitin-proteasome system[J].Seminars in Cell&Developmental Biology,2012,23(5):523 -529.
[6] Jennifer A,Benanti JA,Coordination of cell growth and division by the ubiquitin-proteasome system[J].Seminars in Cell& Developmental Biology,2012,23(5):492-495.
[7] Wang ZL,Dai LY,Jiang ZD,et al.GmCOI1,a soybean F-Box protein gene,shows ability to mediate jasmonate- regulated plant defense and fertility in Arabidopsis[J].MPMI,2005,12:1285 -1295.
[8] Devoto A,Nieto-Rostro M,Xie D,et al.coi1 links jasmonate signaling and fertility to the SCF ubiquitinligase complex in Arabidopsis[J].Plant J ,2002,32(4):457-466.
[9] Lei L,Zhao YF,Bonnie C,et al.The tomato homolog of CORONATIN-INSENSITIVE1 is required for the maternal control of seed maturation,jasmonate signaled defense responses,and glandular trichome development [J].Plant Cell,2004,16:126 -143.
[10] 赵 歌,王 谨,储荣华,等.番茄子叶不定芽分化初探[J].北方园艺,2010,(4):150 -152.
[11] 曲雪艳,周庆红.樱桃番茄的组织培养与离体快繁技术研究[J].江西农业大学学报,2006,28(6):962-964.
[12] 孙同虎,孙秀玲,薄鹏飞,等.番茄高效离体再生体系的建立[J].安徽农业科学,2006,34(24):6467 -6487.
[13] 韩碧文,刘淑兰.植物离体体细胞胚胎发生[J].植物生理学通讯,1988,(10):9 -15.
[14] 陈火英,张建华,俞俊棠,等.番茄离体培养的形态发生[J].华东理工大学学报,2001,27(2):139 -142.
[15] 王金杰,王志英,徐香玲,等.影响番茄离体培养再生的主要因素探讨[J].东北农业大学学报,2009,40(11):28-32.
[16] 曹慧颖,张立军,夏润玺,等.番茄组织培养研究进展[J].中国蔬菜,2012,(16):10 -14.
[17] 乔永旭.番茄再生体系的建立[J].北方园艺,2010,(17):174-176.
[18] Adams E,Abdollahi P,Shin R.Cesium inhibits plant growth through jasmonate signaling in Arabidopsis[J].Int J Mol Sci,2013,14(3):4545 -4559.
[19] Shan X,Li C,Peng W,et al.New perspective of jasmonate function in leaf senescence[J].Plant Signal Behav,2011,6(4):575 - 577.
