湿地芦苇根结合好气细菌群落时空分布及其与水质因子的关系
2013-09-15薇1郭逍宇1霏1
熊 薇1,郭逍宇1,*,赵 霏1
(1.首都师范大学资源环境与旅游学院,北京100048;2.北京市城市环境过程与数字模拟重点实验室-省部共建国家重点实验室培育基地,北京100048;3.三维信息获取与应用教育部重点实验室,北京100048;4.资源环境与地理信息系统北京市重点实验室,北京100048)
再生水作为一种稳定的再生水源,在缓解北京市湿地水资源供需矛盾、减轻湿地水环境污染方面发挥了重要作用[1-3],据统计到2010年北京市再生水利用6.8亿m3,其中河湖环境利用2.1亿m3,占再生水利用总量的30.9%[4],但再生水中丰富的氮、磷含量决定了再生水利用必然会产生许多负面环境效应,再加上城市湿地多为封闭性水体,水流速度较缓,水体更新周期较长,水体生态系统结构较为单一,使得水体富营养化成为湿地再生水利用的最大障碍[5]。
城市人工湿地不仅具有重要的景观作用,而且具有良好的环境污染修复能力,能有效去除水体氮、磷、各种有机物质、重金属氧化物,降低水体生化需氧量(BOD)、总悬浮固体(TSS)含量[6-7],植物在人工湿地氮污染修复过程中扮演重要角色[8],Oostrom等认为湿地中13%的氮是通过基质的过滤和植物吸收作用被去除的,湿地植物的净化作用主要是通过植物群落根际分泌物及凋落物的分解影响微生物群落的功能,进而影响系统的净化效能[9]。Li等采用基因文库技术对北京翠湖人工湿地芦苇和香蒲根内生细菌群落结构分别进行研究,结果表明湿地植物根内生菌群落对湿地氮、磷、硫以及有机复合物具重要的降解作用,对湿地修复具重要意义[10-11]。Atif等运用变性梯度凝胶电泳(DGGE)技术研究了两个典型垂直流人工湿地植物凋落物及沉积物中氮去除功能细菌的群落结构,结果表明功能细菌群落因基质不同及采样点位置不同而具有显著差异,功能细菌群落多样性与湿地净化系统功能作用相关[12]。大量研究表明湿地植物根围细菌多样性与水体物理化学性质、湿地净化效率、人工湿地系统稳定性具显著相关性[5,13-14],且具显著的季节动态特征[15-16],但从环境因素角度揭示湿地微生物群落结构差异机制的研究尚鲜见报道。
借助于生态学多样性测度方法研究复杂多样的微生物群落结构已经较为成熟[17-19],而湿地微生物多样性信息主要依靠培养法和非培养法如基于聚合酶链式反应(PCR)的限制性片段长度多态性性分析(ARDRA)、变性梯度凝胶电泳(DGGE)、荧光原位杂交(FISH)技术获得。尽管传统的微生物培养法对于研究微生物群落结构有不足之处,但培养法不仅对微生物资源的开发与利用具重要作用,而且可通过培养基的选择作用有针对性的反映人工湿地中具有不同分解作用的细菌类群,如在普通牛肉膏蛋白胨培养基上生长的细菌可能代表了对含氮有机污染物具有较强分解能力的微生物类群,而有机氮素如蛋白质、多肽、氨基酸和尿素等是富营养水体的主要污染元素,这一类群的细菌可能在氮污染水体的治理上具有重要的应用潜力[20],对研究再生水补水湿地微生物净化机理具有重要作用。基于此本研究以北京奥林匹克公园再生水人工湿地净化系统为例,借助细菌培养与ARDRA相结合的技术分析研究夏秋两季的净化系统不同功能区湿地芦苇根结合好气细菌的数量、群落结构及其多样性,并借助典范对应分析(CCA)研究水质变量对群落结构的影响,揭示影响细菌群落结构特征变异的主要水质参数[21],为再生水城市湿地利用提供合理的科学依据。
1 研究区概况
奥林匹克公园人工湿地净化系统地处北京市北部,位于奥林匹克公园园内,于2007年开始运行。该区属暖温带半干旱半湿润大陆性季风气候。多年平均气温11—12℃,极端最高气温41.6℃,极端最低气温-21.2℃。多年平均水面蒸发量在1200 mm左右,多年平均降雨量约600 mm。降雨年内分配不均,多集中在汛期6—9月,约占全年的85%。该净化系统以两个复合垂直流人工湿地为核心,以氧化塘为补充,形成多层次的净化系统,将来自清河再生水厂的再生水净化处理后作为奥林匹克公园主湖补充水源。其中,复合垂直流人工湿地由垂直向下流和垂直向上流两部分湿地构成。湿地系统内水生植物主要包括芦苇、香蒲、水葱、千屈菜等,植被覆盖度较高,可达70%—90%。净化系统各处理区分布及水流方向如图1[22]。再生水作为补充水源首先进入复合垂直流人工湿地再生水处理区(RW),同时主湖水循环至复合垂直流人工湿地循环水处理区(CW),再生水处理出水经氧化塘区(OP)深化处理后进入主湖,主湖水停留后会进行下一次循环。
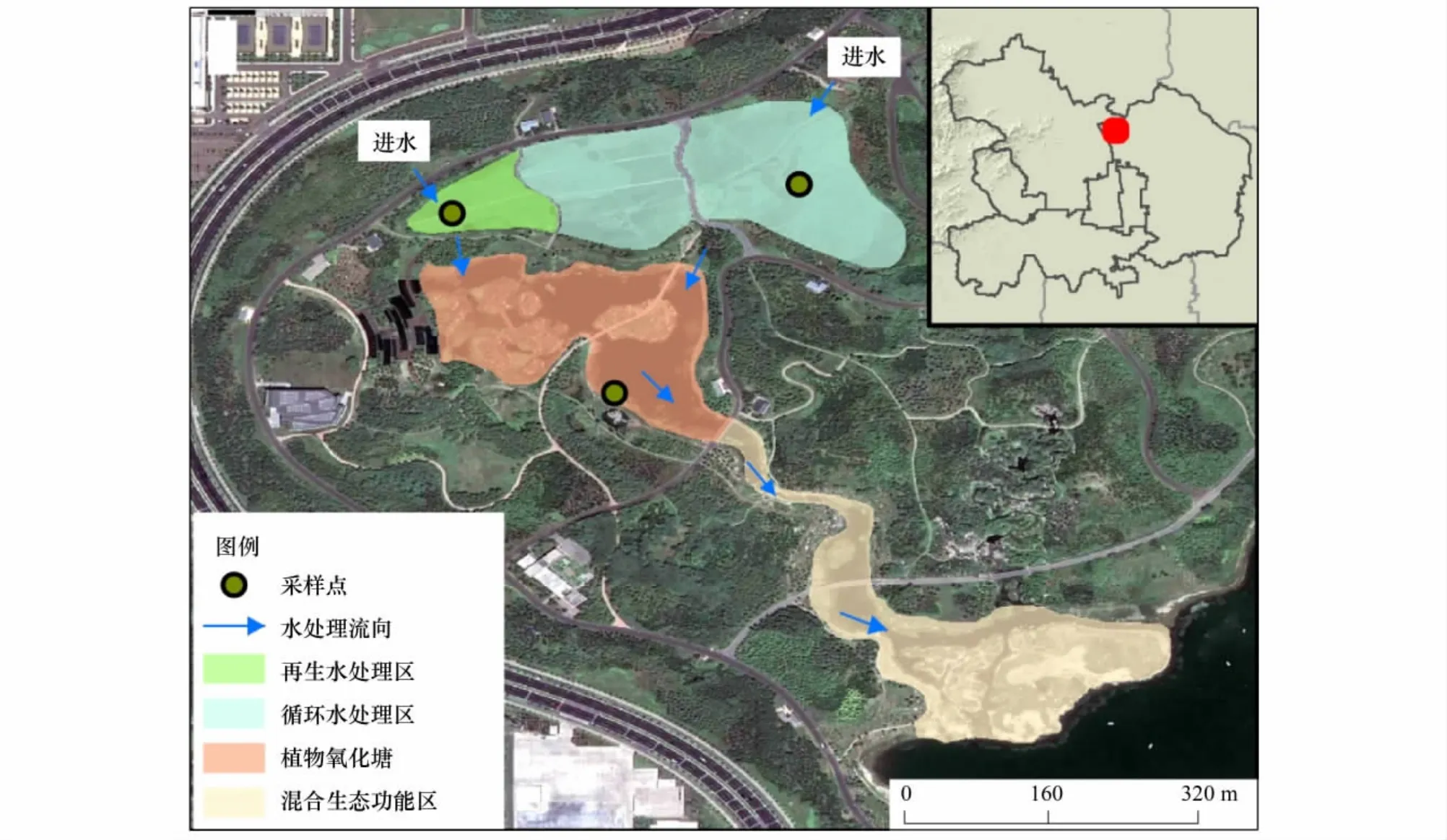
图1 北京奥林匹克公园再生水人工湿地净化系统示意图Fig.1 Location and distribution of the purification system in Beijing Olympic Park
2 材料与方法
2.1 芦苇根系样品采集及水质测定
选取研究区不同处理区典型湿地植物芦苇为研究对象,于2010年11月9日、2011年6月11日在人工湿地净化系统中RW、CW、OP功能区分别获得芦苇根系样品,新鲜表面附着基质的芦苇根系样品置于无菌三角瓶中密封,立即带回实验室处理分析。并对样品进行编号,夏季编号为SRW、SCW、SOP,秋季各功能区样品编号为ARW、ACW、AOP。于夏、秋两季分别在3个功能区均匀布3个样点,采集水样,分析与氮污染相关的水体富营养化指标。水质样品低温储藏带回实验室处理。其中,水体化学需氧量(COD)、总磷(TP)采用国标法测定,NH+4、NO-3浓度由离子色谱仪(ICS-1500型、ICS-90型,美国Dionex)测定,水体总氮(TN)采用耶拿Multi N/CUV分析仪测定。其余水质参数,包括叶绿素a(CHL)、溶解氧(DO)、氯离子(Cl-)、蓝绿藻(PCY)、盐度(Sal)、总溶解性固体(TDS)、电导系数(SPC)、氧化还原电位(ORP)由水质仪(Hydrolab Datasonde5 5 X,the United States)现场测定,测定结果见表1。
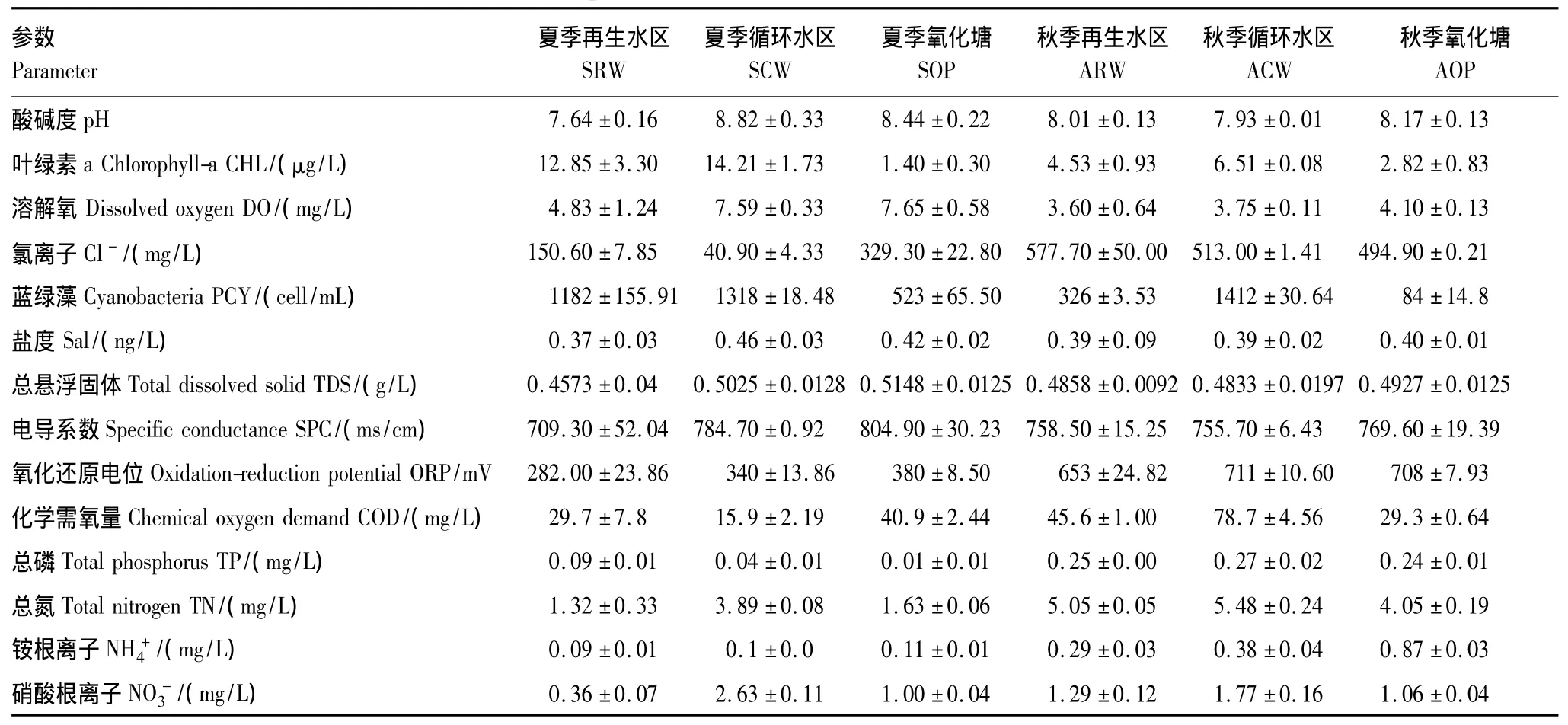
表1 夏秋两季水质理化性质Table 1 Water quality of constructed wetland in autumn and summer
2.2 根结合菌细菌培养、计数、分离纯化
将新鲜表面附着基质的芦苇根系置于震荡仪震荡去除表面附着物,取表面清洗干净的芦苇根系1 g,再用无菌水清洗3次,无菌滤纸吸取多余水分,置于灭菌研钵内,加入少量无菌石英砂及少量无菌水研磨后定容100 mL。此液体依次稀释涂板,采用LB培养基培养,每梯度3个平行,在30℃条件下倒置培养48 h,记录菌落数目,计算可培养细菌的平均数目。选择菌落数在30—300范围的稀释度平板,将所有单菌落分别转接划线LB培养基平板上,分离纯化。
2.3 扩增16SrDNA限制性分析
2.3.1 PCR模板制备
用无菌牙签挑取少量已纯化的菌体重悬于20μL无菌ddH2O中,置于沸水浴中煮沸10 min,立即置于冰上5 min,4℃,10000 rpm离心5 min,置于冰上,使用时取2.0μL上清液做模板[23-24]。
2.3.2 16SrDNA扩增
采用细菌通用引物765f:5'-GGAGCAAACAGGATTTGATA-3',和1492r:5'-GGTTACCTTGTTACGACTT-3'[25]对细菌DNA进行扩增。25μL扩增体系包含:12.5μL 2×Taq PCR Master Mix(天根生化科技有限公司,KT201-12),1μL 10μmol/L引物765f和1μL 10μmol/L 1492r(生工生物工程(上海)有限公司),2μL DNA模板,8.5μL无菌水。PCR反应程序94℃,5 min;30个循环包括94℃,30 s,55℃,1 min,72℃,1 min;72℃ 延伸10 min;4℃保存。1.0%的琼脂糖凝胶检测PCR产物。
2.3.3 扩增片段酶切分型
用限制性内切酶Hae III对PCR产物酶切,10μL酶切体系:5μL PCR产物,0.3μL Hae III(10 U/μL),1 μL 10×buffer,3.7μL双蒸水。37℃反应4 h。酶切产物用2.0%琼脂糖凝胶电泳,1×TAE电泳缓冲液,100 V电泳60 min。比较分析酶切电泳图谱。
2.4 统计数据分析
据酶切图谱信息,将酶切图谱完全一致的菌落划分为1个操作分类单元(operational taxonomic unit,OTU)[26],据此估计样品中存在的最低限度的细菌数目,并运用SPSS18.0将菌落聚类。依此分类分析细菌群落结构及多样性分析。利用Shannon-Weaver指数(H')评价细菌群落综合多样性,以EI计算均匀度指数,以Margale指数(D')评价群落丰富度。CCA排序图由Canoco for Windows 4.5和TWINSPAN软件包共同完成,其余图表由Microsoft Excel 2007完成。多样性评价指数计算公式如下:

式中,Pi=ni/N,S是图谱的分类数,ni是第i类包含的图谱,N为总图谱数。
3 结果与分析
3.1 细菌群落密度分析
人工湿地微生物群落密度与污水净化效率具有密切关系,微生物数量与污染物去除率呈正相关[14,20,27]。群落密度分析结果见表2,从季节变异看,夏季芦苇根结合微生物群落密度较秋季增加76.37%—96.70%,具有明显的季节效应。从湿地类型差异来看,再生水和循环水经复合垂直流人工湿地处理进入氧化塘后,微生物群落密度减少。从补水水质差异看,再生水处理区微生物群落密度高于循环水处理区,夏秋两季在不同功能区表现出相同的分布格局。为进一步分析环境因子对芦苇根结合细菌群落密度的影响,采用spearman秩相关系数分析(表4)水环境因子对群落密度的影响,结果显示净化系统水体浓度(0.934**,P﹤0.001)和ORP(0.886*,P﹤0.005)与群落密度显著相关,是影响细菌密度时空差异的主要因素。
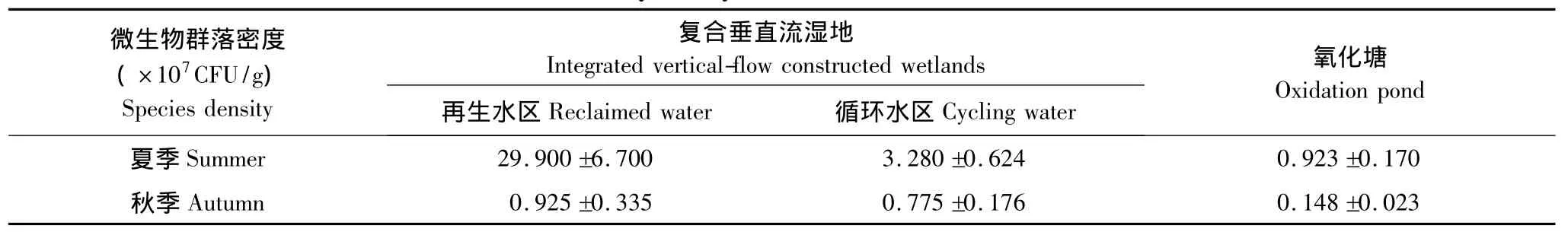
表2 芦苇根结合细菌群落密度Table 2 Community density of the different water treatment units
3.2 芦苇根结合细菌群落结构的时空变异分析
通过聚类分析,将获得138株分离物划分为29个OTUs,每个OTUs至少代表一种细菌,表明研究区至少分布29种不同细菌(图2)。其中,16个OTUs属于夏季,14个OTUs属于秋季,OTU28是夏秋两季唯一的共有OTU,该类群从夏季优势类群过渡为秋季偶见类群。夏季16个OTUs中,11个OTUs属于再生水处理区,8个OTUs属于循环水处理区,4个OTUs属于氧化塘,其中OTU1,OTU28是夏季3个功能区共有类群,OTU1从再生水处理区和循环水处理区的优势类群过渡为氧化塘的非优势类群,OTU28从再生水区和氧化塘的优势类群过渡为循环水区的偶见类群。11个OTUs属于各功能区特有OTU,特有OTU均为非优势类群或偶见类群,其中8个OTUs属于再生水处理区,3个OTUs属于循环水处理区。秋季14个OTUs中,6个OTUs属于再生水处理区,5个OTUs属于循环水处理区,10个OTUs属于氧化塘,其中,OTU12,OTU18是秋季3个功能区的共有类群,OTU12从再生水处理区和循环水处理区的偶见类群过渡为氧化塘的非优势类群,OTU18是秋季3个功能区的共有优势类群。9个OTUs属于各功能区特有OTU,特有OTU均为非优势类群或偶见类群,其中2个OTUs属于再生水处理区,2个OTUs属于循环水处理区,5个OTUs属于氧化塘。可见季节动态对微生物种群类型分布的响应体现在夏秋两季微生物丰富度差别不大,但夏季群落均匀性高于秋季,及共优种比例增高,优势种群类型改变。
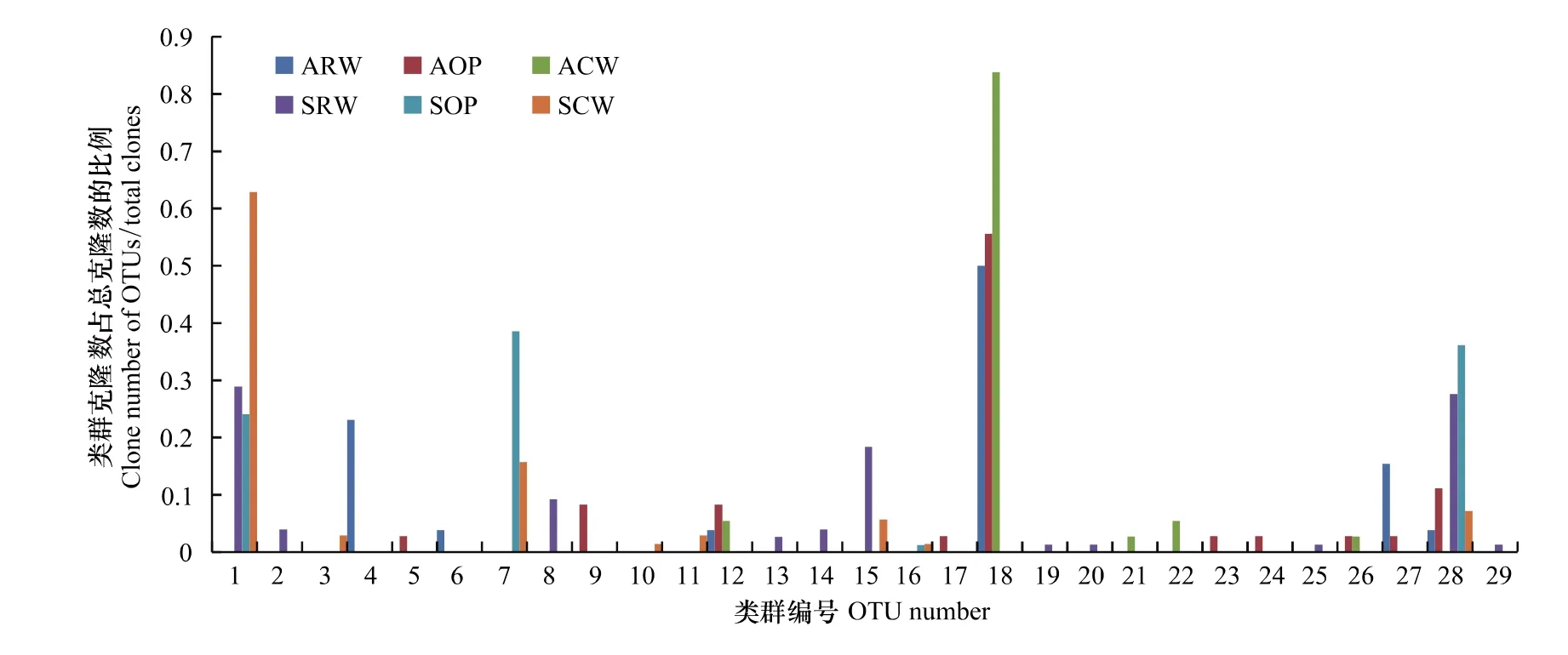
图2 不同OTUs分离菌株在总分离菌株中的分布Fig.2 Bacterial number distribution of OTUs in all bacterial number
根据单个OTUs包含菌株与该样品中总菌株数的比例,对菌株情况进行了统计(表3)。季节动态对芦苇根结合好气细菌群落结构影响主要体现在:其一,夏季较秋季优势类群、非优势类群及偶见类群3大类群的OTU类型多样化;其二,夏季较秋季偶见类群数量百分比呈下降趋势。芦苇根结合好气细菌群落结构空间差异夏季体现为:其一,复合垂直流人工湿地(再生水处理区、循环水处理区)较氧化塘非优势类群和偶见类群类型多样化;其二,复合垂直流人工湿地(再生水处理区、循环水处理区)较氧化塘非优势类群及偶见类群数量百分比增加,其三,不同功能区之间优势类群差异增大,再生水处理区为OTU1和OTU28,循环水处理区为OTU1,氧化塘为OTU7和OTU28。三者共同作用导致复合垂直流人工湿地丰富度及均匀度均增高。芦苇根结合好气细菌群落结构空间差异秋季体现为:其一,氧化塘较复合垂直流人工湿地丰富度增高,均匀度变化规律不明显;其二,不同功能区之间优势类群趋于一致,均为OTU18。综合不同OTUs分离菌株在总分离菌株中的分布及细菌群落结构统计分析结果,多样化的类型及其较低频次的偶见类群共同作用使得夏季较秋季微生物群落结构的丰富度及均匀度均呈现升高趋势。共有的优势类群多度降低,特有的偶见类群增加,同时偶见类群的多度减少。偶见种类群增加主要体现在特有种类群增多。
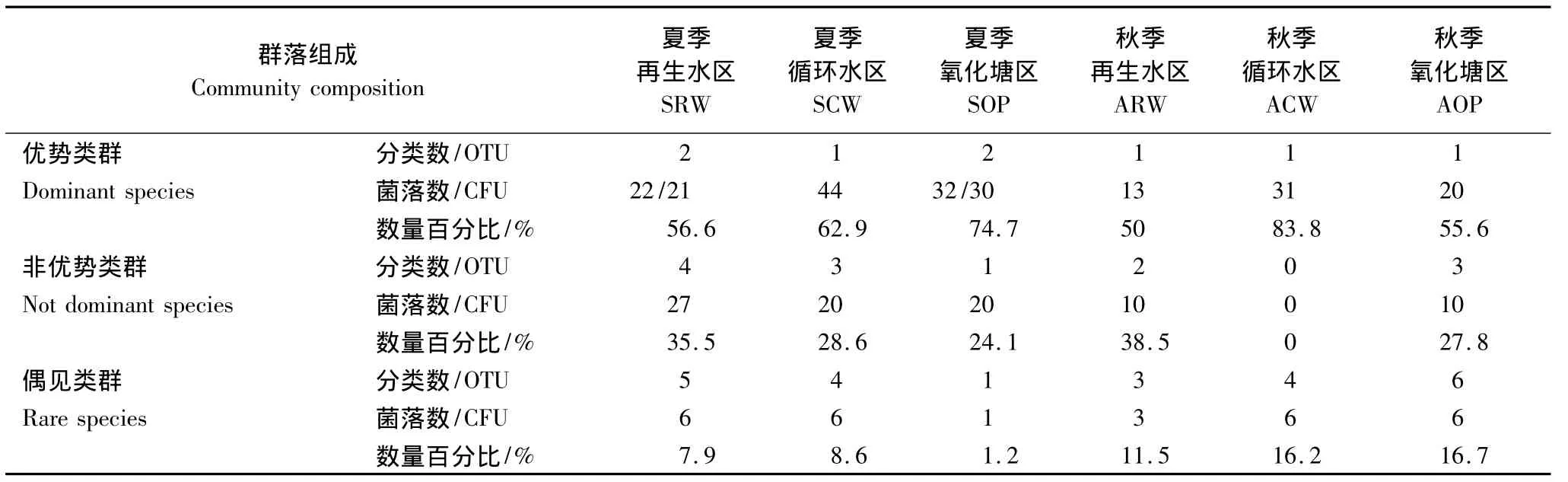
表3 净化系统可培养芦苇根结合细菌群落结构的时空差异Table 3 Spatial variability of bacterial community structure in reclaimed water management system
为解释水质变量对群落结构分布格局的影响,采用Spearman秩相关分析群落组成类群的数量百分比与主要水质指标之间的关系。结果如表4,优势类群所占百分比与PCY浓度相关(r=0.771*,P<0.05),偶见类群所占百分比与ORP(r=0.771*,P<0.05)、TP(r=0.771*,P<0.01)、TN(r=0.771*,P<0.05)、NH+4(r=0.829*,P<0.05)相关。相关分析结果表明细菌优势类群是水质净化的主要贡献者,优势类群对消除水体富营养化起重要作用,与水体富营养化紧密相关。在一定条件下,细菌群落优势类群百分比随水体PCY浓度增高而增加。细菌偶见类群一般因环境扰动导致新物种的产生或者已存物种的消亡而出现,湿地水体营养水平及氧化还原环境的改变是偶见类群出现的扰动因素,其改变导致新的适应性类群出现及非偶见类群数量减少,与偶见类群紧密相关。
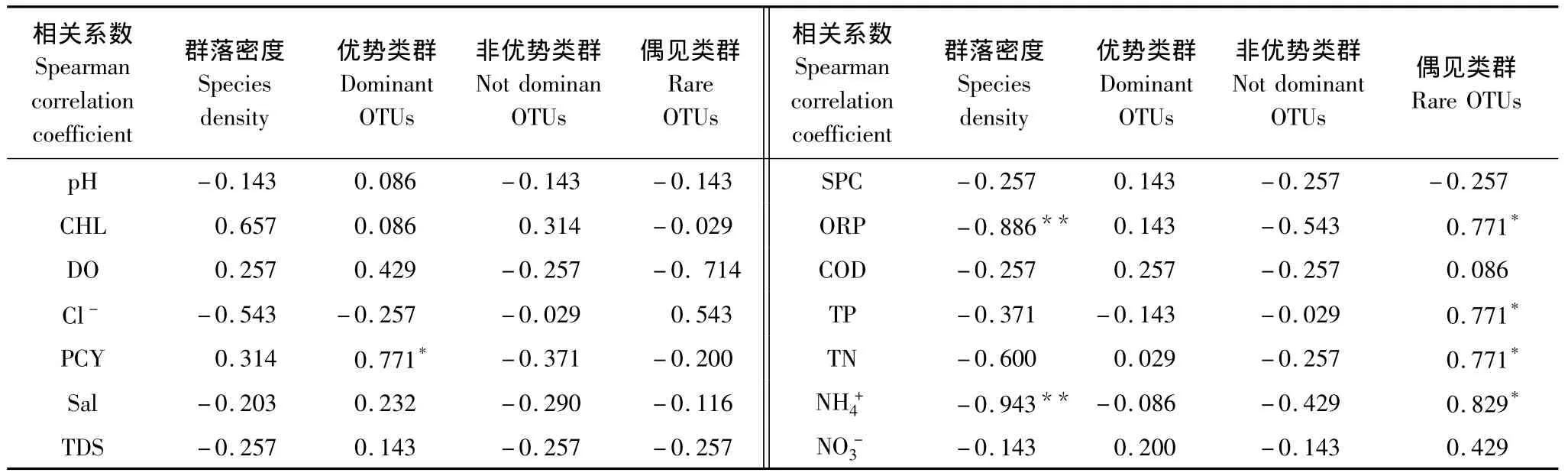
表4 水质指标与芦苇根结合细菌群落特征的相关性分析Table 4 Correlation analysis of Water quality and bacterial community characteristics
3.3 芦苇根结合细菌群落多样性分析
采用多样性指数进一步分析芦苇根结合细菌群落的时空变异,分析结果见表5。其中,Shannon-Weaver指数受群落物种丰富度影响较大,Margale指数反映群落物种丰富度,均匀度指数反应群落物种均匀性大小。从表中可以看出,夏季较秋季复合垂直流人工湿地好气芦苇根结合细菌群落Shannon-Weaver指数、丰富度指数显著增高,均匀度指数变化不大,氧化塘区好气细菌群落均匀度指数增加,Shannon-Weaver指数及Margale指数均减少,复合垂直流人工湿地与氧化塘细菌多样性具不同的季节差异。夏季再生水净化系统中,再生水处理区具最高Shannon-Weaver指数、Margale指数,氧化塘区Shannon-Weaver指数、Margale指数处于最低水平,但是在秋季再生水净化系统中氧化塘区具最高Shannon-Weaver指数、Margale指数,循环水区Shannon-Weaver指数、Margale指数具最低水平。总的来看,氧化塘细菌群落多样性受季节动态影响最小,而复合垂直流人工湿地细菌群落多样性季节变异较大。再生水处理区较循环水处理区夏秋两季细菌群落多样,丰富度及均匀性均增高。

表5 秋夏两季可培养芦苇根结合细菌多样性分析Table 5 Diversity of bacterial community of three water treatment units and two seasons
3.4 CCA排序分析
为进一步分析再生水湿地净化系统细菌群落结构与水质参数响应关系,结合运用典范对应分析(CCA)排序法和双向指示种分类法(TWINSPAN),分析夏秋两季细菌群落结构特征及其成因。以6样方内29个OTUs在群落中权重组成的物种矩阵和12种环境参数组成的环境变量矩阵为基础数据,应用CCA排序,得到样方、物种、环境因子相互关系的二维排序图,并应用TWINSPAN将29个OTUs分为7类(图3)。排序结果表明,CCA排序图第一轴AX1和第二轴AX2的特征值累计占总特征值的65.06%,排序图包含了大部分的信息,排序效果良好。在CCA排序图中,物种用三角形符号表示,物种之间夹角余弦值越大表示它们越相关。样方点用圆圈表示,样方之间的距离越近则表示样方间越相似。各环境因子用箭头表示,箭头的长短表示某个环境因子与种群分布相关性的大小,线越长,说明相关性越大,反之则小。从图5箭头的连线长度可以看出,选取的12个与氮污染相关的水环境变量对芦苇根结合好气细菌群落结构空间分布状况都有一定程度的影响,其中,TDS、pH值、DO、Sal、TP、ORP对好气细菌群落结构时空分布影响较大,TN较NH+4、NO-3对群落结构时空变异贡献率高。箭头方向表示环境变量之间或者环境变量与排序轴的之间的关系,夹角越小,相关性越大[16],其中NH+4、TN、ORP、TP与第1轴关系密切,NO-3、TDS、pH值、Sal与第2轴密切相关。
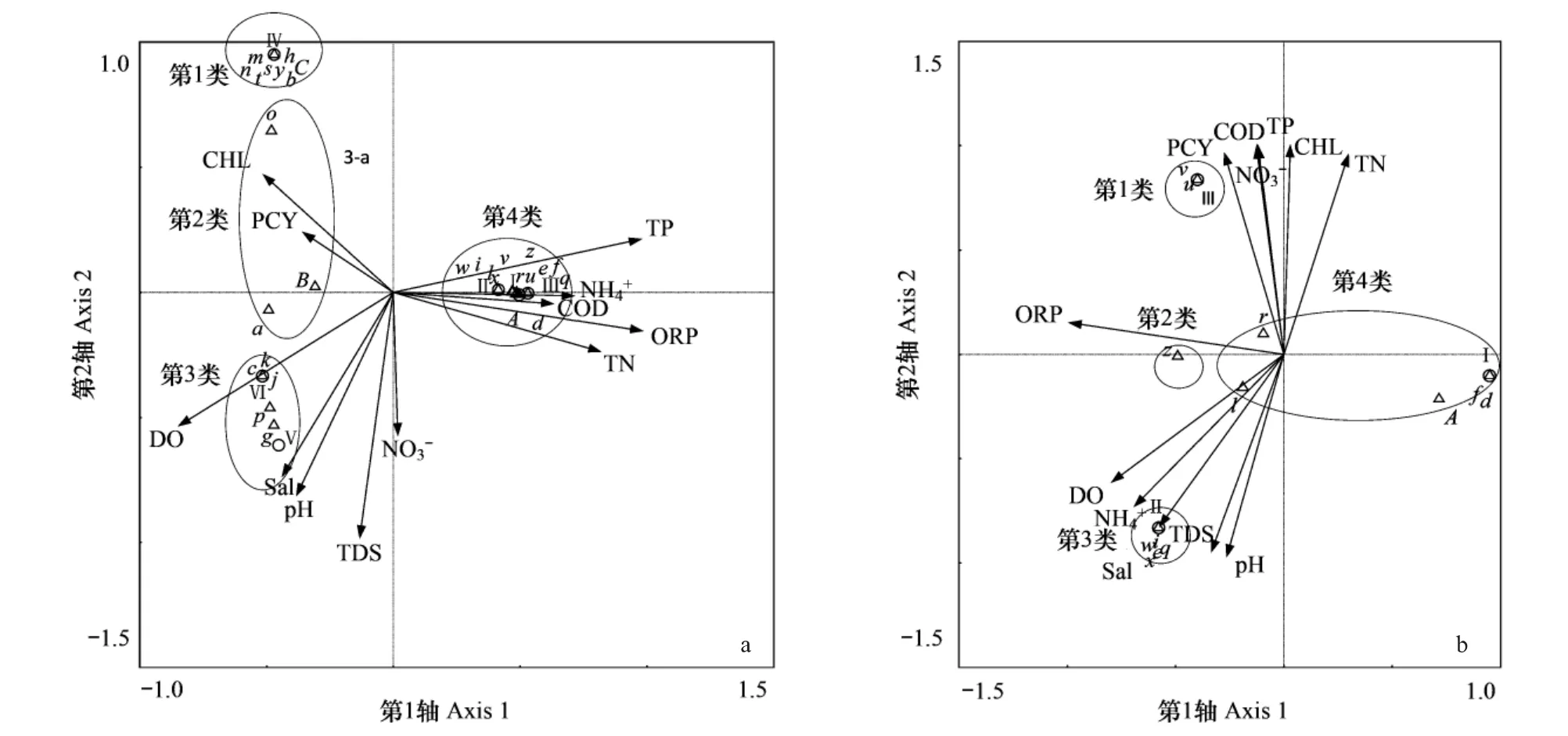
图3 29 OTUs的CCA双轴排序图,其中a为夏秋两季物种与环境因子的CCA排序图,b是对a图中第4类的放大,是秋季特有物种与水质的CCA排序图Fig.3 Bi-plot(species and environmental variables)of CCA for summer and autumn survey on bacterial diversity in reclaimed water purification system(a),Bi-plot(species and environmental variables)of CCA for autumn survey on diversity of unique bacteria,which is the additional information of(b)
依据TWINSPAN对物种分类结果,将图3中29 OTUs圈为4类,其中夏季分为三类,分别是:如图第1类,包含Ⅳ(SRW)样方的偶见类群及部分非优势类群;第2类,包含Ⅳ、Ⅴ(SRW、SCW)样方共有种群,且为优势种或非优势种;第3类,包含Ⅴ、Ⅵ(SCW、SOP)样方的共有种及Ⅴ样方的独有种,秋季分为一类,即第4类,第4类包括秋季特有类群。图3中第2类临近排序中心,在净化系统中具相对稳定丰度,这些类群对环境适应性较强,生态幅比较广泛,在湿地物质和能量代谢中发挥重要作用,如,OTU28(B)在夏季3个功能区均出现,为夏季再生水处理区优势种,是水质净化的重要类群,第1类远离排序中心,均为夏季再生水处理区独有种,易受环境因子影响,较少频率出现于再生水净化系统中,对水体净化不起主要作用。夏季种群沿第2轴分散分布于第1轴的负半轴,而秋季种群集中分布于第1轴的正半轴,细菌群落结构具显著季节差异。从图3还可以看出,、TN、ORP、TP是导致净化系统可培养细菌群落季节演替的主要水质变量,、TDS、pH、Sal是导致夏季可培养细菌群落结构空间演替的主要因素。第2类,包括优势类群OTU1(a)OTU28(B)与PCY和CHL密切相关,对水体富营养化去除其主要作用类群。第3类,包括样方SOP优势类群OTU7(g)及样方SCW偶见类群OTU3(c)、OTU10(j)、OTU11(k)、OTU16(p)与DO具有密切的关系,DO是改善湿地氧化还原环境的重要环境因子,氧化塘与复合垂直流湿地基质中具不同氧气分布特征,导致各区细菌群落结构发生显著改变。第1类与测定的水体富营养化环境因子不具显著关系,说明再生水特有的性质影响了该区根结合细菌群落的偶见类群的分布格局,需要进一步结合细菌测序结果分析。从图3可以看出,秋季各样点及芦苇根结合可培养细菌群落结构梯度排序是各水质变量共同作用的结果,这与秋季各处理区净化效率降低,各功能区优势类群趋于一致有紧密联系。结合分类结果可以看出,第2类和第4类类群具相对较高丰度,受环境因子影响较小,如,O(r)是秋季净化系统3个功能区共有优势种,OTU12(l)在秋季净化系统3个功能区中均有出现,但其与水体富营养化环境因子不具密切关系,这说明秋季优势类群的水质净化作用较小。第1类较偏好高TN、TP浓度,第3类较偏好高DO、NH+4、Sal浓度,这两类与水体富营养化环境因子密切相关,但这些类群不占优势。
4 讨论与结论
大量研究表明微生物在人工湿地中起核心作用,研究湿地微生物多样性的技术方法很多,而培养法只记录适合在培养基上生长的微生物群落,该法只能反映自然环境少部分的微生物,不能全面反映湿地中细菌群落的真实情况。但是,培养法的优势在于利用不同的培养基,可以选择性的反映湿地中对不同资源具较强利用能力的微生物群落[20]。如本研究中利用LB培养基分离的细菌可以反映对再生水中氮素如蛋白质、多肽、氨基酸、尿素等及有机碳具较强分解能力的细菌类群[28-29],是修复水体富营养化的优势类群,分析其时空变异规律及其与水富营养化因子的关系,对于再生水补水湿地水生态修复机制具有重要的意义。
4.1 净化系统可培养芦苇根结合细菌群落特征及多样性时空差异
微生物与环境因子之间有密切的响应关系,许多研究表明微生物群落结构特征是微生物群落与环境因子长期响应的结果,受植物生长状况和代谢活动、气候季节变化、污水处理工艺、污水水体水质状况等多种因素影响,基于多因子共同作用微生物群落结构及多样性呈现差异[28,30]。
(1)净化系统芦苇根结合好气细菌群落密度、群落组成特征、群落多样性均表现出显著的季节差异。夏季较秋季净化系统芦苇根结合好气细菌群落密度增加,这与夏季较秋季净化系统细菌群落优势类群百分比增大,非优势类群及偶见类群百分比减少相关。夏季较秋季复合垂直流人工湿地细菌群落多样性、丰富度、均匀度一致呈现增大趋势,这与夏季较秋季该类型人工湿地细菌群落优势类群、非优势类群和偶见类群种类数均增加密切相关。Florent Chazarenc等采用Biolog Ecoplate的方法对人工湿地微生物群落时空差异进行分析,结果表明季节动态是影响微生物群落多样性最主要因素之一[15]。高程等对北京城区不同水体可培养细菌的研究表明夏季细菌数量高于秋季[20]。王晓丹等同时采用用LB固体培养基培养法和PCR-DGGE技术对密云水库细菌群落结构进行研究,结果表明季节差异导致群落结构发生改变[28]。陆开宏等通过对富营养水体植物根际微生物群落特征分析发现因季节差异,植物的生长状况及代谢改变,植物根际微生物群落结构出现差异,并影响水体污染物的去除效率[30]。由前人研究可知,在湿地生态系统或水体生态系统中,采用培养法或非培养法,细菌群落结构研究结果均表明细菌群落受季节影响,具明显的季节效应。在再生水湿地净化系统中,夏季向秋季的季节转变不仅降低了净化系统细菌生长温度,影响了细菌生长繁殖及活性,而且导致湿地芦苇枯萎凋零,植物功能减弱,根系分泌物质能力、泌氧功能降低,植物-微生物的互作去污作用降低,依托于植物、微生物、基质共同作用净化水质的人工湿地生态功能受到影响,水质净化效率降低,进一步促使水体有机负荷及污染物的积累,水质恶化,细菌密度及多样性降低,群落结构产生差异[31-32]。
(2)净化系统芦苇根结合可培养细菌群落密度、细菌群落构成特征、群落多样性均表现出显著的空间差异。夏季各处理区群落结构差异明显高于秋季,夏季净化系统空间差异具体表现为复合垂直流湿地较氧化塘好气细菌群落密度、多样性、丰富度增加,均匀度减少,这与复合垂直流湿地非优势类群和偶见类群类型、数量百分比增加相关;再生水处理区较循环水处理区可培养细菌群落密度、多样性、丰富度、均匀度增加,这与再生水净化区优势类群、非优势类群类型增加,非优势类群数量百分比增加,偶见类群量百分比减少相关。秋季净化系统空间分布特征具体表现为:3个不同功能区具有相同优势类群,但3个功能区优势类群百分比呈现显著差异,而偶见类群百分比在3各功能区具有趋同效应;复合垂直流湿地较氧化塘细菌群落多样性及丰富度均减少,均匀度变化规律不明显,这与复合垂直流湿地非优势类群、偶见类群类型减少相关;再生水处理区较循环水处理区可培养细菌群落密度、多样性、丰富度、均匀度增加,这与再生水处理区非优势类群类型数、百分比数均增加相关,夏秋两季分析结果一致表明再生水处理区具最高的群落密度和细菌群落多样性。前人研究表明湿地微生物数量与其净化功能之间存在显著关系,微生物数量越多污染物的去除效率越高[27]。魏成等研究表明提高湿地系统的多样性对提高湿地系统的净化效率和效率的稳定性具重要意义[14]。湿地工艺流程与其净化功能之间同样存在显著关系,复合垂直流人工湿地特殊结构及进水类型有利于水体营养及溶解氧分布、好养-厌氧-好养功能层形成,有利于微生物生长繁殖及活性,促进复杂有机物、氮、磷去除,提高污水净化效率[33]。其次,进水水质的差异是影响微生物及其净化功能的主要因素,再生水中丰富的氮、磷等营养元素利于微生物数量增加,并改变微生物群落结构及其多样性[23]。本研究中,复合垂直流湿地先进工艺特征及再生水特殊水质是影响再生水补水湿地系统中不同处理区微生物群落结构差异的主要原因。
4.2 净化系统芦苇根结合可培养细菌群落结构与水环境的相互关系
据文献,细菌群落结构与水质之间的关系还没有明确定论,研究方法也多采用相关性分析法。已有相关研究表明水质状况对微生物群落产生重要影响的同时微生物适应环境并改变水体环境,微生物群落多样性呈现出与水环境质量协同变化的特征[34]。梁威等的研究发现湿地微生物活动是污水中TN及COD的主要去除途径[27],其随后研究表明污水中BOD的去除率与复合垂直流湿地细菌总数显著相关[35]。CCA和TWINSPAN是两种具有很强解释能力的多元统计方法,它们生态学中成功运用,已被认为是最有效的群落定量分析方法[36]。近年来有学者尝试将CCA排序和多元回归结合,这为分析微生物群落物种对水质变量的联合反应提供了通用框架。YAN等采用CCA分析了污水处理厂微生物群落结构的季节演替,结果表明COD、、KN、C/N/P值是重要的微生物生长限制因子,DO是微生物群落演替的关键因子[16]。Shiah&Ducklow通过对细菌群落构成的控制研究揭示出温度是冬季、秋季、春季的细菌群落结构的控制因子,而无机营养限制及基质是夏季细菌群落结构的控制因子[37]。另一些研究,包括一个中型实验,也支持同样的观点,认为有机碳、无机营养是夏季细菌群落的重要限制因子[38-39]。微生物的呼吸作用和发酵过程是有机污染物的重要去除机制,其去除过程依赖于湿地氧化还原条件,高ORP为微生物提供氧化环境,有利于好养过程,如硝化作用、有机碳的降解,相反,低ORP提供还原环境,有利于厌氧过程,如硫酸盐降解、甲烷化。
本研究分析结果表明净化系统芦苇根结合好气细菌群落密度与水体浓度及ORP相关,群落构成与水体PCY、TP、TN和浓度及ORP相关,ORP是DO、有机物和含氮污染物三者氧化还原性的综合体现,宽泛的ORP范围有利于多种污染物的去除[8],是好养微生物通过氨化作用对水体有机氮降解的产物。夏季净化系统较秋季因具较高的细菌群落密度,群落多样性,净化效率提高,对有机物的去除效率提高,虽然夏季较秋季水体具较高的DO浓度,但较秋季ORP依然处于较低水平,这也是ORP与可培养细菌群落密度负相关的原因,较高的DO浓度有利于细菌的氨化作用,这是夏季较秋季水体具低水平COD、TDS及TN,同时与好气细菌群落密度正相关的原因。PCY浓度是水体富营养化的重要水质指标,其生长繁殖需要充足的营养和优越的物理条件[40],PCY浓度与优势种百分比相关,说明优势种对消除水体富营养化,对去除氮污染起主要作用,ORP及氮磷含量及N/P比值改变导致偶见种类型改变,改变好气细菌群落种群丰富度。因此ORP、浓度既影响好气微生物群落数量,同时改变微生物群落结构。由CCA分析表明、COD、ORP、TP是芦苇可培养根结合细菌群落结构季节差异的驱动因子。在驱动因子中,、ORP、TP与好气细菌偶见种百分比相关,说明该湿地净化系统细菌群落季节差异不仅体现在优势种群的改变上,同时体现在偶见种群的多少上,偶见种群的百分比与湿地净化系统的稳定性及净化效率密切相关。而这种微生物群落群落结构季节差异很大程度上可以由夏秋植物生长状况及代谢活动不同,微生物生长繁殖及活性不同来解释。在夏季,芦苇生长状况良好,根系的泌氧功能有利于根际氧化还原电位提高,碳(COD)、氮()、磷(TP)及高氧化还原电位促进微生物生长繁殖及活性,细菌群落度增加,促进水体净化,湿地系统净化效率提高。在夏季湿地较高净化效率的基础之上,功能区间水质差异增大,微生物群落结构空间差异增大,在排序图中夏季种群分散分布;相反,在秋季,微生物活动减弱,植物枯萎,水体碳氮磷浓度增加,氧化还原电位降低,高有机负荷抑制微生物生长及活性[31-32],细菌群落密度减少,湿地净化系统净化效率降低,好气细菌群落结构空间差异不明显,在排序图中秋季种群集中分布。本研究结果表明水质变量TDS、pH值、Sal是导致夏季好气细菌群落结构空间差异的主要水质变量。SRW较SCW和SOP具较低TDS、pH值、Sal水平,在SCW和SOP细菌群落更偏好于较高TDS、Sal浓度及较高pH值。而在SRW,细菌群落与富营养化程度相关。这可能与湿地功能分布相关。
据酶切分类结果,分别于29 OTUs中随机选取分离物进行16s rDNA序列测定,同源性比对表明:夏季净化系统中优势好气细菌为葡萄球属(Staphylococcus)、肠杆菌属(Enterobacteriaceae),微小杆菌属(Exiguobacterium)和芽孢杆菌属(Bacillus.),气单胞菌属(Aeromonas),其中气单胞菌属分布于夏季净化系统各功能区中。秋季人工湿地净化系统主要好气细菌为假单胞菌属(Pseudomonas),黄单胞菌属(Xanthomonadaceae),芽孢杆菌属(Bacillus),其中假单胞菌属为3个处理区共有的优势种。据已有报道称,气单胞菌在湿地系统氮循环过程中起重要作用,其生长受铵离子、氮、磷浓度影响明显[41],具有将转化为的能力[42],肠杆菌耐污能力强,具固氮能力,并抗植物病原体,同时在磷循环中起重要作用[10]。葡萄球属细菌多为机会致病病原菌,对固氮菌有协同促进作用[43]。秋季主要细菌种类:假单胞菌属,芽孢杆菌属,及黄单胞菌属,这几种菌属的微生物生长快速,其中假单胞菌被频繁的从湿地植物根系周围分离到,不仅以碳氢化合物为营养来源,在去除碳源污染方面起主要作用,还是氨化细菌的优势菌属,具很好地去除有机氮的效果,芽孢杆菌对大分子结构的有机物具破坏作用,有效促进有机物的分解[44]。总之,芦苇根结合菌促进了水体净化过程中的植物修复作用,尤其在氮磷循环及碳化合物降解去除方面。但是,限于培养法不能直接的反映芦苇根结合菌的全部信息,结合非培养方法分析奥林匹克公园再生水净化湿地芦苇根结合菌对水体净化的机制原理是下一步的工作重点。
[1]Zhou L B,Han L B,Su D R.Advance in research on application of reclaimed water for turf-grass irrigation.Water Saving Irrigation.Water Saving Irrigation,2004,5(1):17-20.
[2]Guo X Y,Gong H L,Zhao W J.Effects of recycled water irrigation on bacterial community compositions in lawn soil.Acta Microbiologica Sinica,2010,50(11):1519-1524.
[3]Yang H,Abbaspour K C.Analysis of wastewater reuse potential in Beijing.Desalination,2007,212(1/3):238-250.
[4]Wen J.Beijing water authority issued the 12thFive-Year Plan about reclaimed water.China News Service,2011-01-28.http://www.chinanews.com/ny/2011/01-28/2817700.shtml.
[5]Zhu J N,Wang X D,Zhai Z H,Ma W L,Li R Q,Wang X L,Li Y H.Changes of bacterial community structure on reusing domestic sewage of daoxianghujing hotel to landscape water.Environmental Science,2010,31(5):1299-1306.
[6]Zhao SM,Hu N,Chen Z J,Zhao B,Liang Y X.Bioremediation of reclaimed wastewater used as landscape water by using the denitrifying bacterium Bacillus cereus.Bulletin of Environmental Contamination and Toxicology,2009,83(3):337-340.
[7]Thurston JA,Gerba C P,Foster K E,Karpiscak M M,Gerba C P.Fate of indicator microorganisms,giardia and cryptosporidium in subsurface flow constructed wetlands.Water Research,2001,35(6):1547-1551.
[8]Faulwetter J L,Gagono V,Sundberg C,Chazarenc F,Burr M D,Brisson J,Camper A K,Stein OR.Microbial processes influencing performance of treatment wetlands:a review.Ecological Engineering,2009,35(6):987-1004.
[9]Kennedy A C.Rhizosphere//Sylvia D M,Hartel P G,Fuhrman J J,and Zuberer Z A,eds.Principals and Applications of Soil Microbiology.Upper Saddle River:Pearson Prentice Hall Publishing,2005:309-407.
[10]Li Y H,Zhu JN,Zhai Z H.Endophytic bacterial diversity in roots of Phragmites australisin constructed Beijing Cuihu Wetland(China).FEMS Microbiology Letters,2010,309(1):84-93.
[11]Li Y H,Liu Y F,Liu Y,Zhu J N,Zhang Q.Endophytic bacterial diversity in roots of Typha angustifolia L.in the constructed Beijing Cuihu Wetland(China).Research in Microbiology,2011,162(2):124-131.
[12]Mustafa A,Scholz M.Characterization of microbial communities transforming and removing nitrogen in wetlands.Wetlands,2011,31(3):583-592.
[13]Ravit B,Ehrenfeld J G,Haeggblom M M,Bartels M.The effects of drainage and nitrogen enrichment on Phragmites australis,Spartina alterniflora,and their root-associated microbial communities.Wetlands,2007,27(4):915-927.
[14]Wei C,Liu P.Relationship between wastewater purification and diversity of rhizosphere microorganism in the constructed wetland.Journal of Agro-Environment Science,2008,27(6):2401-2406.
[15]Chazarenc F,Brisson J,Merlin G.Seasonal and spatial changes of microorganism communities in constructed wetlands:a community level physiological profiling analysis.International Journal of Chemical Engineering,2010,doi:10.1155/2010/490240.
[16]Yan Q M,Zhang X X,Zhang T,Fang H H P.Seasonal microbial community shift in a saline sewage treatment plant.Frontiers of Environmental Science and Engineering in China,2011,5(1):40-47.
[17]Kirk J L,Beaudette L A,Hart M,Moutoglis P,Klironomos J N,Lee H,Trevors J T.Methods of studying soil microbial diversity.Journal of Microbiological Methods,2004,58(2):169-188.
[18]Bohannan B JM,Hughes J.New approaches to analyzing microbial biodiversity data.Current Opinion in Microbiology,2003,6(3):282-287.
[19]Hughes J B,Hellmann J J,Ricketts T H,Bohannnan B J.Counting the uncountable:statistical approaches to estimating microbial diversity.Applied and Environmental Microbiology,2001,67(10):4399-4406.
[20]Gao C,Huang M R,Tao S,Sun X,Li J,Guo L D.Seasonal dynamics of culturable bacterium numbers in freshwater bodies of different water quality in Beijing.Acta Ecologica Sinica,2011,31(4):1157-1163.
[21]Hejcmanovā-NezerkováP,Hejcman M.A canonical correspondence analysis(CCA)of the vegetation-environment relationships in Sudanese savannah,Senegal.South African Journal of Botany,2006,72(2):256-262.
[22]Deng Z Z.On Water System and Rainwater Harvesting System in Beijing Olympic Green.Beijing:China Water Power Press,2009.
[23]Guo X Y,Dong Z,Gong H L.Influence of reclaimed water irrigation on microbial community on lawn soil.China Environmental Science,2006,26(4):482-485
[24]Sakai M,Matsunaga N,Matsuka A,Kanazawa S.Application of T-RFLPanalisis to the study of bacterial community structure in the rhizosphere.Soil Science and Plant Nutrition,2001,47(4):773-778.
[25]Dong X Z.Common Bacteria Identification Manual.Beijing:Chinese TCM Publishing House,2000.
[26]Sun L.Endophytic Bacteria and Root-Associated Bacteria with Rice by Culture-Independent and Culture-Dependent Approaches[D].Beijing:Capital Normal University,2006.
[27]Liang W,Wu Z B,Zhou Q H,Cheng SP,Fu G P.Analysis of substrate microorganisms in the constructed wetland and their correlation with wastewater purification effects.China Environmental Science,20r02,22(3):282-285.
[28]Wang X D,Zhai Z H,Zhao S.The bacterial diversity in different seasons of Miyun Resevoir.Acta Ecologica Sinica,2009,29(7):3919-3927.
[29]Li F D,Yu Z N,He SH.Agricultural Microbiology Experiment Technology.Beijing:China Agriculture Press,1996.
[30]Lu K H,Hu Z Y,Liang JJ,Zhu JY.Characteristics of rhizosphere microbial community structure of two aquatic plants in eutrophic waters.China Environmental Science,2010,30(11):1508-1515.
[31]Huang D F,Li T,Lu B.Pollutants removal and analysis of structure changes of microbial community in integrated vertical-flow constructed wetland.Research of Environmental Science,2007,20(6):137-141.
[32]Wang X D,Zhai Z H,Zhao S,Li R Q,Ma W L,Li Y H.Effect of free surface flow wetland and subsurface flow wetland on bacterial diversity in Beijing Cuihu Wetland Park.Environmental Science,2009,30(1):280-288.
[33]Zhou Q H,He F,Zhang L P,Wang Y F,Wu Z B.Characteristics of the microbial communities in the integrated vertical-flow constructed wetlands.Journal of Environmental Sciences,2009,21(9):1261-1267.
[34]Wang Z Q,Wang W D,Zhu G B,Yin C Q.A comparative study on the diversity of rhizospheric bacteria community structure in constructed wetland and natural wetland with reed domination.Acta Ecologica Sinica,2011,31(16):4489-4498.
[35]Liang W,Wu Z B,Zhan F C,Deng J Q.Seasonal variation of macrophytes root-zone microorganisms and purification effect in the constructed wetland system.Journal of Lake Sciences,2004,16(4):312-317.
[36]ter Braak C J F,Verdonschot P F M.Canonical correspondence analysis and related multivariate methods in aquatic ecology.Aquatic Sciences,1995,57(3):254-289.
[37]Shiah F K,Ducklow H W.Temperature regulation of heterotrophic bacterioplankton abundance,production,and specific growth rate in Chesapeake Bay.Limnology Oceanography,1994,39(6):1243-1258.
[38]Rivkin R B,Anderson M R.Inorganic nutrient limitation of oceanic bacterioplankton.Limnol Oceanogr,1997,42(4):730-740.
[39] Øvreås L,Bourne D,Sandaa R A,Casamayor E O,Benlloch S,Goddard V,Smerdon G,Heldal M,Thingstad T F.Response of bacterial and viral communities to nutrient manipulations in seawater mesocosms.Aquatic Microbial Ecology,1997,31(2):109-121..
[40]Kong F X,Gao G.Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes,Acta Ecologica Sinica,2005,25(3):589-595.
[41]Minana-Galbis D,Farfan M,Fuste M C,Lore J G.Aeromonas bivalvium sp.nov.,isolated from bivalve mollusks.Int.J.Syst.International Journal of Systematic and Evolutionary,2007,57(3):582-587.
[42]Pianetti A,Bruscolini F,Rocchi M B,Sabatini L,Citterio B.Influence of different concentrations of nitrogen and phosphorous on Aeromonas spp.growth.Igiene E SanitàPubblica,2006,62(6):609-622.
[43]Holguin G,Guzman M A,Bashan Y.Two new nitrogen-fixing bacteria from the rhizosphere of mangrove trees:their isolation,identification and in vitro interaction with rhizosphere Staphylococcus sp..FEMSMicrobiology Ecology Letters,1992,101(3):207-216.
[44]Chen B Q,Yin C Q.The ecological distributions of bacteria and algae in the stimulation wetland system.Acta Ecologica Sinica,1998,18(6):634-639.
参考文献:
[1] 周陆波,韩烈保.再生水灌溉草坪绿地的研究进展.节水灌溉,2004,5:17-20.
[2] 郭逍宇,宫辉力,赵文吉.再生水灌溉对草坪根际可培养细菌组成影响.微生物学报,2010,50(11):1519-1524.
[4] 文静.北京水务局发布再生水十二五规划.中国新闻网,2011-01-28.http://www.chinanews.com/ny/2011/01-28/2817700.shtml.
[5] 朱竞男,王晓丹,翟振华,马文林,李荣旗,王雪莲,李艳红.稻香湖景酒店景观再生水生产中的细菌群落结构变化.环境科学,2010,31(5):1299-1306.
[14] 魏成,刘平.人工湿地污水净化效率与根际微生物群落多样性的相关性研究.农业环境科学学报,2008,27(6):2401-2406.
[20] 高程,黄满荣,陶爽,孙翔,黎景,郭良栋.北京城区不同水质水体可培养细菌数量的季节动态变化.生态学报,2011,31(4):1157-1163.
[22] 邓卓智.北京奥林匹克公园水系及雨洪利用系统研究、设计及示范.北京:中国水利水电出版社,2009.
[23] 郭逍宇,董志,宫辉力.再生水灌溉对草坪土壤微生物群落的影响.中国环境科学,2006,26(4):482-485.
[25] 东秀珠.常见细菌系统鉴定手册.北京:中国中医药出版社,2000.
[26] 孙磊,非培养方法和培养方法对水稻内生细菌和根结合细菌的研究[D].北京:首都师范大学,2006.
[27] 梁威,吴振斌,周巧红,成水平,付贵萍.构建湿地基质微生物与净化效果及相关分析.中国环境科学,2002,22(3):282-285.
[28] 王晓丹,翟振华,赵爽.密云水库不同季节细菌群落多样性.生态学报,2009,29(7):3919-3927.
[29] 李阜棣,喻子牛,何绍红.农业微生物学实验技术.北京:中国农业出版社,1996.
[30] 陆开宏,胡智勇,梁晶晶,朱津永.富营养水体中2种水生植物的根际微生物群落特征.中国环境科学,2010,30(11):1508-1515.
[31] 黄德锋,李田,陆斌.复合垂直流人工湿地污染物去除及微生物群落结构的PCR-DGGE分析.环境科学研究,2007,20(6):137-141.
[32] 王晓丹,翟振华,赵爽,李荣旗,马文林,李艳红.北京翠湖表流和潜流湿地对细菌多样性的影响.环境科学,2009,30(1):280-288.
[34] 汪仲琼,王为东,祝贵兵,尹澄清.人工和天然湿地芦苇根际土壤细菌群落结构多样性的比较.生态学报,2011,31(16):4489-4498.
[35] 梁威,吴振斌,詹发萃,邓家齐.人工湿地植物根区微生物与净化效果的季节变化.湖泊科学,2004,16(4):312-317.
