电针预处理对脑缺血再灌注损伤大鼠谷氨酸和γ-氨基丁酸的影响
2013-09-12郭真真吴毅贾杰吴志远李明芬
郭真真 吴毅 贾杰 吴志远 李明芬
1990年Kitagawa等[1]发现对脑组织进行短暂缺血预处理后,可以产生“脑缺血耐受(brain ischemic tolerance)”。随后研究发现可诱导脑缺血耐受的预处理方法有缺氧/高氧[2]、药物[3]、低温[4]、运动[5]、缺血[6]和电针[7-15]等多种。
电针作为一种对机体刺激较小且行之有效的预处理方法,得到了研究人员的重视,并取得了很大进展。研究证明,电针预处理可明显减少缺血区脑细胞的凋亡[16],减小脑梗死体积,显著减轻大鼠的神经功能损害程度[17],并能改善大鼠缺血后突触的超微结构从而影响突触的可塑性[18]。相应的机制研究表明,电针预处理可以调节神经元NMDA受体2A和2B的表达[19-20],而重复电针预处理可增加内源性大麻素及其受体[21];Davies 等[22]及 Silkis 等[23]研究表明,大麻素与GABA、谷氨酸(glutamate,Glu)相互作用而调节 γ-氨基丁酸(GABA)、Glu的释放。
Glu是脑内主要的兴奋性氨基酸(EAA),对脑缺血神经细胞具有兴奋性毒性作用。郭景春等[24-25]证实电针可抑制细胞外兴奋性氨基酸的过量堆积。GABA是脑内的主要抑制性氨基酸,有证据表明[26-27],GABA可能通过超极化神经元膜电位并抑制Glu能的递质释放而对抗脑缺血时Glu的神经毒作用。电针预处理对脑缺血的脑保护作用机制是否与Glu和GABA有关,尚未检索到相关报道。因此,本实验拟通过检测电针预处理的脑缺血大鼠纹状体内Glu和GABA的动态变化,探讨电针预处理对脑缺血再灌注损伤的保护机制。
1 资料与方法
1.1 实验动物与分组 将18只2~3月龄雄性Sprague-Dawley(SD)大鼠(清洁级,体质量250~300 g,由中国科学院上海实验动物中心提供)随机分为3组:假手术组、缺血组和电针预处理组,每组6只。
1.2 电针预处理 在大鼠清醒状态下,用自备绳子将大鼠四肢固定在自制木板上,参照华兴邦大鼠穴位图谱,选取督脉经穴百会(GV20)、大椎(GV14)两穴。“百会”位于顶骨正中,“大椎”在第7颈椎与第1胸椎间,背部正中。以0.5寸毫针向前平刺百会约3 mm,斜刺大椎约10 mm,在两穴上接电针刺激仪形成闭合电流环路。电流强度以大鼠耳朵微颤为穴位刺激有效指标,疏密波(2/15 Hz),刺激 30 min,1 次/d,共 5 d。假手术组和缺血组无电针治疗。
1.3 微透析留置管的植入及大脑中动脉缺血(MCAO)模型的建立 电针预处理结束后第2天,用10%的水合氯醛(35 ml/kg)腹腔注射麻醉大鼠;将大鼠固定于立体定位仪上,切开头皮,暴露颅骨;于坐标为前囟向尾侧4.6 mm,中线偏外侧4 mm,深3.0 mm处钻2 mm大小的孔,植入一自制不锈钢留置管于大鼠纹状体区,并用牙托粉固定。把植入留置管的大鼠仰卧位放在头下方有一直径为2 cm大小孔洞的木板上(防止留置的透析管脱落)。缺血组和电针预处理组参照Longa法制备大鼠中动脉缺血(middle cerebral artery occlusion)模型[28]。假手术组只分离颈总动脉、颈外动脉和颈内动脉,而不结扎和放置线栓。
1.4 微透析采样 以人工脑脊液作为脑内微透析灌流液[29],用MD21001型针管式微量注射泵进样。大鼠麻醉后取俯卧位,头水平位固定在立体定位仪上并在麻醉状态下取样:(1)置入微透析探针:把平衡好的微透析探针插入已埋好留置管的大鼠脑内,将微透析探头(有效透析膜长度4 mm,MAB6.14.4探针,Stainless Steel)经留置管插入脑内,入口端通过塑料导管与微透析泵(MD-0100,bioanalytical system,USA)的注射器相连,出口端通过导管连接0.5 ml离心管,以收集透析液用于高效液相测定。(2)收集流出液:将平衡好的微透析探针插入已埋好留置管的大鼠脑内,流速为1 μl/min平衡90 min,收集所有流出液于一个微量管里,继续平衡30 min,收集所有流出液于另一微量管里。(3)收集对照液:维持流速2 μl/min在纹状体区进行微透析,测定微透析液中氨基酸含量的变化。每10 min收集1管透析液,共收集20 ml。分别在缺血前,插入线栓后 40、80、120 min,再灌注后 40、80、120、160、200、240 min 时收集透析液,整个过程共收集10管透析液。动物实验结束后用高效液相色谱(HPLC)-荧光检测法测定透析液中的Glu和GABA变化。
1.5 Glu和GABA递质的测定 参考顾拥军等[29]的方法,用高丝氨酸作内标,采用邻苯二甲醛(OPA)柱前衍生法行高效液相色谱分析。用保留时间做定性分析,峰面积内标法做定量分析。
1.6 神经行为学评分 在缺血再灌注后24 h、处死大鼠之前对其进行神经行为学评分,参照Zea-Longa五分制评分法:0分为无神经系统症状;1分为不能完全伸展对侧前爪;2分为爬行时转圈;3分为向对侧倾倒;4分为不能自行行走,意识丧失。评分为1~3分的为造模成功,并选入相应组别。
1.7 TTC染色 再灌注24 h神经功能损害评估完成后,立即给予过量的水合氯醛处死大鼠。迅速断头取脑,将脑放入-20℃冰箱中约15 min,然后用刀片从大脑额极至枕极连续冠状位切片5片,每片厚约2.5 mm,把脑片浸入到2%TTC磷酸盐缓冲液中(pH=7.4),并用锡箔纸避光染色30 min。染色结束后,电针预处理组和缺血组可以看到梗死区域,而假手术组中没有见到梗死区。用数码相机拍照脑片,然后计算脑梗死体积。每层脑片的梗死面积乘以脑片厚度就是该层脑片的梗死体积,5层梗死体积之和就是总梗死体积。
1.8 统计学分析 采用SPSS 16.0统计软件进行分析,数据以±s表示,P<0.05表示有统计学意义。组间比较采用单因素方差分析,组内比较采用重复测量数据的方差分析,整体比较先采用重复测量方差分析,再按时间点分层采用单因素方差分析或t检验进行组别间比较,按组别分层采用重复测量方差分析进行时间点间比较,具体时间点两两比较采用Bonferroni检验。组间两两比较采用Tukey法。
2 结果
2.1 Glu水平比较 假手术组缺血及再灌注各时间点与缺血前比较均无显著性差异(P>0.05)。缺血组大部分时间点(除外再灌注80 min和240 min)与缺血前比较有统计学差异(P<0.01);与缺血前水平相比,Glu水平在缺血40 min开始升高(P<0.01),80 min升高到峰值(P<0.01),120 min仍保持较高水平(P<0.01)。再灌注后开始下降,再灌注80 min时下降至正常水平,至120 min时发生二次升高(P<0.01),160 min时达二次升高高峰(P<0.01)。200 min后又降至正常(P<0.01),直至240 min一直保持正常水平。电针预处理组缺血及再灌注各时间点Glu水平与缺血前比较差异趋势与缺血组基本一致:缺血开始先迅速升高,直至40 min时达到最高水平(P<0.01),80 min(P <0.01)、120 min(P <0.01)仍处于较高水平;再灌注时开始下降,到80 min时处于正常水平,然后开始回升,160 min升至一个小高峰(P<0.01),然后又开始下降,直至240 min再次降至正常水平。
组间比较结果显示:除再灌注80 min和240 min外,缺血组大部分时间点与假手术组相应时间点比较有显著升高(P<0.01);除再灌注80 min和240 min外,电针预处理组大部分时间点与假手术组相应时间点比较有显著升高(P<0.01),电针预处理组的Glu水平在缺血40、80、120 min和再灌注后120、160 min等时间点与缺血组相应时间点比较有显著降低(P<0.05或P<0.01)。见表1。
表1 清醒大鼠脑缺血再灌注期间纹状体透析液中Glu水平的变化(±s,μmol/L)
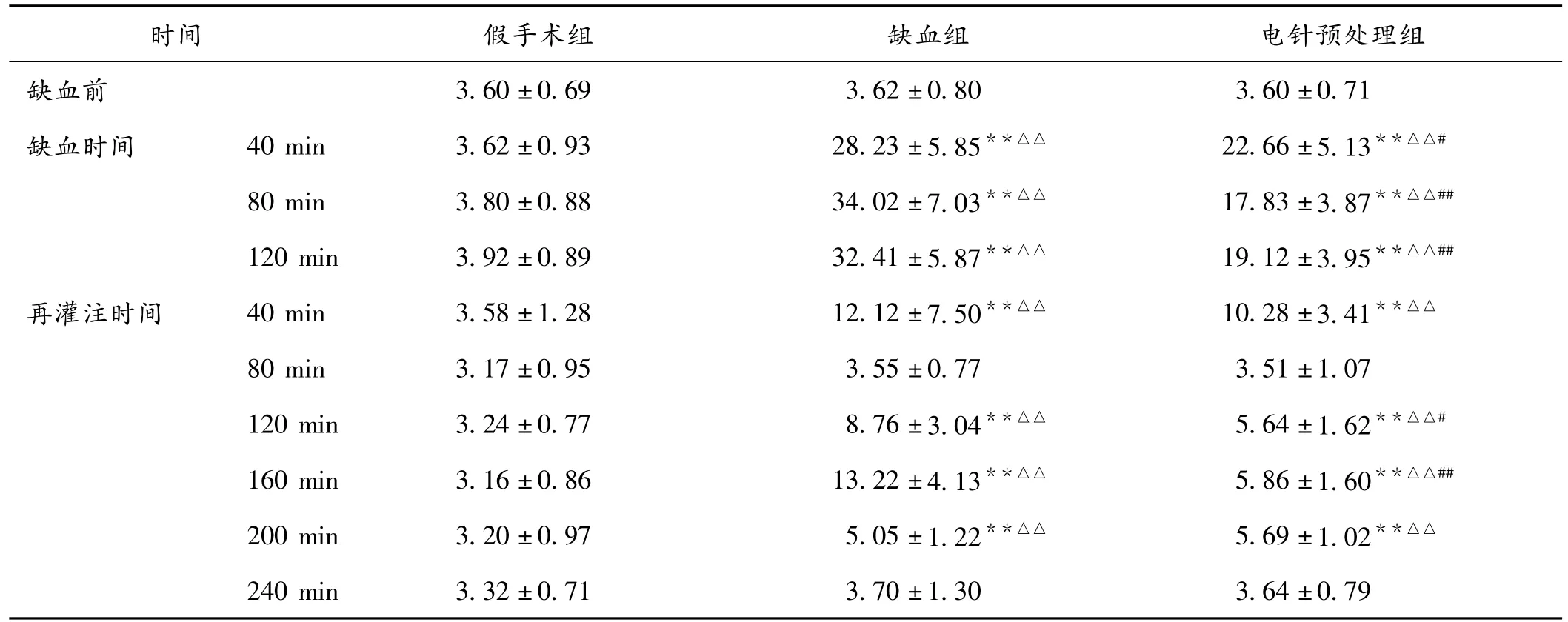
表1 清醒大鼠脑缺血再灌注期间纹状体透析液中Glu水平的变化(±s,μmol/L)
注:与缺血前比较,**P<0.01;与假手术组比较,△△P<0.01;与缺血组比较,#P<0.05,##P<0.01
时间 假手术组 缺血组 电针预处理组缺血前3.60±0.69 3.62±0.80 3.60±0.71缺血时间 40 min 3.62±0.93 28.23±5.85**△△ 22.66±5.13**△△#80 min 3.80±0.88 34.02 ±7.03**△△ 17.83 ±3.87**△△##120 min 3.92±0.89 32.41 ±5.87**△△ 19.12 ±3.95**△△##再灌注时间 40 min 3.58±1.28 12.12±7.50**△△ 10.28±3.41**△△80 min 3.17±0.95 3.55±0.77 3.51±1.07120 min 3.24±0.77 8.76 ±3.04**△△ 5.64 ±1.62**△△#160 min 3.16±0.86 13.22 ±4.13**△△ 5.86 ±1.60**△△##200 min 3.20±0.97 5.05±1.22**△△ 5.69±1.02**△△240 min 3.32±0.71 3.70±1.30 3.64±0.79
2.2 GABA水平比较 假手术组缺血及再灌注各时 间点与缺血前比较均无显著性差异(P>0.05)。缺血组各时间点与缺血前比较有显著统计学差异(P<0.01);缺血40 min开始升高(P<0.01),120 min升高到峰值(P<0.01),再灌注后开始下降,下降至再灌注40 min速度较快(P<0.01),之后一直到再灌注240 min呈现缓慢下降趋势(P<0.01)。电针预处理组缺血及再灌注各时间点GABA水平与缺血前比较差异趋势与缺血组基本一致:缺血开始先迅速升高(P<0.01)直至120 min时达到最高水平;再灌注后开始下降,下降至再灌注40 min速度较快(P<0.01),之后一直到再灌注240 min呈现较慢下降趋势(P<0.01)。
组间比较结果显示:缺血组各时间点与假手术组相应时间点比较有显著升高(P<0.01);电针预处理组各时间点与假手术组相应时间点比较有显著升高(P<0.01),电针预处理组缺血40、80、120 min和再灌后160、200 min与缺血组相应时间点比较有显著升高(P<0.05或P<0.01)。见表2。
表2 清醒大鼠脑缺血再灌注期间纹状体透析液中GABA的变化(±s,μmol/L)

表2 清醒大鼠脑缺血再灌注期间纹状体透析液中GABA的变化(±s,μmol/L)
注:与缺血前比较,**P<0.01;与假手术组比较,△△P<0.01;与缺血组比较,#P<0.05,##P<0.01
2.3 神经行为学评分比较 假手术组评分为0分,缺血组为(3.17±0.41)分,电针预处理组为(2.17±0.41)分,各组之间有显著的统计学差异(P<0.01),电针预处理组的行为学评分明显低于缺血组(P<0.01)。
2.4 各组大鼠脑梗死体积比较 采用单因素方差分析对各组缺血24 h脑梗死体积进行分析。由图1可知,缺血组的脑梗死体积最大[(158.67±12.86)mm3],电针预处理组脑梗死体积次之[(118.83±26.77)mm3],假手术组则没有发生脑梗死。电针预处理组的脑梗死体积小于缺血组脑梗死体积(P<0.01),说明电针预处理能够明显减小大鼠脑梗死体积。这与神经功能损害评估的结果是一致的。
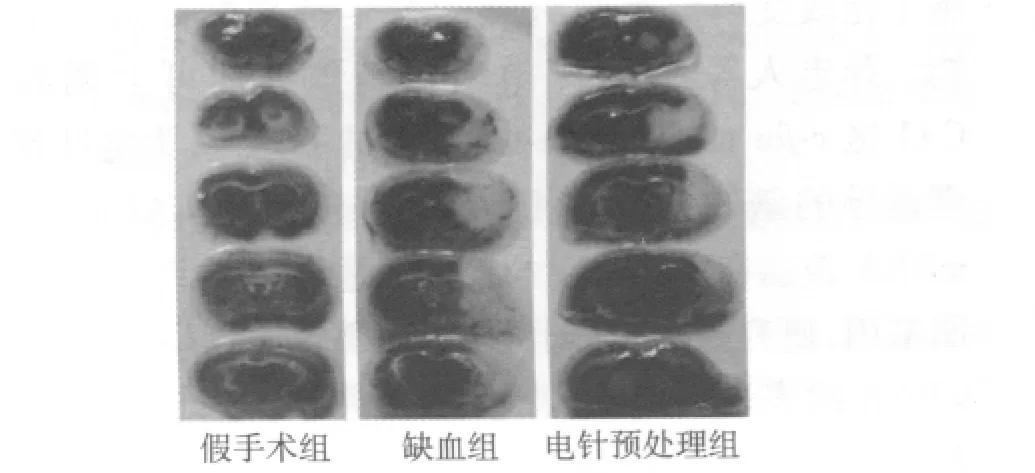
图1 各组大鼠脑组织梗死体积比较
3 讨论
EAA是中枢神经系统的主要兴奋性神经递质,包括 Glu、天冬氨酸(Asp)等。1971 年 Olney[30-31]首次提出“兴奋毒(excitotoxicity)”,他观察到全身应用Glu可导致脑内神经元的退行性病变。后来大量研究表明[32-35],脑缺血时细胞外液EAA增高,特别是EAA中的Glu增高更为显著,Glu的大量堆积使神经元持续去极化,增加了神经元内Glu的大量释放。有证据表明[36],一些对缺血再灌注损伤具有脑保护作用的药物可能是通过降低细胞外液Glu浓度、抑制Glu受体的表达从而降低Glu的兴奋毒作用而实现的。也有研究证实,采取一定的预干预措施诱导的脑保护作用可能是通过降低Glu浓度而实现的[5]。GABA是脑内的主要抑制性氨基酸,在脑缺血时可能通过对抗Glu的兴奋毒作用而起到脑保护效应,该效应通过激活GABA受体复合物来增加细胞外液中GABA浓度,从而导致跨过突触后膜的氯离子的流动增加,减轻脑缺血产生的损伤作用[37]。近年来已有学者将GABA作为脑缺血的一种治疗药物来研究,并取得了一定成果。
脑缺血耐受的发现,为研究内源性脑保护作用机制提供了新的思路,而电针作为一种刺激性小且行之有效的诱导脑缺血耐受的方法,更成为人们关注的焦点。电针预处理诱导脑缺血耐受的机制还不是很确切,归纳起来主要有以下几方面:(1)针刺预处理后能够使低氧诱导因子(HIF-1α)表达增加,是防止脑组织进一步缺血坏死的代偿性反应[8];(2)针刺预处理可以使脑组织内腺苷(ADO)含量增高,ADO可使K+-ATP通道开放提前或加强,从而限制Ca2+内流和兴奋性氨基酸的释放,继而稳定了神经细胞的膜电位,使脑的能量代谢降低,从而使脑组织产生对氧和能量供应障碍的耐受性[9];(3)电针预处理可诱导海马 CA1区HSP70mRNA及 HSP70的表达增强,提示HSP70 mRNA及HSP70的表达与针刺预处理诱导的脑缺血耐受可能有关[10];路志红等[11]研究发现电针预处理百会穴后,大脑皮质缺血区周围HSP70的表达,同样提示电针预处理诱导的脑缺血耐受与大脑皮质缺血区周围HSP70表达增强有关;(4)即早基因c-fos及c-fos蛋白是在受到胞外刺激后最先表达的一组基因,是联系细胞生化改变与细胞最终刺激发生特异性反应的中介物。孙忠人等[12]研究指出针刺预处理可上调海马CA1区c-fos mRNA及c-fos蛋白的表达,认为电针预处理诱导的脑缺血耐受机制可能与海马CA1区c-fos mRNA表达有关。Bcl-2癌基因是细胞凋亡的重要抑制基因,研究指出,针刺预处理可诱导海马CA1区Bcl-2 mRNA的表达,表明电针预处理诱导的脑缺血耐受机制可能与海马CA1区Bcl-2表达有关[13];(5)白细胞介素类和肿瘤坏死因子是体内分泌的具有调节多种细胞的一类活性物质,脑缺血区产生的炎性细胞因子可介导炎症级联反应,加重脑缺血损伤。王军等[14]研究发现电针预处理诱导的脑缺血耐受机制可能与降低炎性细胞因子含量及阻断炎症级联反应有关。(6)阿片受体可能参与电针预处理诱导的脑缺血耐受机制[15]。
本实验测定了电针预处理对脑缺血再灌注大鼠脑纹状体内Glu和GABA水平的动态变化,结果显示,在缺血大鼠Glu动态变化的第一个峰值(缺血80 min时)和再灌注后峰值(再灌注160 min时)的2个时间点,电针预处理后Glu水平均显著下调。与Glu变化趋势相似,在GABA动态变化的第一个峰值(缺血120 min时)和再灌注后160、200 min的3个时间点,电针预处理后GABA水平均显著上调。本实验也测定了各组大鼠缺血再灌注后脑梗死体积的变化及缺血再灌注24 h后神经行为学评分,结果显示电针预处理组的脑梗死体积小于缺血组的脑梗死体积,神经行为学评分低于缺血组。以上结果表明电针预处理诱导脑缺血耐受的保护作用可能与其下调脑缺血灌注后Glu的升高及上调GABA浓度有关,为电针预处理诱导脑缺血耐受的机制研究提供了新的可能性和关注。
本实验初步探讨了电针预处理对大鼠脑缺血再灌注期间Glu和GABA浓度水平的影响,推测电针预处理可能通过调整Glu和GABA浓度水平变化诱导缺血耐受的机制,为临床上应用电针预处理诱导脑保护作用提供了更有利的依据。但是电针预处理诱导脑缺血耐受的机制非常复杂,本实验也只是关注了其中的一个可能性,其确切机制还有待进一步探讨,电针预处理通过调整Glu和GABA浓度水平变化诱导缺血耐受更深层次的机制也有待进一步完善。
[1]Kitagawa K,Matsumoto M,Tagaya M,et al.‘Ischemic tolerance’phenomenon found in the brain[J].Brain Res,1990,528(1):21-24.
[2]金海龙,徐雪,李永旺,等.缺氧预处理对脑缺血大鼠海马超微结构的影响[J].中国神经免疫学和神经病学杂志,2010,17(5):317-319,322.
[3]张巾,董幼溪,刘耘.丹星通络汤对脑缺血再灌注大鼠神经生长因子表达的影响[J].实用老年医学,2012,26(1):68-70.
[4]杨家斐,余新光,周定标,等.亚低温预处理对大鼠局灶性脑缺血的保护作用[J].中华实验外科杂志,2003,20(2):185.
[5]贾杰,胡永善,吴毅,等.预运动训练对脑梗死大鼠脑内谷氨酸含量及其受体mRNA表达的影响[J].中国运动医学杂志,2008,27(4):443-446.
[6]李虹,郑世营,张正春,等.预处理对老年鼠脑缺血bcl-2表达及细胞凋亡的影响[J].实用老年医学,2005,19(5):251-252.
[7]王振宇,王希文,孙忠人,等.电针预处理对局灶性脑缺血再灌注大鼠pSTAT3蛋白表达的影响[J].针灸临床杂志,2012,28(7):49-51.
[8]韩雪梅,王春辉,常颖,等.针刺预处理对大鼠脑缺血后低氧诱导因子-1表达的影响[J].中国实验诊断学,2009,13(10):1347-1349.
[9]唐伟,邹飒枫.针刺预处理对脑缺血/再灌注大鼠脑水肿及腺苷水平的影响[J].中国中西医结合急救杂志,2007,14(3):166-168.
[10]唐伟,孙忠人,张力,等.针刺预处理全脑缺血大鼠海马CA1区细胞凋亡和热休克蛋白70 mRNA的表达[J].中国临床康复,2005,9(37):90-92.
[11]路志红,熊利泽,田磊,等.重复电针预处理对脑缺血再灌注大鼠脑皮层热休克蛋白70表达的影响[J].中华麻醉学杂志,2004,24(6):453-456.
[12]孙忠人,唐伟,王威,等.针刺预处理诱导全脑缺血大鼠海马CA1区即刻早期基因c-fos mRNA及其蛋白的表达[J]. 中国临床康复,2006,10(19):125-127.
[13]唐伟,王威,孙忠人,等.针刺预处理全脑缺血大鼠海马CA1区Bcl-2 mRNA的表达[J].中国中医基础医学杂志,2007,13(2):156-158.
[14]王军,于震,贾士奇,等.电针预处理对全脑缺血再灌流大鼠炎性细胞因子的影响[J].中国实用医药,2008,3(6):4-5.
[15]杨静,熊利泽,王强,等.阿片受体在电针预处理诱导大鼠脑缺血耐受效应中的作用[J].中华老年多器官疾病杂志,2006,5(3):218-221.
[16]丁炯,顾振,吴文忠,等.电针预处理对大鼠局灶性脑缺血的影响[J].中国临床康复,2004,8(1):106-108.
[17]熊利泽,路志红.重复电针预处理可减轻大鼠急性短暂性脑缺血损伤[J].第四军医大学学报,2001,22(21):封2.
[18]聂煌,劳宁,黄怡,等.电针预处理对脑缺血后突触结构的影响[J].中华神经外科疾病研究杂志,2012,11(2):132-135.
[19]陈泽斌,袁芳,梁凤霞,等.针刺预处理脑组织提取液抗大鼠脑缺血再灌注损伤作用探讨[J].中国针灸,2004,24(5):347-350.
[20]陈泽斌,邹峰,袁芳,等.针刺预处理对脑缺血再灌注大鼠顶皮质NR2A和NR2B蛋白表达的影响[J].中国中西医结合急救杂志,2005,12(2):79-83.
[21]Wang Q,Peng Y,Chen S,et al.Pretreatment with electroacupuncture induces rapid tolerance to focal cerebral ischemia through regulation of endocannabinoid system[J].Stroke,2009,40(6):2157-2164.
[22]Davies SN,Pertwee RG,Riedel G.Functions of cannabinoid receptors in the hippocampus[J].Neuropharmacology,2002,42(8):993-1007.
[23]Sil'Kis IG.Possible mechanism of cannabinoid-mediated modulation of signal transduction through the basal ganglia[J].Ross Fiziol Zh Im I M Sechenova,2002,88(2):144-157.
[24]夏艳,郭景春,赵鹏,等.脑内牛磺酸含量的降低可减弱针刺抗脑缺血作用[J].中国神经科学杂志,2003,19(1):32-35.
[25]郭景春,程介士.电针对脑缺血大鼠纹状体细胞外兴奋性氨基酸水平的影响[J].上海针灸杂志,2000,19(1):37-39.
[26]Costa C,Leone G,Saulle E,et al.Coactivation of GABA(A)and GABA(B)receptor results in neuroprotection during in vitro ischemia[J].Stroke,2004,35(2):596-600.
[27]甘平,郭景春,杨茹,等.针刺抗脑缺血损伤时脑内γ-氨基丁酸的作用[J].上海针灸杂志,2003,22(9):3-6.
[28]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[29]顾拥军,倪文,包维丽,等.反相高效液相色谱荧光法测定氨基酸类神经递质[J].上海医科大学学报,1995,22(3):210-212.
[30]Olney JW,Adamo NJ,Ratner A.Monosodium glutamate effects[J].Science,1971,172(3980):294.
[31]Olney JW.Glutamate-induced neuronal necrosis in the infant mouse hypothalamus.An electron microscopic study[J].J Neuropathol Exp Neurol,1971,30(1):75-90.
[32]Johnston MV.Excitotoxicity in perinatal brain injury[J].Brain Pathol,2005,15(3):234-240.
[33]Grewer C,Gameiro A,Zhang Z,et al.Glutamate forward and reverse transport:from molecular mechanism to transporter-mediated release after ischemia[J].IUBMB Life,2008,60(9):609-619.
[34]吴喆,赵宇阳,康秋君,等.谷氨酸代谢变化与脑缺血损伤[J].中国实用医药,2008,3(2):101-103.
[35]尚游,顾佩菲,尚宇,等.盐酸戊乙奎醚(长托宁)抑制脑缺血/再灌注时谷氨酸的释放及受体机制研究[J].中国应用生理学杂志,2011,27(3):353-356.
[36]孙永海,岳云,王云.异丙酚和咪唑安定预处理对大鼠全脑缺血损伤的保护及递质机制[J].中风与神经疾病杂志,2005,22(4):344-347.
[37]Babcock AM,Everingham A,Paden CM,et al.Baclofen is neuroprotective and prevents loss of calcium/calmodulin-dependent protein kinase II immunoreactivity in the ischemic gerbil hippocampus[J].J Neurosci Res,2002,67(6):804-811.
