干旱胁迫下丛枝菌根真菌对玉米生理生化特性的影响
2013-09-12秦子娴朱敏郭涛
秦子娴,朱敏,郭涛
(西南大学资源环境学院,重庆400716)
玉米是我国北方和西南山区的主要粮食作物之一,目前限制玉米生长及其产量的重要因素之一是干旱[1]。在我国干旱和半干旱地区约占国土面积的50%,主要分布于西部地区。据不完全统计,由于干旱造成的作物减产和植物生长减少远远超过了其他逆境造成的总和[2]。因此水分胁迫一直是农业研究的重点之一。
丛枝菌根 (arbuscular mycorrhiza fungus,AMF)是分布于各种陆地生态系统中最广的一类内生菌根,它能够与大多数植物共生,目前已知世界上大约有90%的有花植物以及苔藓、蕨类等植物都能与AMF形成丛枝菌根[3]。大量的实验结果已经表明,AM真菌能够改善植物的水分状况,提高植物的抗旱能力[4]。因此利用丛枝菌根生物技术提高玉米抗旱能力具有重要的实践意义和理论意义。
然而,农田土壤中的有效磷直接影响到AMF的发育和对植物的接种效应,土壤磷营养状况会影响丛枝菌根真菌的侵染。在玉米生产过程中,经过过去30年大量施用化肥,我国农田有效磷含量整体上得到了很大的提高[5]。因此,有关AM真菌作用的研究,应该考虑到土壤肥力变化的新情况,更多地关注在土壤有效磷含量逐渐升高的条件下AM真菌的作用及其机制,以往研究AM真菌促进植物的生长及抗旱性多是在土壤磷含量较低的条件下进行的,在高磷土壤条件下研究较少。在土壤中磷营养状况较高的情况下,菌根共生体是否还会发挥其抗旱的作用成为丛枝菌根真菌在玉米生产中应用须首先考虑的因素[6]。因此,本试验通过盆栽试验采用有效磷较高的土壤(48.73 mg/kg),研究三种不同水分处理下AMF对玉米抗旱效应的影响,探讨AMF的抗旱性作用和机理,为其进一步的研究提供理论依据。
1 材料与方法
1.1 试验材料
供试作物:玉米(Zea mays L.)品种为东单80,播种前用10%H2O2对种子表面消毒10 min,然后用去离子水清洗,在25℃恒温培养箱催芽,种子露白大约1cm左右进行播种。
供 试 AM 菌 种:Glomusintraradices(G.intraradices)和 Glomus etunicatum(G.etunicatum),两个菌种均来自中国农业大学资源环境学院。菌种采用了三叶草、玉米盆栽扩繁,接种剂含有真菌孢子、根外菌丝和以及被宿主植物侵染的根段,每克菌剂含有孢子数20~30个。
供试土壤为中性紫色土,采自西南大学国家紫色土肥力与肥料效益监测站。基本性状为pH 6.7、有机质 21.51g/kg、全氮 0.57 g/kg、全磷 1.07 g/kg、全钾15.44 g/kg、碱解氮28.34 mg/kg、有效磷48.73 mg/kg、速效钾72.95 mg/kg。田间最大持水量36.06%。土壤经湿热灭菌处理,风干后备用。
1.2 试验设计
盆栽试验在西南大学资源环境学院网室中进行,试验采用两因素设计,设置3个水分梯度,分别为田间最大持水量的70%(正常供水)、45%(中度干旱)、20%(重度干旱),同一水分条件下设接种G.intraradices、G.etunicatum 和不接种(CK)3个处理,每个处理重复5次,随机排列,共45盆。每盆装土6 kg,接种处理每盆施菌剂600 g,对照处理加同等质量的灭菌菌剂。选出芽1cm左右颗粒饱满的种子播种,每盆播种3粒。出苗5 d后间苗,每盆留长势相近的两棵。植株生长期间各处理统一正常浇水量,考虑到早期干旱对于AMF孢子萌发、菌丝侵染可能会有抑制作用,待生长45 d(AMF侵染根系后)开始土壤水分处理,每天用称重法浇水补充水分。
1.3 测定项目及方法
盆栽干旱胁迫期间每天上午11时测定每株玉米同一部位叶片水势,胁迫7 d后进行取样测定玉米叶片过氧化物酶、过氧化氢酶、脯氨酸、丙二醛含量,之后对植株地上部和地下部分别收获。根系用去离子水洗净,剪成1cm左右的根段,混匀后随机取约1g测菌根侵染率。剩下的样品105℃杀青30 min时后70℃烘干,用于生物量的测定。土壤样品风干备用。
植株收获时菌根侵染率按照方格交叉法测定[7];菌丝密度按照 Abbott等人[8]的方法进行。植株全磷含量采用钒钼黄比色法[9]。过氧化物酶和过氧化氢酶活性分别采用愈创木酚法和高锰酸钾滴定法,脯氨酸采用茚三酮比色法,丙二醛的含量采用硫代巴比妥酸法[10]测定。玉米水势的测定采用美国产PSYPRO型便携式露点水势仪,用L51探头活体测定,原位探头夹住各处理植株顶部以下第3片叶测定读数,重复测定3次,取其平均值作为该处理叶片水势值,连续测定7 d,取其平均数。
应用SPSS软件对试验数据进行二因素和单因素统计分析,5%水平下LSD多重比较检验各处理平均值之间的差异显著性。
2 结果与分析
2.1 水分胁迫下接种丛枝菌根真菌对玉米生长状况的影响
结果表明,玉米植株地上部的生物量随着土壤水分含量的减少显著降低,因此水分胁迫明显抑制了玉米的生长。在不同的水分梯度下,与对照相比,接种G.intraradices和G.etunicatum均都显著促进了玉米的地上部的生长,接种AMF处理对植物磷含量也有相同的趋势,但接种 G.intraradices和 G.etunicatum处理之间的差异不明显。对照处理玉米根系未检测到菌根真菌侵染结构(表1),接种处理的菌根真菌侵染率随着水分梯度的下降而显著性降低,说明了土壤干旱抑制了菌根真菌对玉米根系的侵染。随着水分胁迫的加强,接种处理的菌丝密度也显著降低,表明水分胁迫明显抑制了菌根的发育。在同一水分梯度条件下,接种不同丛枝菌根真菌之间侵染率和菌丝密度均无显著差异。
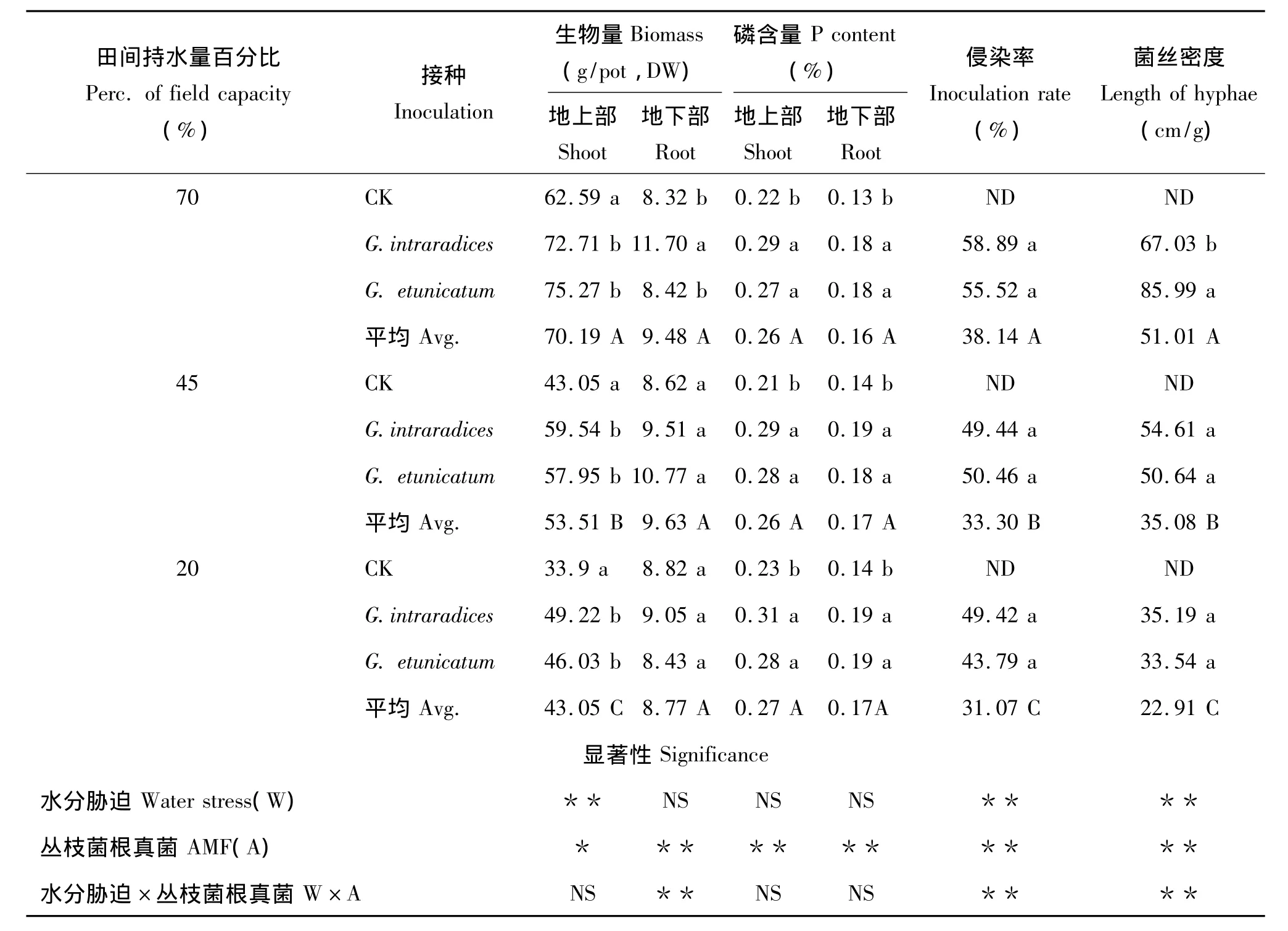
表1 不同处理对玉米生物量、磷含量、菌根侵染率和菌丝密度的影响Table 1 Effects of different treatments on dry weight,P content,percentage of root colonized and hyphal density of maize plants
2.2 水分胁迫下接种丛枝菌根真菌对玉米叶水势的影响
水势是作物水分状况的一个重要生理指标,作物在干旱下维持较高的水势是作物适应干旱的重要生理机能[11]。图1表明,水分胁迫显著降低了玉米叶片水势,接种AMF均不同程度地显著提高了玉米叶片水势,在正常供水下,与对照相比接种 G.intraradices和G.etunicatum的叶水势分别提高了21.52%和19.73%。同样,中度干旱和重度干旱处理时,与未接种株相比较,接种株表现出了相同的趋势。且在重度干旱处理时,丛枝菌根真菌提高叶片水势能力最强。
2.3 水分胁迫下丛枝菌根真菌对玉米叶片脯氨酸、丙二醛、保护酶活性的影响
脯氨酸是植物体内重要的渗透调节物质,在土壤干旱条件下,植物通过合成大量的脯氨酸来增强植株的渗透调节作用,以保护各种抗氧化酶的活性。因此,脯氨酸含量的高低可以反映植物遭受干旱的强弱[10]。由表2可见,玉米叶片脯氨酸随着胁迫的加强而显著升高,在中度干旱和重度干旱下接种AMF均显著降低了叶片脯氨酸的含量,说明接种AMF能够改善玉米的水分代谢。水分胁迫与AMF对叶片脯氨酸的含量有极显著的交互作用。
植物在干旱胁迫下,产生的氧自由基增多,会增加植物叶片膜脂过氧化程度,丙二醛(MDA)是膜脂过氧化作用的最终分解产物,其含量的多少反映细胞膜脂过氧化强弱程度。表2表明,随着胁迫的加强,玉米叶片的MDA含量显著增加,在不同水分梯度下接种AMF均显著降低玉米叶片的MDA含量,且在重度干旱胁迫下接种AMF对于膜脂过氧化程度的缓解作用最强。水分胁迫与AMF的交互作用对于叶片MDA的影响未达到显著水平。

图1 不同处理对玉米叶水势的影响Fig.1 Effects of different treatments on leaf water potential of maize

表2 不同处理对玉米叶片脯氨酸、丙二醛和保护酶(POD和CAT)活性的影响Table 2 Effects of different treatments on the activities of Prolin,MDA,POD and CAT of maize leaves
过氧化物酶(POD)和过氧化氢酶(CAT)是植物重要的保护酶,其活性与植物的抗旱性密切相关。由表2可以看出,随着胁迫的增强,POD和CAT的活性显著增加。与未接种处理相比,在正常供水条件下,接种G.intraradices处理的POD和CAT分别提高了100%、11.87%;接种G.etunicatum处理分别提高了135.60%、11.97%。在重度干旱下,接种G.intraradices处理的 POD和 CAT分别提高了25.61%、10.16%;接种G.etunicatum处理的分别提高了33.47%、12.11%。在正常供水和重度干旱下,接种G.intraradices和G.etunicatum与对照相比均差异极显著,说明无论是否干旱接种AMF均能够有效地增强保护酶活性。因此,也可以初步认为,AMF对于提高植物抗旱性是与提高保护酶活性密切相关的。水分胁迫与AMF的交互作用对于叶片POD的影响达到显著水平,但对 CAT的影响不显著。
3 讨论
已有大量研究表明接种AMF能改善宿主植物的水分状况[1,3-4],但大部分研究是在低磷营养状况下进行的,且认为在磷水平较高的土壤中作用不明显[12]。
干旱条件下菌根对植物的效益首先要保证菌根有较高的侵染率。大多数观点认为高磷环境不利于菌根侵染[13-14]。然而,在本试验土壤有效磷含量较高的条件下,AMF不仅与宿主植物形成了菌根共生体,在3种不同水分梯度处理下均达到了40%以上,显著增加玉米植株地上部和地下部的磷含量,促进了地上部的生长。这对于改善植株的生理状况,促进作物的生长发育有着重要作用。在干旱条件下植株的水势可降到较低的水平(图1),在高磷土壤中,Nelsen等[15]的试验表明,接种 AM 菌根没有影响洋葱的叶水势和蒸腾速率等。Bolgiano等[16]认为,高磷对菌根菌侵染的抑制作用会导致对植物水分代谢的不明显。然而,本研究表明玉米叶片水势随着干旱胁迫的加强而显著降低,且AM真菌显著提高了同一水分处理下的叶片水势,利于植株从土壤中吸收水分,提高了植物耐旱能力,对于 G.intraradices和G.etunicatum菌种,提高玉米叶水势的能力差异不显著,这与曾秀华等[17]的研究结果相似。这可能是试验选取的菌种本身比较耐旱,因为AM真菌本身具有一定的抗旱性[18]。也可能是由于玉米生长需磷量大,在高磷的土壤条件下玉米通过吸收大量的磷来满足自身对磷素的需求从而改善了植物的营养状况,有利于光合磷酸化等许多与光合作用有关的环节正常运行,也促进光合产物的运输和分配,光合产物向根的运输和分配又促进了AM真菌菌丝的生长发育和对玉米根系的侵染[19],通过菌丝的直接吸水影响植物的水分代谢[20]。二者相互作用使得AM真菌提高了植株的抗旱性。
干旱能够影响植物的水分状态,而缺水会降低植物体内的代谢活动,植物体为缓解干旱胁迫的影响会诱导或加速多种生理反应,如脯氨酸等渗透调节物质的积累[21]。该物质的积累可以通过渗透调节来稳定植物体内渗透压的平衡以增强自身保水的能力,其积累量随植物体受胁迫程度的增加而增加[22]。本试验的研究中,玉米叶片的脯氨酸含量随着水分胁迫的加强而显著增加。在同一水分处理下,接种AMF显著降低了脯氨酸累积量,这说明接种AMF改善了植株水分代谢,有效减轻了植株受胁迫的程度。POD和CAT是植物体内保护酶系统,在逆境下,保护酶活性下降,细胞内自由基平衡被打破,自由基累积增加,造成膜脂过氧化,产生较多有毒产物MDA,使膜结构受损程度加重,导致植物受害甚至死亡。在本研究中随着水分胁迫的加强植株保护酶活性显著提高,且不同水分梯度接种AM真菌的植株保护酶活性均显著高于未接种株,膜脂过氧化程度轻,其产物MDA含量低,膜损伤程度就低,增强了植物抗旱性。这与前人研究AMF提高植物抗旱机理结果是一致的[4,23-24],本研究也充分证明了丛枝菌根增强了与寄主植物抗旱性相关的保护酶(如POD、CAT)活性,从而增强了玉米的抗旱性这一观点。
目前,丛枝菌根真菌在提高植物玉米抗旱性的机理研究有着多种结论[1,3]。有研究者认为接种AMF提高宿主植物抗旱主要是AMF的侵染扩大了宿主植物根系与土壤接触的表面积从而增强了宿主植物对水分的运输,菌丝增加对土壤中水分的吸收,改善植株水分状况,从而提高植株抗旱性[25];AMF通过改变植物体内源激素来间接影响植物水分代谢[26];通过增加植物体内可溶性碳水化合物,如游离氨基酸、可溶性糖等物质的浓度,使细胞渗透势降低,提高宿主植物保持水分的能力[26]。
综上所述,本次试验证明了在土壤有效磷较高的土壤条件下,AMF也能与玉米根系建立良好的共生关系,改善水分状况。这为丛枝菌根技术在玉米抗旱性上的应用提供依据,关于其机理还需要更进一步的研究,特别是丛枝菌根真菌的外延菌丝网络在提高宿主植物抗旱性中的作用。
[1] Boomsma C R,Vyn T J.Maize drought tolerance:Potential improvements through arbuscular mycorrhizal symbiosis?[J].Field Crops Res.,2008,108:14-31.
[2] IPCC,2007.Summary for policymakers[A].Parry M L,Canziani O F,Palutikof J P et al.Climate change 2007:Impacts,adaptation and vulnerability.contribution of working groupⅡto the fourth assessment report of the intergovernmental panel on climate change[C].Cambridge,UK:Cambridge University Press,7-22.
[3] Smith S E,Read D J.Mycorrhizal symbiosis(3rd ed.)[M].London:London Academic Press,2008.145-187.
[4] Augé R M.Arbuscular mycorrhizae and soil/plant water relations[J].Can.J.Soil Sci.,2004,84:373-381.
[5] Zhang F S.Development and application of the nutrients managing technology for high yielding crop production and environmental friend ship[M]. Beijing:China AgriculturalUniversity Press,2008.
[6] 冯固,张福锁,李晓林,等.丛枝菌根真菌在农业生产中的作用与调控[J].土壤学报,2010,47(5):995-1004.Feng G,Zhang F S,Li X L et al.Functions of arbuscular mycorrhizal fungi in agriculture and their maninpulation[J].Acta Pedol.Sin.,2010,47(5):995-1004.
[7] Giovannett M,Mosse B.An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in root[J]. New Phytol.,1980,84:489-500.
[8] Abbott L K,Robson A D,Deboer G.The effect of phosphorus on the formation of hyphae in soil by the vesicular arbuscular mycorrhizal fungus Glomus fasciculatum[J].New Phytol.,1984,97:437-446.
[9] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.107-314.Lu R K.Analytical method for soil and agricultural chemistry[M].Beijing:China Agricultural Science and Technology Press,2000.107-314.
[10] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2002.Li H S.Principles and techniquesofplantphysiological biochemicalexperiment[M]. Beijing:HigherEducation Press,2002.
[11] 邵宏波,梁宗锁,邵明安.小麦抗旱生理生化和分子生物学研究进展与趋势[J].草业学报,2006,15(3):13-17.Shao H B,Liang Z S,Shao M A.Progress and trends in the study of anti-drought physiology and biochemistry,and molecular biology of Triticum aestivum[J].Acta Prat.Sin.,2006,15(3):13-17.
[12] 毕银丽,李晓林,丁保健.水分胁迫条件下接种菌根对玉米抗旱性的影响[J].干旱地区农业研究,2003,21(2):7-12.Bi Y L,Li X L,Ding B J.Influence of VA mycorrhiza on maize resistance to drought[J].Agric.Res.Arid Areas,2003,21(2):7-12.
[13] 冯海艳,冯固,王敬国,等.植物磷营养状况对丛枝菌根真菌生长及代谢活性的调控[J].菌物系统,2003,22(4):589-598.Feng H Y,Feng G,Wang J G et al.Regulation of P status in host plant on alkaline phosphatase(ALP)acticity in intraradical hyphae and development of extraradical hyphae of AM fungi[J].Mycosystema,2003,22(4):589-598.
[14] 张国盛,张仁陟.水分胁迫下氮磷营养对小麦根系发育的影响[J].甘肃农业大学学报,2001,36(2):163-167.Zhang G S,Zhang R Z.The influence of nitrogen,phosphorus nutrition on the root characteristics matters of spring wheat under water stress[J].J.Gansu Agric.Univ.,2001,36(2):163-167.
[15] Nelsen C E,Safir G R.The water relations of well-watered,mycorrhizal and non-mycorrhizal onion phants[J].J.Am.Soc.Hortic.Sci.,1982,107(2):271-274.
[16] Bolgiano N C,Safir G R,Warncke D D.Mycorrhizal infection and growth of onion in the field in relation to phosphorus and water availability[J].J.Am.Soc.Hortic.Sci.,1983,108(5):819-825.
[17] 曾秀华,叶少萍,白昌军,等.接种丛枝菌根真菌(AMF)及施磷量对狗牙根抗旱性的影响[J].热带作物学报,2011,32(6):1069-1074.Zeng X H,Ye S P,Bai C J et al.Effects of arbuscular mycorrhizal fungi(AMF)on the droughtresistance of bermudagrass under different phosphorus application rates[J].Chin.J.Trop.Crops,2011,32(6):1069-1074.
[18] Fagbola O,OsonubiO,Mulongoy K et al.Effects of drought stress and arbuscular mycorrhiza on the growth of Gliricidia sepium(Jacq).walp,and Leucaena leucocephala(Lam.)de Wit in simulated eroded soil conditions[J].Mycorrhiza,2001,11:215-223.
[19] Jakobsen I,Rosendahl L.Carbon flow into soil and external hyphe from root of Mycorrhizal cucumberplants[J].New Phytol.,1990,115:77-83.
[20] 唐明,陈辉,商鸿生.丛枝菌根真菌(AMF)对沙棘抗旱性的影响[J].林业科学,1999,35(3):48-52.Tang M,Chen H,Shang H S.Effects of arbuscular mycorrhiza(AMF)on hiphophae rhamnoides drought-resistance[J].Sci.Sil.Sin.,1999,35(3):48-52.
[21] Qu T,Nan Z B.Research progress on responses and mechanisms of crop and grass under drought stress[J].Acta Prat.Sin.,2008,17(2):126-135.
[22] 史燕山,骆建霞,王煦,等.5种草本地被植物抗旱性研究[J].西北农林科技大学学报,2005,33(5):130-134.Shi Y S,Luo J X,Wang X et al.The study of drought resistance from 5 herbaceous ground cover plants[J].J.Northwest A&F Univ.,2005,33(5):130-134.
[23] 吴强盛.丛枝菌根真菌对柑橘抗旱性的作用及其机理研究[D].武汉:华中农业大学博士论文,2006.Wu Q S.Study on the effect and mechanism of arbuscular mycorrhizal fungi in drought resistance of citrus[D].Wuhan:PhD dissertation,Huazhong Agriculture University,2006.
[24] 贺学礼,高露,赵丽莉,等:水分胁迫下丛枝菌根AM真菌对民勤绢蒿生长与抗旱性的影响[J].生态学报,2011,31(4):1029-1037.He X L,Gao L,Zhao L L et al.Effects of AM fungi on the growth and drought resistance of Seriphidium minchünense under water stress[J].Acta Ecol.Sin.,2011,31(4):1029-1037.
[25] Rillig M C,Mardatin N F,Leifheit E F,Antunes P M.Mycelium of arbuscular mycorrhizal fungi increases soil water repellency and is sufficientto maintain water-stable soil aggregates[J].Soil Biol.Biochem.,2010,42:1189-1191.
[26] Ruiz-Lozano J M.Arbuscular mycorrhizal symbiosis and alleviation of osmotic stress new perspectives for molecular studies[J].Mycorrhiza,2003,13(6):309-317.
