土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响
2013-09-11张光灿张淑勇徐志强
裴 斌,张光灿,张淑勇,吴 芹,徐志强,徐 萍
(山东省土壤侵蚀与生态修复重点实验室/山东农业大学林学院/国家林业局泰山森林生态站,泰安 271018)
植物光合作用是地球上最重要的化学反应过程[1],光合作用效率是植物生产力和作物产量高低的决定性因素[2]。光合作用对环境因子的响应高度敏感,干旱胁迫是植物经常遭受的逆境形式,对植物光合作用过程有着重要的影响,植物受到干旱胁迫时光合作用被限制,净光合速率下降[3]。迄今为止,对于逆境下植物光合作用限制因素的研究较多,但取得结果和结论还存在一定的差别[4]。例如,在干旱胁迫下植物光合作用水平下降的原因,有的研究结果是气孔因素(气孔关闭引起CO2供应受阻)为主[5],或是非气孔因素(叶肉细胞光合活性下降)为主[6],也有的认为是气孔与非气孔因素共同作用的结果[7]。综合分析不同的研究结果表明,水分胁迫环境下植物光合速率下降的主要原因,是气孔限制还是非气孔限制抑或是两者的共同作用,不仅与试验植物的种类、年龄、生长状况等有关,而且与试验处理方式(水分胁迫强度和时间)以及测定指标等有关[7-11]。另外,干旱环境抑制植物光合作用的机理比较复杂,涉及到诸多生理、生化与生态因子的影响。因此,必须在具体的试验条件下同时进行气体交换参数以及叶绿素荧光参数测定[12],并参考光合作用过程中发生的一系列生理生化指标特别是抗氧化酶活性的变化情况[13-15],才可能对土壤干旱逆境下不同植物光合作用的抑制机理有更加深入系统和客观准确的认识。
沙棘为胡颓子科沙棘属落叶灌木或小乔木,具有抗逆能力强,适应性广的特点,是我国黄土高原等干旱半干旱地区植被恢复重建中常用的生态与经济树种。迄今为止,关于水分胁迫下沙棘光合作用的研究多见于光合生理参数日变化特征[16-18]以及生理生化特性[19-20]等方面报道,对沙棘在干旱胁迫下光合作用光响应特征、叶绿素荧光动力学特征以及与抗氧化酶活性协同作用的研究较少,据此探讨沙棘光合作用的抑制机理及其与土壤水分定量关系的研究尚未见报道。而且,已有的研究多是基于少数几个土壤水分亏缺程度(如轻度胁迫、中度胁迫和重度胁迫)下的试验结果[17-18],还缺乏在土壤干旱逐渐加剧过程中对多土壤水分梯度下光合作用的连续观测研究。因此,沙棘在干旱胁迫下光合作用下降的过程、机制及其与土壤水分的定量关系等诸多生理学问题还不十分清楚。为此,在半干旱黄土丘陵区,以沙棘3年生苗木为试料,采用盆栽控水试验,测定了土壤干旱加剧过程中8个水分梯度下沙棘叶片光合作用的气体交换、叶绿素荧光、抗氧化酶活性等生理生化参数的变化。研究目的:1)探讨沙棘在土壤干旱逐渐加重过程中叶片光合作用的变化过程;2)揭示沙棘光合作用对土壤水分胁迫的响应机制及其与土壤水分的定量关系。为深入了解沙棘的光合生理生态特征、指导沙棘在黄土高原等干旱缺水地区的合理栽培提供参考。
1 材料与方法
1.1 试验区概况
试验地位于山西省吕梁山西麓的方山县峪口镇土桥沟流域(北纬37°36'58″,东经110°02'55″),为黄河中游黄土丘陵沟壑区。流域内最高海拔1446 m,平均海拔1200 m左右。属暖温带大陆性季风气候,多年平均降水量416 mm,且年内分配不均,6—9月份降水占全年的70%以上。多年平均蒸发量达1857.7mm,最大蒸发出现在4—6月,明显大于同期降水,干燥度1.3,年平均大气相对湿度为50%,表现出典型的北方严重春旱的特征。多年平均气温7.3℃,极端最高温35.6℃(1980-05-29),极端最低温-25.3℃(1980-01-30);年无霜期140 d,日照总时数2496 h;多年平均≥10℃的活动积温2819.7℃。地表为新生代第四纪马兰黄土(厚度20—100 m),土壤为中壤质黄绵土,有黄土母质直接发育形成,层次过渡不明显,质地均匀;试验区平均土壤容重1.20 g/cm3,田间持水量23.0%左右,土壤pH值8.0—8.4。该流域属森林草原灌丛植被区,乔木树种主要有刺槐(Robinia pseudoacacia)、白榆(Ulmus pumila)、油松(Pinus tabulaeformis)、侧柏(Platycladus orientalis);灌木主要有黄刺玫(Rosa xanthina)、沙棘(Hippophae rhamnoides)、大果榆(Ulmus macrocarpa);草本植物以菊科和禾本科为主,菊科蒿属居多。
1.2 试验材料与水分控制
选用生长健壮、无病虫害、生长势基本一致的3年生沙棘苗木为供试材料。2010年3月进行苗木盆栽培育(共栽植6盆,每盆1株),每个花盆(内径38cm,深45cm)装相同野外大田土20kg,至7月份进行土壤水分处理和光合作用观测。用环刀法测得盆栽土壤容重在1.20g/cm3左右、田间持水量为23.4%。在田间环境条件下(盆长期埋于土壤中,使盆内土壤与田间土壤同温),采用人工给水后通过自然耗水的方法获取盆栽土壤水分梯度。即选取生长健壮的盆栽苗3株(3盆),试验观测前2 d充分浇水使土壤水分饱和,以后不再浇水使其自然干旱。采用烘干法测定土壤重量含水量(GWC%),根据GWC与田间持水量(FC%)的比值求得土壤相对含水量(RWC%)。干旱处理2d后获得初期土壤水分含量(GWC为22.5%,RWC为96.2%),进行第1次光合作用测定。依据D-最优性法则和以往观测经验,以后每隔2d获取一个土壤水分含量共获取8个土壤水分含量系列。GWC 分别为22.5%、19.4%、16.5%、13.7%、11.3%、9.1%、7.2%和 6.1%,RWC 分别为 96.2%、82.9%、70.5%、58.6%、48.3%、38.9%、30.8%和26.1%。试验期间为防止降雨对土壤水分连续消耗的干扰,采用搭建简易遮雨棚的方法,防止雨水进入土壤水分控制区。
1.3 测定内容与方法
1.3.1 光合作用光响应过程测定
在每一试验植株中部选3片生长健壮的成熟叶片,应用英国PPS公司生产的CIRAS-2型光合作用系统,在晴朗的天气下测定不同土壤水分下光合作用的光响应过程。每个土壤水分处理水平下测定1d,时间在8:30—11:00之间,在每一植株上测定标记过的同一叶片,每个叶片重复3次记录,取平均值进行分析。测定时使用大气CO2浓度((380±6.0)μmol/mol),大气温度24—26℃之间,相对湿度(60±4.0)%左右。利用LED光源控制光合有效辐射强度(PAR,μmol·m-2·s-1)在1800、1600、1400、1200、1000、800、600、400、250、150、100、50、20、0 μmol·m-2·s-1。每个光照强度下控制测定时间为120 s。仪器自动记录净光合速率(Pn,μ mol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、气孔导度(Gs,mmol·m-2·s-1)、胞间CO2浓度(Ci,μmol/mol)等光合作用参数,叶片水分利用效率(WUE,μmol/mmol)和气孔限制值(Ls)分别用公式计算:WUE=Pn/Tr[21],Ls=1-Ci/Ca[22],其中 Ca为空气 CO2浓度(μmol/mol)。
1.3.2 叶绿素荧光参数测定
叶绿素荧光参数观测与光响应曲线测定同步进行。应用脉冲调制式荧光系统(FMS2.02型,英国Hansatech公司)测定不同土壤水分梯度下沙棘叶片叶绿素荧光动力学参数。在自然光下活化40min,测定光合有效辐射强度(PAR)为1000μmol·m-2·s-1下的叶片实际荧光产量(Fs),随后加一个强闪光(5000 μmol·m-2·s-1,脉冲时间0.7s),测定光下最大荧光(Fm'),同时将叶片遮光,关闭作用光5s后暗适应3s,再打开远红光5s后测定光下最小荧光(Fo')。叶片暗适应30min后测定初始荧光(Fo),随后加一个强闪光(5000 μmol·m-2·s-1,脉冲时间0.7s),测定最大荧光(Fm),其中Fo和Fm为凌晨天亮前的测定值。按Rohacek[23]公式计算PSⅡ的最大光化学效率Fv/Fm=(Fm-Fo)/Fm;PSⅡ的实际光化学效率ΦPSⅡ=(Fm'-Fs)/Fm';光化学猝灭系数qP=(Fm'-Fs)/(Fm'-Fo');非光化学猝灭系数NPQ=(Fm-Fm')/Fm'。
1.3.3 抗氧化酶活性和丙二醛含量测定
采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性[24],以抑制NBT光化学还原的50%为一个酶活性单位(U);采用愈创木酚显色法测定过氧化物酶(POD)活性[25],以每分钟内470nm下的光密度(D470nm)变化0.10为一个酶活性单位(U);采用紫外吸收法测定过氧化氢酶(CAT)活性[25],以1min内A240降低0.1为一个酶活性单位(U);丙二醛(MDA)含量的测定采用双组分光光度法[26]。
1.4 数据处理
采用Excel2003计算试验数据并作图,不同处理间的数据(结果)差异显著性等分析采用单因素方差分析(One-way AVOVO)和 Duncan多重比较(SPSS18.0)。
2 结果与分析
2.1 不同土壤水分下沙棘叶片气体交换参数的光响应
在各种土壤水分条件下,沙棘叶片光合速率(Pn)随着光合有效辐射强度(PAR)的增大在达到光饱和点(LSP)前表现出类似的规律(图1),即先直线式快速升高然后曲线式缓慢升高。此后,在土壤相对含水量(RWC)为38.9%—82.9%的范围内,Pn稳定在较高水平且随PAR增大的变化不大,即同一土壤水分下LSP对应的Pn与PAR为1800μmol·m-2·s-1(试验最大光强)时的Pn没有显著差异(P>0.05);但超出此RWC范围时,Pn则表现出随PAR增大而明显下降的趋势,即同一土壤水分下LSP对应的Pn与PAR为1800μmol·m-2·s-1时的Pn差异显著(P<0.05)。说明过高或过低的土壤水分均会引起沙棘叶片在高光强下光合作用水平的下降。沙棘叶片蒸腾速率(Tr)和水分利用效率(WUE)随着PAR的增大表现出和Pn类似的响应规律。另外,Pn、Tr和WUE对RWC都表现出明显的阈值响应(图1),即在一定的RWC范围内,Pn、Tr以及WUE随着RWC的增加逐渐增大,达到最大值后又随RWC的继续增加而减小。Pn达到最大时对应的RWC为70.5%;Tr最大时对应的RWC大于Pn对应的值,为82.9%;WUE最大时对应的RWC则小于Pn对应的值,为58.6%。维持沙棘叶片 Pn处于较高水平的 RWC范围为58.6%—82.9%,维持 WUE处于较高水平的 RWC范围为48.3%—70.5%。
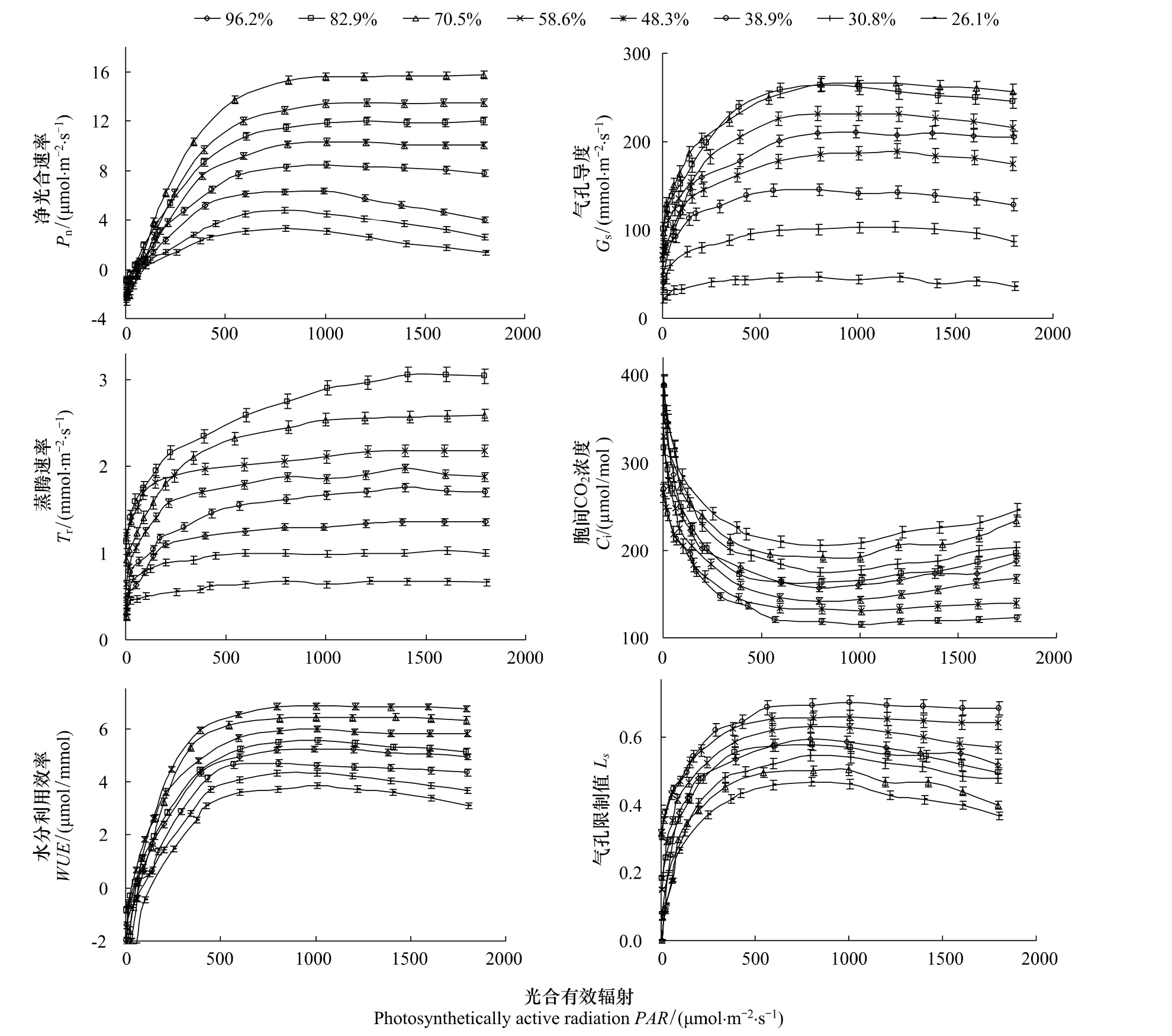
图1 土壤水分胁迫下沙棘叶片光合光响应曲线Fig.1 Light response curves of net photosynthetic rate(Pn),transpiration rate(Tr),water use efficiency(WUE),stomatal conductance(Gs),intercellular CO2concentration(Ci),and stomatal limitation values(Ls)of Hippophae rhamnoides Linn.under soil drought stress
沙棘叶片气孔导度(Gs)对PAR的响应变化趋势与Pn基本一致,但在RWC<38.9%严重的干旱胁迫时,Gs随光强增大的变化不明显,说明植物气孔基本上失去了调节作用,导致出现对光强变化的响应不敏感。沙棘光合作用的胞间CO2浓度(Ci)和气孔限制值(Ls)的光响应变化趋势相反。同一光强下,Gs随着RWC的增加而逐渐增大,当RWC>82.9%时开始出现明显的下降。RWC在38.9%—70.5%的范围内,随着RWC的降低,Ci明显下降但Ls明显上升;当RWC<38.9%时,随着RWC的降低,Ls明显下降而Ci显著上升(图1)。这表明随着土壤干旱的加剧,沙棘叶片Pn下降的主要原因发生了由气孔因素向非气孔因素的转变[27],发生转变的土壤水分临界值大约在RWC为38.9%。
2.2 水分胁迫对沙棘叶片叶绿素荧光参数的影响
初始荧光(Fo)是PSⅡ反应中心全部开放时的荧光水平,PSⅡ天线的热耗散增加常导致Fo的降低,而PSⅡ反应中心的破坏或可逆失活则引起Fo的增加。因此可根据Fo的变化推测反应中心的状况和可能的光保护机制[28]。最大荧光(Fm)是PSⅡ反应中心处于完全关闭时的荧光产量,可反映通过PSⅡ的电子传递情况[29],同时强光下Fm降低也是光抑制的一个特征。PSⅡ的最大光化学效率(Fv/Fm)的大小反映了PSⅡ反应中心内原初光能的转换效率,是反映光抑制程度的良好指标[30]。研究发现(图2),随着土壤含水量的降低,Fm、Fv/Fm以及ΦPSⅡ均呈现出下降的趋势,而Fo则呈现上升的趋势。方差分析结果显示,当RWC>38.9%时,各水分梯度下Fo没有显著差异(P>0.05),超出此范围则出现大幅度的升高,表明PSⅡ反应中心发生了破坏或可逆失活。RWC 70.5%时,Fv/Fm和ΦPSⅡ最大,随着土壤含水量的降低,ΦPSⅡ从RWC 58.6%开始出现明显下降,而Fv/Fm和Fm从RWC 48.3%开始出现明显下降,ΦPSⅡ的下降幅度要大于Fv/Fm的下降幅度,表明此时光抑制现象已经产生。当RWC<38.9%时,各土壤水分梯度下的Fv/Fm、ΦPSⅡ以及Fm较RWC 70.5%均出现明显下降,都维持在较低的水平且差异不显著,由此推测,此时沙棘叶片已发生光氧化破坏,P SⅡ反应中心的光合电子传递活性受到抑制。
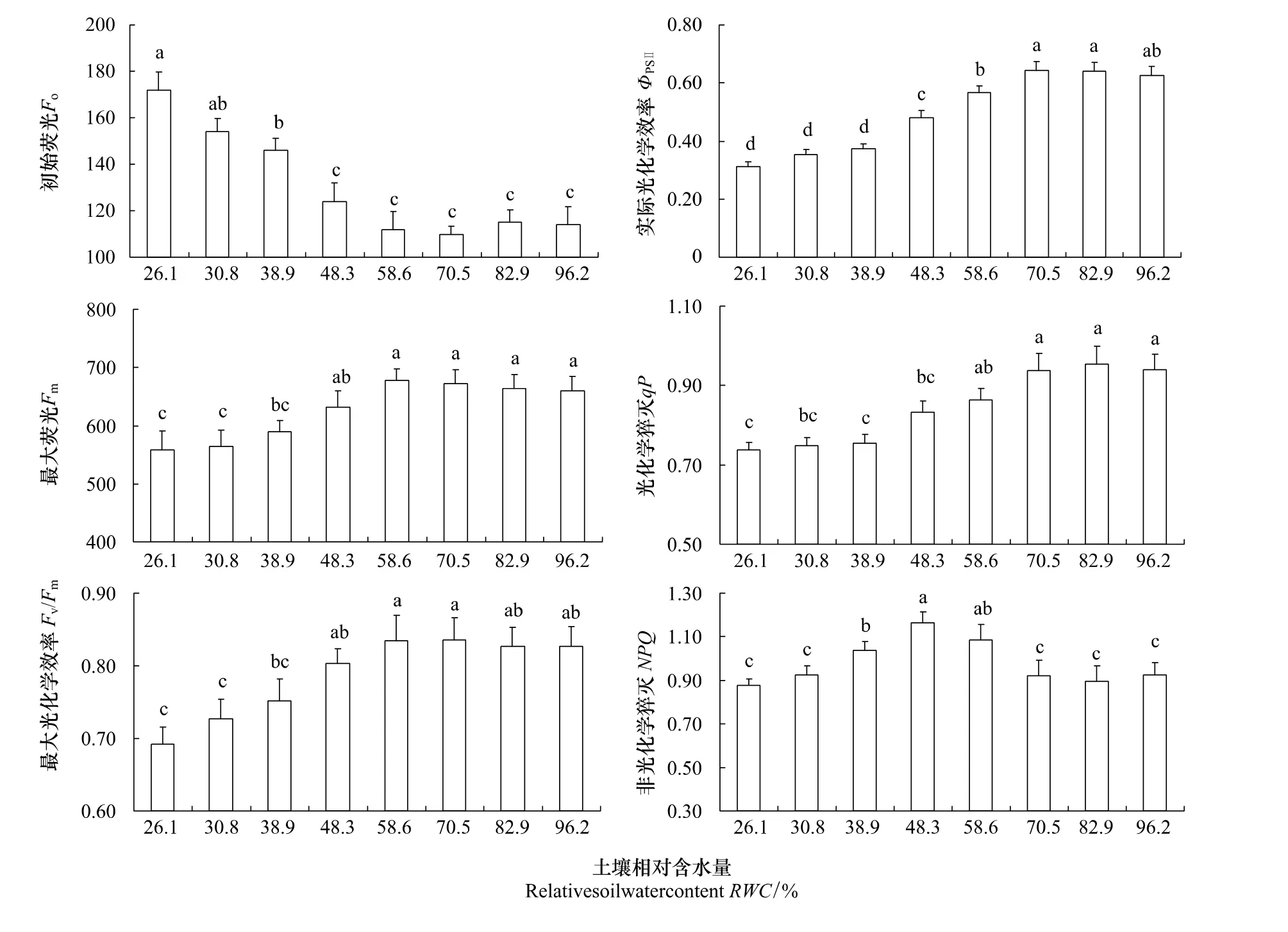
图2 水分胁迫下沙棘叶片叶绿素荧光参数的变化Fig.2 Changes of minimal fluorescence(Fo),maximal fluorescence(Fm),maximal photochemical efficiency(Fv/Fm),actual photochemical efficiency(ΦPSⅡ),photochemical quenching(qP)and non photochemical quenching(NPQ)of Hippophae rhamnoides Linn.under soil drought stress
光化学淬灭(qP)反映的是PSⅡ天线色素吸收的光能用于光化学电子传递的份额,一定程度上反映了PSⅡ反应中心的开放程度,其值越大,说明PSII的电子传递活性越高[31]。非光化学淬灭(NPQ)是PSⅡ天线色素吸收的以热的形式耗散掉的部分[32],是对光合机构的一种自我保护机制,表征PSII反应中心对天线色素吸收过量光能后的热耗散能力及光合机构的损伤程度。研究发现(图2),随着RWC的逐渐降低,qP表现出下降的趋势,而NPQ则表现出先上升后下降的趋势。RWC 70.5%时qP最大,随着RWC的逐渐降低qP开始逐渐下降,RWC 48.3%时出现明显的降低,方差分析差异显著(P<0.05);RWC<48.3%时,各土壤水分点下qP维持在较低水平且变化不大,表明土壤水分对沙棘PSⅡ反应中心的电子传递活性有较大的影响,严重的干旱胁迫导致qP的显著降低,PSII的电子传递活性下降。随着RWC的逐渐降低,NPQ在干旱胁迫初期开始上升,在RWC 48.3%时达到最大值,表明适度的水分胁迫可增加沙棘叶片PSⅡ天线色素的热耗散,在一定程度上缓解水分胁迫对光合作用的影响,RWC<48.3%时NPQ又开始下降,与RWC 48.3%相比,RWC<38.9%的水分条件下NPQ显著下降,表明此时PSⅡ受到破坏,热耗散能力下降。
2.3 水分胁迫对沙棘叶片抗氧化酶活性和丙二醛的影响
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等抗氧化酶类,是植物活性氧清除系统中重要的酶,能维持活性氧自由基产生与清除系统的平衡,丙二醛(MDA)是脂质过氧化作用的主要产物之一,其含量的高低在一定程度上反映脂膜过氧化作用水平和膜结构的受害程度。研究结果(图3)表明,RWC在70.5%到96.2%的范围内,各土壤水分梯度下的SOD、POD、CAT活性以及MDA含量均没有显著差异(P>0.05);随着土壤含水量的降低,SOD、POD和CAT活性均表现出先升高后降低的趋势,且都在RWC 48.3%时达到最大值,与RWC 70.5%时相比分别增加了38.9%、25.7%和19.3%。表明在土壤干旱相对较轻(48.3%<RWC<70.5%)时,沙棘叶片的SOD、POD和CAT活性升高,起到保护光合作用机构免受或减轻干旱伤害的作用;但干旱加剧到严重胁迫(RWC<38.9%)时,SOD、POD和CAT的活性发生明显的降低,即沙棘叶片抗氧化系统活力开始下降。3种抗氧化酶(SOD、POD和CAT)相比,干旱胁迫使SOD的活性提高幅度较大,其次是POD和CAT,表明SOD对干旱胁迫反应更敏感,是沙棘适应干旱胁迫的主要抗氧化酶。随着土壤水分含量的降低,MDA呈现出逐级递增的趋势;在RWC 26.1%时出现最大值(是RWC 70.5%时的2倍),表明此时沙棘叶片抗氧化系统活性下降,活性氧的产生超出了细胞的清除能力,导致活性氧大量积累,活性氧引起光合色素严重降解和膜脂过氧化,破坏了光合机构膜系统。
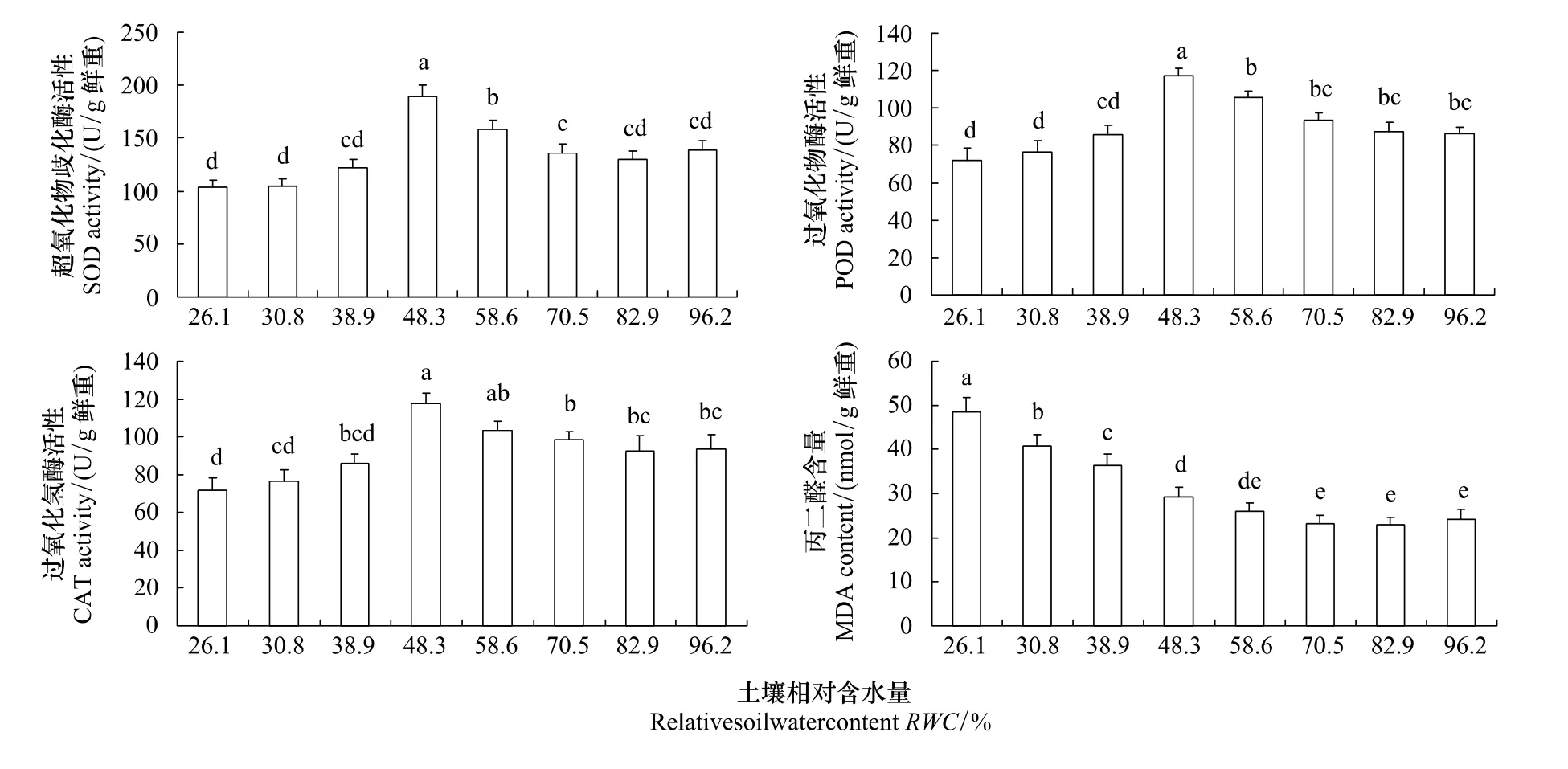
图3 水分胁迫下沙棘叶片抗氧化酶活性和丙二醛含量的变化Fig.3 Changes of superoxide dismutase(SOD),peroxidase(POD),catalase(CAT)activities and malondialdehyde(MDA)contents of Hippophae rhamnoides Linn.under soil drought stress
3 讨论
水分胁迫下植物光合作用的变化一直是人们研究的重点。通常影响植物光合作用的因素可分为气孔因素和非气孔因素,前者指水分胁迫导致气孔导度下降,CO2进入叶片受阻而使光合下降,后者指叶肉细胞的光合活性下降。Farquhar和Sharkey[33]认为,引起光合速率降低的气孔和非气孔限制因素可以根据叶片胞间CO2浓度(Ci)和气孔限制值(Ls)的变化方向来判断,其中Ci是关键因子。只有光合速率下降伴随着Ci降低和Ls升高时,才可以认为光合速率(Pn)的下降主要是受气孔限制所致;反之,如果Pn下降的同时Ci升高或者不变,同时Ls降低,则光合作用的主要限制因素是非气孔因素,即叶肉细胞光合活性的下降。本研究发现(图1),土壤相对含水量(RWC)在38.9%—70.5%的范围内,随着土壤水分减少Pn降低,同时Ci明显下降和Ls显著上升,说明此时沙棘叶片光合作用水平降低主要是由气孔限制因素造成的;当RWC<38.9%时,干旱胁迫继续加剧,沙棘的Pn和Ls都降低,而Ci却显著上升,说明Pn下降的主要原因已经由气孔因素转变为非气孔因素,沙棘叶片光合机构受到伤害。由此认为,RWC 38.9%为沙棘叶片光合作用气孔与非气孔因素限制的转折点,也是半干旱黄土丘陵区沙棘生长所允许的土壤水分最大亏缺程度。
在水分胁迫环境下,植物可以通过合理协调碳同化和水分消耗之间的关系,从而调节叶片水分利用效率(WUE)的变化,是植物抗旱策略的重要组成部分[34]。本研究发现(图1),沙棘叶片净光合速率(Pn)、蒸腾速率(Tr)和水分利用效率(WUE)对土壤水分都表现出明显的阈值响应,WUE达到最大值时对应的RWC(58.6%)要小于Pn达到最大值时对应的RWC(70.5%),也就是说,RWC 70.5%是Pn的最适土壤含水量,当RWC在58.6%左右时,气孔部分关闭,Pn、Tr都开始下降,但Tr下降幅度要大于Pn的下降速率,从而导致WUE增加,即适度水分胁迫能够提高沙棘叶片的WUE。对冬小麦[35]、山杏[36]、辽东楤木[37]等较多植物的研究也有类似的规律。当RWC<58.6%时,Pn和WUE都开始随RWC的降低而下降。维持沙棘叶片Pn处于较高水平的RWC范围为58.6%—82.9%,维持WUE处于较高水平的RWC范围为48.3%—70.5%。由此认为,在半干旱黄土丘陵区,沙棘生长适宜的土壤水分阈值范围在RWC为58.6%—70.5%,此土壤水分阈值能保证沙棘叶片同时获得较大的光合作用水平和水分利用效率,符合干旱缺水地区植物生长和生产以高效用水为核心的栽培管理原则[7,38]。有相关研究称之为 WUE与 Pn协调的“高效水阈值”[38]或“经济水阈值”[7]。
叶绿素荧光参数在测定植物光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用,与反映光合作用“表观性”的光合气体交换参数相比更具有反映光合作用“内在性”的特点。目前,叶绿素荧光作为快速、灵敏和无损伤地研究光合作用机理的探针,已被较多的研究应用于探测干旱等逆境胁迫对农作物光合作用的影响过程与机理[39-40],但针对沙棘等生态经济树种的相关研究还相对较少。本研究中(图2),在土壤干旱相对较轻(48.3% <RWC<70.5%)时,随着土壤含水量的降低,PSⅡ最大光化学效率(Fv/Fm),PSⅡ实际光化学效率(ΦPSⅡ),光化学猝灭(qP)均表现出逐渐降低的趋势,但初始荧光(Fo)并未发生显著的变化,非光化学猝灭(NPQ)则逐渐升高。表明此时沙棘光合作用的光破坏防御机制有效启动,天线色素捕获的光能向PSⅡ反应中心传递的效率下降,同时热耗散能力增加,减少了反应中心过剩光能的积累,保护光合机构免受破坏。但在土壤干旱到严重胁迫(RWC<38.9%)时,Fo显著升高,NPQ开始下降,Fv/Fm和ΦPSⅡ(即CO2同化的能量表征[41])都大幅降低,表明此时沙棘叶片PSⅡ系统受到一定程度的损伤,热耗散功能受到抑制,由此推测PSⅡ光系统损伤是Pn下降的非气孔限制的原因之一。在沙棘叶绿素荧光参数与土壤水分的定量关系方面,当RWC 70.5%时,沙棘叶片Fm、Fv/Fm、ΦPSⅡ、qP都达到最大值,表明RWC为70.5%时最有利于沙棘光合作用光反应过程的进行,这与沙棘Pn在RWC为70.5%时达到最大值的结果一致(图1);当RWC<38.9%时,沙棘的PSⅡ受到破坏,反应中心的光合电子传递活性受到抑制,这与沙棘光合作用发生非气孔限制的RWC临界值为38.9%的结果一致(图1)。
植物抗氧化酶系统活性的变化及膜脂过氧化作用已经广泛用于植物对逆境反应机理的研究。在干旱逆境下,植物碳同化过程减弱以及PSⅡ的活性降低,导致激发能上升而引发能量过剩,植物体内活性氧的产生与清除间的平衡被打破,自由基在体内大量积累,造成膜脂过氧化作用加剧,引起膜脂过氧化物产物(MDA)增加,从而降低植物叶片的光合能力[42]。近年来有研究发现,干旱胁迫引起烟草、玉米等植物体内活性氧自由基代谢失调而引发的生物膜结构与功能的破坏,是光合作用非气孔限制的主要原因[43,15]。本研究结果表明(图3),在土壤干旱相对较轻(48.3% <RWC<70.5%)时,沙棘叶片的抗氧化酶系统启动,SOD、POD和CAT等抗氧化酶活性显著升高,自由基清除能力增强,从而起到保护光合作用机构的作用;由此结合沙棘叶片荧光参数对土壤水分变化的响应关系(图2),可以认为此时PSⅡ光能转化和活性氧代谢协同发挥作用,共同稳定了光合作用机构的功能。但当土壤干旱到严重胁迫(RWC<38.9%)时,沙棘光合作用的抗氧化酶活性发生了明显下降,MDA急剧升高;表明此时沙棘叶片的抗氧化酶系统受到损伤,活性氧的产生超出了系统的清除能力导致其大量积累而引起生物膜结构和功能的破坏。由此认为,当土壤发生严重水分胁迫时,沙棘叶片抗氧化酶系统损伤和PSⅡ系统的损伤一样,也是沙棘光合作用发生非气孔限制的重要原因。干旱胁迫影响玉米(郑单958)苗期光合作用的研究[15]也得出了类似的结果。
4 结论
(1)当土壤干旱程度在RWC为48.3%—70.5%时,沙棘光合作用降低的主要原因是气孔因素的限制,即叶片气孔开度减小导致的CO2供应受阻;此时,沙棘叶片主要通过减少光捕获、热耗散和酶活性调节的协同作用,稳定光合作用机构的功能,适应和抵御土壤干旱环境。
(2)当土壤水分在RWC为58.6%—70.5%范围,沙棘叶片可以通过气孔导度调节,较好地协调碳同化和蒸腾耗水之间的关系,保持较高的光合速率和水分利用效率。即在半干旱黄土丘陵区,维持沙棘同时具有较高光合速率和水分利用效率的土壤水分阈值在RWC为58.6%—70.5%。
(3)当土壤发生严重水分胁迫(RWC<38.9%)时,沙棘光合作用的主要限制因素由气孔限制转变为非气孔限制,表现为PSⅡ系统和抗氧化酶系统受到损伤。即在半干旱黄土丘陵区,沙棘生长所允许的土壤水分最大亏缺程度在RWC为38.9%左右。
[1] Pan R C.Plant Physiology.5th ed.Beijing:Higher Education Press,2004:56-57.
[2] Xu D Q.Photosynthetic Efficiency.Shanghai:Shanghai Science and Technology Press,2002:163-167.
[3] Li J Y,Blake T J.Effects of repeated cycles of dehydration-rehydration on gas exchange and water use efficiency of seedlings.Journal of Beijing Forestry University,1999,21(3):1-8.
[4] Lawson T,Oxborough K,Morison J L,Baker N R.The responses of guard and mesophyll cell photosynthesis to CO2,O2,light,and water stress in a range of species are similar.Journal of Experimental Botany,2003,54(388):1743-1752.
[5] Teskey R O,Fites J A,Samuelson L J,Bongarten B C.Stomatal limitations to net photosynthesis in Pinus taeda L.under different environmental conditions.Tree Physiology,1986,2(1/2/3):131-142.
[6] Liu M Y,Chen P Y.Effects of stomatal and nonstomatal factors on wheat photosynthesis under water stress.Plant Physiology Communications,1990,(4):24-27.
[7] Zhang S Y,Zhang G C,Gu S Y,Xia J B,Zhao J K.Critical responses of photosynthetic efficiency of goldspur apple tree to soil water variation in semiarid loess hilly area.Photosynthetica,2010,48(4):589-595.
[8] Lu C M,Zhang Q D,Kuang T Y.The mechanism for the inhibition of photosynthesis in rice by water stress.Acta Agronomica Sinica,1994,20(5):601-606.
[9] Flexas J,Medrano H.Drought-inhibition of photosynthesis in C3plants:stomatal and non-stomatal limitations revisited.Annals of Botany,2002,89(2):183-189.
[10] Wu F Z,Bao W K,Li F L,Wu N.Effects of water stress and nitrogen supply on leaf gas exchange and fluorescence parameters of Sophora davidii seedlings.Photosynthetica,2008,46(1):40-48.
[11] Liu J C,Zhong Z C,He Y J.Influence of drought stress on the gas exchange of Cupressus funebris endl seedlings of different ages in the limestone area of chongqing china.Acta Ecologica Sinica,2007,27(9):3601-3608.
[12] Cui X Y,Song J F,Zhang Y H.Some photosynthetic characteristics of Fraxinus mandshurica seedlings grown under different soil water potentials.Acta Phytoecologica Sinica,2004,28(6):794-802.
[13] Fu S L,Zhou Y B,He X Y,Chen W.Effects of drought stress on photosynthesis physiology of populus pseudo-simonii.Chinese Journal of Applied Ecology,2006,17(11):2016-2019.
[14] Sun J K,Zhang W H,Lu Z H,Liu X C.Effects of drought stress on gas exchange characteristics and protective enzyme activities in Elaeagnus angustifolia and Grewia.bilobag.don var.Parviflora seedlings.Acta Ecologica Sinica,2009,29(3):1330-1340.
[15] Zhang R H,Zheng Y J,Ma G S,Zhang X H,Lu H D,Shi J T,Xue J Q.Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seeding.Acta Ecologica Sinica,2011,31(5):1303-1311.
[16] Ruan C J,Li D Q.Study on several hydrological and ecological characteristics of Hippophae rhamnoides in the loess hilly region.Forest Research,2002,15(1):47-53.
[17] Gao L,Yang J,Liu R X.Effects of soil moisture levels on photosynthesis,transpiration,and moisture use efficiency of female and male plants of Hippophae rhamnoides ssp.sinensis.Acta Ecologica Sinica,2009,29(11):6025-6034.
[18] Cai H X,Wu F Z,Yang W Q.Effects of drought stress on the photosynthesis of Salix paraqplesia and Hippophae rhamnoides seedings.Acta Ecologica Sinica,2011,31(9):2430-2436.
[19] Ruan C J,Xie Q L.Effect of soil moisture on survival rate of hippophae rhamnoides L.and its stress-resistance physiological characteristics.Chinese Journal of Applied and Environmental Biology,2002,8(4):341-345.
[20] Han R L,Li L X,Liang Z S.Seabuckthorn relative membrane conductivity and osmotic adjustment under drought stress.Acta Botanica Boreali-Occidentalia Sinica,2003,23(1):23-27.
[21] Nijs I,Ferris R,Blum H,Hendrey G,Impens I.Stomatal regulation in a changing climate:a field study using free air temperature increase(FATI)and free air CO2enrichment(FACE).Plant Cell Environment,1997,20(8):1041-1050.
[22] Berry J A,Downton W J S.Environmental regulation of photosynthesis.In Govindjee ed.Photosynthesis,Vol.Ⅱ.New York:Academic Press,1982:263-342.
[23] Rohacek K.Chlorophyll fluorescence parameters:the definitions,photosynthetic meaning and mutual relationships.Photosynthetica,2002,40(1):13-29.
[24] Zheng B S.Modern plant physiological and biochemical research techniques.Beijing:Meteorological Press,2006:91-92.
[25] Sun Q,Hu J J.Plant physiological research techniques.Yangling:Northwest Agriculture and Forestry University Press,2005:167-170.
[26] Hao J J,Kang Z L,Yu Y.Plant physiology experiments.Beijing:Chemical Industry Press,2006:159-160.
[27] Xu D Q.Some problems in stomatal limitation analysis of photosynthesis.Plant Physiology Communications,1997,33(4):241-244.
[28] Krause G H.Photoinhibition of photosynthesis:an evaluation of damaging and protective mechanisms.Physiologia Plantarum,1988,74:566-574.
[29] Zhang S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance.Chinese Bulletin of Botany,1999,16(4):444-448.
[30] Xu D Q,Zhang Y Z,Zhang R X.Photoinhibition of photosynthesis in plants.Plant Physiology Communications,1992,28(4):237-243.
[31] Guo C F,Sun Y,Tang Y H,Zhang M Q.Effect of water stress on chlorophyll fluorescence in leaves of tea plant(Camellia sinensis).Chinese Journal of Eco-Agriculture,2009,17(3):560-564.
[32] Gilmore A M,Yamamoto H Y.Zeaxanthin formation and energy dependent fluorescence quenching in pea chloroplasts under artificially mediated linear and cyclic electron transport.Plant Physiol,1991,96(2):635-643.
[33] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annu Rev Plant Physiol,1982,33:317-345.
[34] Steduto P,Katerji N,Puertos-Molina H,Unlu M,Mastrorilli M,Rana G.Water-use efficiency of sweet sorghum under water stress conditions:Gas-exchange investigations at leaf and canopy scales.Field Crops Research,1997,54(2/3):221-234.
[35] Heitholt J J.Water use efficiency and dry matter distribution in nitrogen-and water-stressed winter wheat.Agronomy Journal,1989,81(3):464-469.
[36] Xia J B,Zhang G C,Sun J K,Liu X.Threshold effects of photosynthetic and physiological parameters in Prunus sibirica to soil moisture and light intensity.Journal of Plant Ecology,2011,35(3):322-329.
[37] Chen J,Zhang G C,Zhang S Y,Wang M J.Response processes of Araiia elata photosynthesis and transpiration to light and soil moisture.Journal of Applied Ecology,2008,19(6):1185-1190.
[38] Zhang G C,Xia J B,Shao H B,Zhang S J.Grading woodland soil water productivity and soil bioavailability in the semi-arid loess plateau of china.Clean-Soil,Air,Water,2012,40(2):148-153.
[39] Massacci A,Nabiev S M,Pietrosanti L,Nematov S K,Chernikova T N,Thor K,Leipner J.Response of photosynthesis apparatus of cotton to the onset of drought stress under field conditions by gas change analysis and chlorophyll fluorescence imaging.Plant Physiology and Biochemistry,2008,46(2):189-195.
[40] Efeoglu B,Ekmekci Y,Cicek N.Physiological responses of three maize cultivars to drought stress and recovery.South Afican Journal of Botany,2009,75(1):34-42.
[41] Sinsawat V,Leipner J,Stamp P,Fracheboud Y.Effect of heat stress on the photosynthetic apparatus in maize(Zea mays L.)grown at control or high temperature.Environmental and Experimental Botany,2004,52(2):123-129.
[42] Sohrabi Y,Heidari G,Weisany W,Golezani K G,Mohammadi K.Changes of antioxidative enzymes,lipid peroxidation and chlorophyll content in chickpea types colonized by different Glomus species under drought stress.Symbiosis,2012,56(1):5-18.
[43] Li G Y,Li Z W,Zhen H J.Research advance on physiological and biochemical responses in tobacco under water stress.Chinese Agricultural Science Bulletin,2007,23(9):298-301.
参考文献:
[1] 潘瑞炽.植物生理学.5版.北京:高等教育出版社,2004:56-57.
[2] 许大全.光合作用效率.上海:上海科学技术出版社,2002:163-167.
[3] 李吉跃,Terence J.Blake.多重复干旱循环对苗木气体交换和水分利用效率的影响.北京林业大学学报,1999,21(3):1-8.
[6] 刘孟雨,陈培元.水分胁迫条件下气孔与非气孔因素对小麦光合的限制.植物生理学通讯,1990,(4):24-27.
[8] 卢从明,张其德,匡廷云.水分胁迫抑制水稻光合作用的机理.作物学报,1994,20(5):601-606.
[11] 刘锦春,钟章成,何跃军.水分胁迫对重庆石灰岩地区不同龄级柏木幼苗气体交换的影响.生态学报,2007,27(9):3601-3608.
[12] 崔晓阳,宋金凤,张艳华.不同土壤水势条件下水曲柳幼苗的光合作用特征.植物生态学报,2004,28(6):794-802.
[13] 付士磊,周永斌,何兴元,陈玮.干旱胁迫对杨树光合生理指标的影响.应用生态学报,2006,17(11):2016-2019.
[14] 孙景宽,张文辉,陆兆华,刘新成.沙枣和孩儿拳头幼苗气体交换特征与保护酶对干旱胁迫的响应.生态学报,2009,29(3):1330-1340.
[15] 张仁和,郑友军,马国胜,张兴华,路海东,史俊通,薛吉全.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响.生态学报,2011,31(5):1303-1311.
[16] 阮成江,李代琼.黄土丘陵区沙棘林几个水分生理生态特征研究.林业科学研究,2002,15(1):47-53.
[17] 高丽,杨劼,刘瑞香.不同土壤水分条件下中国沙棘雌雄株光合作用、蒸腾作用及水分利用效率特征.生态学报,2009,29(11):6025-6034.
[18] 蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响.生态学报,2011,31(9):2430-2436.
[19] 阮成江,谢庆良.土壤水分对沙棘成活率及抗逆生理特性的影响.应用与环境生物学报,2002,8(4):341-345.
[20] 韩蕊莲,李丽霞,梁宗锁.干旱胁迫下沙棘叶片细胞膜透性与渗透调节物质研究.西北植物学报,2003,23(1):23-27.
[24] 郑炳松.现代植物生理生化研究技术.北京:气象出版社,2006:91-92.
[25] 孙群,胡景江.植物生理学研究技术.杨凌:西北农林科技大学出版社,2005:167-170.
[26] 郝建军,康宗利,于洋.植物生理学实验技术.北京:化学工业出版社,2006:159-160.
[27] 许大全.光合作用气孔限制分析中的一些问题.植物生理学通讯,1997,33(4):241-244.
[29] 张守仁.叶绿素荧光动力学参数的意义及讨论.植物学通报,1999,16(4):444-448.
[30] 许大全,张玉忠,张荣铣.植物光合作用的光抑制.植物生理学通讯,1992,28(4):237-243.
[31] 郭春芳,孙云,唐玉海,张木清.水分胁迫对茶树叶片叶绿素荧光特性的影响.中国生态农业学报,2009,17(3):560-564.
[36] 夏江宝,张光灿,孙景宽,刘霞.山杏叶片光合生理参数对土壤水分和光照强度的阈值效应.植物生态学报,2011,35(3):322-329.
[37] 陈建,张光灿,张淑勇,王梦军.辽东楤木光合和蒸腾作用对光照和土壤水分的影响过程.应用生态学报,2008,19(6):1185-1190.
[43] 李国芸,李志伟,甄焕菊.水分胁迫条件下烟草生理生化响应研究进展.中国农学通报,2007,23(9):298-301.
