潮虫消耗木本植物凋落物的可选择性试验
2013-09-11廖允成
刘 燕,廖允成
(1.西北农林科技大学,杨凌 712100;2.伯尔尼大学,生态与进化学院,瑞士伯尔尼 3012)
当前,生物入侵领域的中心议题之一是原有生态系统群落构成的变化如何通过系统功能的改变来影响生物入侵进程[1]。其中,以外来植物对入侵地土壤生态循环系统过程的影响效应及反馈机制最受关注[2-6]。外来植物入侵能够引起物种之间竞争的改变,当中的一个必然环节是原有植被结构被修改,凋落物数量和质量随之改变,而那些依赖于枯枝落叶生存的腐生生物分解习惯亦可能由此而被修改[7-10]。植物凋落物的消耗分解是调节碳、氮以及其他营养物质循环的关键生态过程,而土壤无脊椎动物在有机物的分解以及营养元素的释放等方面都有着不容忽视的重要作用[11-13]。土壤动物对植物凋落物取食偏好的研究由来已久,早在1992年就有研究指出腐食性无脊椎动物(如千足虫、潮虫、双翅目幼虫等)对落叶总量的年摄取量不少于20%,有时甚至高达100%[14]。随后大量比较研究发现土壤无脊椎动物对植物落叶的取食偏好可能与特定的凋落物性状相关联,如叶的韧性、碳氮比值、微生物预处理过程以及所含的次生化合物种类、数量等都会从某种程度上决定落叶的适口性[15-16]。
从群落层面上来看,分解率则特别取决于植物种类或其在群落组成中的功能类型[17-18]。近20a来,不断有研究基于群落水平进行外来种与本地种的落叶分解率比较,但结论却不尽一致。当外来植物种具有较高生长率、较高生物量、较大叶面积、含有较高营养成分、抑或是固氮植物,它们相对本地种则具有较高分解率并会促进土壤养分循环[19-20];而当异地种的凋落物中木质素含量、碳氮比值、次生化合物含量较高时,本地种的分解率大于外来种[21-23]。同时,也有部分研究显示出落叶消耗、分解与物种入侵性并无必然因果关联[24-25]。因此,植物被消耗率是否与其入侵状态相关仍是一个公开讨论的话题,而融入不同入侵程度的外来种与本地种的多重比较更具科学意义。本试验选取了10个常见本地木本植物、5个非入侵性外来种和5个入侵性外来种利用等足目潮虫进行模拟的实验室选择性喂养试验,试图通过世界范围内广泛存在的腐食性无脊椎分解动物潮虫的取食偏好求证分解率与入侵性之间是否存在必然的相互关系。
1 材料与方法
1.1 研究区域概况
研究工作在位于瑞士中部以西的首府地区伯尔尼展开。瑞士是欧洲大陆中南部的多山内陆国,南北长220.1 km,东西长348.4 km。平均海拔约1350 m,年均气温为8.6℃,年降雨量为1500 mm。伯尔尼(46°57'08.66″N 7°26'22.50″E)则位于瑞士西部高原中央山地,坐落在莱茵河支流阿勒河一个天然弯曲处,平均海拔550 m。气候温暖湿润,冬暖夏凉,年均高温12.9℃,低温4.2℃,年均降水1028 mm,面积51.62 km2。瑞士森林资源丰富,植物繁多,被称为世界上最绿色的国家[26]。然而,即使在这样一个物种相对丰富、较不易被外来生物干扰的相对稳定生境下,仍有800个建种外来种和107个入侵外来种在瑞士联邦总局(FEON)2006年出版的《瑞士的入侵外来物种》[27]文献中被认定,而在107个入侵外来种中就有47个是植物种。生物入侵带来的生物多样性威胁以及经济、人文损耗同样引起了当地学者的高度重视。
1.2 试验选材
20个在当地较为常见的木本植物被随机抽选,其中包括10个本地种和10个外来种。而10个外来种中,显示出明确传播行为并对当地生态系统产生负面影响的5个植物种被归类为入侵性外来种,相应另外5个物种则为非入侵性外来种(表1)。为了克服分类上的主观性,所有被选种的归类严格根据《瑞士植物志》、《世界入侵种》、《欧洲外来种手册》、《瑞士外来入侵物种》中的分类信息,以及由瑞士野生植物保护协会和瑞士植物栽培保护协会在2007年联合公布的“入侵植物种黑名单”进行反复筛选。2009年10月,在伯尔尼植物园和野外人工手动收集各个植物种的新鲜落叶,要求其满足刚刚自然掉落、未被草食动物破坏以及无分解痕迹的被选条件,每个种共收集约100 g,随后在50℃烘箱被独立干燥,并按种分袋放置在实验室干燥环境下备用。

表1 20个木本植物种名称及其分类Table1 Species name of 20 woody plants and their classification
为了测试本地分解者对本地种、非入侵性外来种和入侵性外来种的消耗差异,本试验选用等足目潮虫(Porcellio scaber)作为喂养试验受体。潮虫为林下主要腐生型土壤节肢动物之一,生活在潮湿、温暖以及有遮蔽的场所,昼伏夜出,具负趋光性。他们通常以取食植物体死的有机物质为生,并被国外学者深入研究证实其为示范型的初级分解者[28-30]。其中尤其以Zimmer等人反复选用潮虫进行选择性喂养试验来测定凋落物消耗率的模拟试验最具代表性。伯尔尼森林达17.33 km2,占总面积的三分之一。鉴于潮虫在自然生态系统中的易捕性和易操作性,300多头潮虫成年个体于2009年10月期间在伯尔尼大学附近的堆肥坑被手工收集,并以30头/盒的密度存放于若干16 cm×11 cm×5 cm大小的塑料盒中,随后将其保存在一个平均温度12℃的气候培养室中直至被试验使用。培养盒透明,底部有1 cm高的石膏层,可以保持足够的湿度,中间以湿润的菜园土和堆肥处凋落物覆盖,顶部以同样透明但不完全封闭的塑料盖遮掩,既防止潮虫流失,又保证足够的空气流通。
1.3 试验方法
测试潮虫对不同入侵性质木本植物的落叶是否具有取食偏好,本研究采用实验室可选择性喂养试验。试验选用玻璃瓶为培养器皿,其底部有一层2 cm高的石膏层,石膏层内部均匀分布7个钻孔(10 mm深,20 mm宽),每个钻孔可分别放置一片属于不同植物的直径大约为10 mm的落叶。这个器皿的优势在于可防止潮虫的拖拽行为,不会因此混合不同植物落叶而影响最终生物量的准确测定。选取单个成年潮虫喂养在含有7种不同落叶随机搭配组合作为其食物来源的玻璃瓶中,经过15 d自由取食,最终以每个物种落叶被取食前后生物量的损耗作为消费率指标。试验前所有选用潮虫个体被断食处理24 h并称重。每只潮虫均被使用1次。试验后将装有剩余残叶的玻璃瓶移至50℃的烘箱进行48 h烘干,随后逐一称重落叶残余生物量。
与此同时,为了检测植物落叶分解率是否与其部分初始性状指标相关,20个植物种凋落物中的木质素、纤维素、半纤维素,以及碳、氮等代表性化学指标成分由德国耶那食品有限公司专业实验室测定。其中木质素由酸性洗涤木质素法(Acid detergent lignin(ADL))测定,而用酸性洗涤纤维法(Acid detergent fiber(ADF))测定木质素和纤维素的混合含量,后者减去前者则得出纤维素含量。再用中性洗涤纤维法(Neutral detergent fiber(NDF))测定木质素、纤维素和半纤维素的综合含量,同理用中性纤维素法数值减去酸性纤维素法数值,推算出半纤维素含量指标。随后碳氮含量则用元素分析仪测定,相应测算出C∶N比值。
1.4 数据分析
统计分析通过SPSS(17.0版本)的统计软件实现。数据经过正态转化处理后满足后续检验所需前提条件。通过运用嵌套设计的方差分析以入侵性为主效应,植物生活型为随机因子确定潮虫对不同入侵水平下木本植物类群的消耗差异;相关分析法用以测试植物木质素、纤维素、半纤维素、碳、氮含量及碳氮比值之间的线性关系;并利用协方差分析方法考察植物种本身的初始性状(木质素、纤维素、半纤维素、碳、氮、碳氮比)与消耗率之间的相关性;最后运用多变量方差分析检测入侵性和生活型双因素影响下,各个初始性状作为相应变量是否具有显著差异。
2 结果与分析
2.1 潮虫对木本植物落叶的消耗差异
首先,经过为期15d的喂养测试,20个植物种的凋落物均被潮虫取食,但消耗率从7%至81.6%不等。其中消耗率大于50%的有6种;消耗率小于10%仅1种,为欧洲山毛榉(图1)。
潮虫偏好的前5个物种中除欧洲桤木为乔木以外,其他4种都是灌木;相应不受青睐的5种植物均为乔木。其次,通过嵌套设计的方差分析,本地种,非入侵性外来种和入侵性外来种之间的消耗率差异不显著(F2,792=0.165,P=0.855),而乔木与灌木之间差异却极为显著(F3,792=34.176,P=0.005)。表明潮虫对不同入侵状态下的木本植物的落叶分解不存在明显偏好,而对灌木的取食大于乔木(图2,图3)。
2.2 植物初始性状指标与消耗率之间的相关性
木质素、纤维素、半纤维素、碳和氮含量分别以其在植物叶片干物质中的百分率表示。数据显示种间差异显著:木质素含量在欧洲榆树中最低(6%),桤木中最高(36.8%);臭椿的纤维素含量最低(9.1%),而玉兰(29%)最高;半纤维素含量则以山梅花(0.8%)最低,玫瑰(36.7%)最高;碳含量榆树(40.2%)最低,桤木(52.6%)最高;氮含量则以火炬树(0.62%)最低,桤木(2.61%)最高。

图1 20种木本植物凋落物被潮虫取食消耗比率Fig.1 The consumption rate of 20 woody species by woodlouse
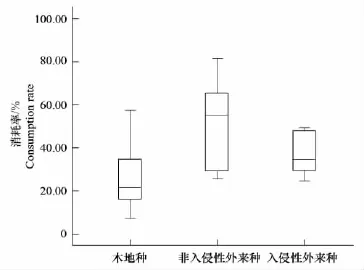
图2 潮虫对本地种、非入侵性外来种和入侵性外来种凋落物分别消耗的箱线图(P>0.05)Fig.2 The box-plot of consumption rate of native,non-invasive alien and invasive alien species(P>0.05)

图3 潮虫对乔木和灌木种凋落物分别消耗的箱线图(P<0.05)Fig.3 The box-plot of consumption rate of tree and shrub(P<0.05)
植物初始性状之间的相关检验表明碳、氮含量分别与木质素含量呈正相关;纤维素、半纤维素含量与其他性状指标并无线性关系(表2)。
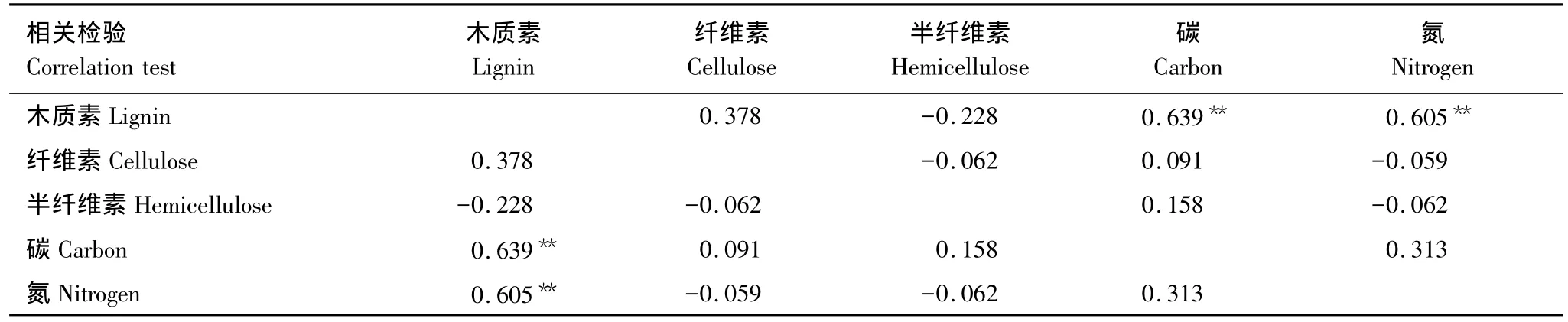
表2 植物初始性状指标之间的相关性Table 2 The correlation among initial traits of plant
其次,以入侵性和生活型为效应因子,对植物初始性状进行多变量变异方差分析,结果表明本地种、非入侵性外来种和入侵性外来种的组间无明显差异,乔木和灌木之间也无显著差异。
最后,植物初始性状指标中氮含量与消耗率呈现极显著相关,氮含量越高,潮虫对其消耗率则越高(图4)。
3 讨论
3.1 潮虫对本地种及不同入侵状态下木本植物的消耗
研究的根本目的是通过本地林下代表性分解生物的自由取食试验,来检测其对本地种、非入侵外来种和入侵性外来种是否具有显著的消耗差异。依据Cappuccino等人基于天敌逃逸假说和新武器假说的一系列研究,他们认为入侵性外来种比非入侵性外来种可能较少遭受到植食性动物取食,这种差异来源于外来入侵种可能含有一些在本地植物群落中鲜见而又强有力的新颖植物化学物质。并且这些独特的次生化合物已有多种被证实具有多重效应,包括抗草食性、抗真菌、抗微生物和化感(植物毒性)作用等,可为植物在新环境中的生长带来复合优势[31-32]。Michall和Power也发现在美国473个归化的欧洲植物种中,入侵性越强的植物对病原真菌存在越高抵御能力[33]。类似研究说明一般情况下入侵性外来种对植食性动物的逃逸能力相对高于非入侵性物种[34-35]。再加上考虑到本地木本植物长期的理化适应性以及其与本地土壤生物的协同进化,此次试验预期假设为潮虫对本地种、非入侵性外来种和入侵性外来种的消耗率依次减弱。
然而,与预测不一致的是,研究结果显示上述三者之间消耗率并无显著差异(P>0.05)。且与假设不同,各类均值比较显示本次试验中本地种被消耗最少;非入侵性外来种最高,而入侵性外来种的被消耗率则介于本地种与非入侵性外来种之间。造成这种结果的原因可能是由于生活型的不同在潮虫取食偏好的选择上扮演了重要角色。数据分析结果显示潮虫对灌木的取食显著高于乔木。相应的,本次试验选材中本地种具有8∶2的乔灌比,而外来种则以3∶7的比例搭配。结果说明以入侵性和生活型同为影响消耗率的因子考虑时,生活型因子比入侵性因子能更加显著的影响潮虫消耗率。也就是说,潮虫选择取食的偏好与入侵性并无显著关联,但潮虫对不同生活型木本植物的消耗率却存在极显性差异。入侵性外来种比非入侵性外来种或本地种含有让本地消费者难以消耗的化合物的假设更无从考证。人们在一定程度上认同天敌逃逸在生物入侵过程中可能的作用机制,但并未因此而认定入侵性外来种比非入侵外来种或本地种一定含有并更具毒性的化合物,它们只是在新范围内缺乏更有效适应它们的草食性动物、病原体以及可竞争抑制它们的本地种。
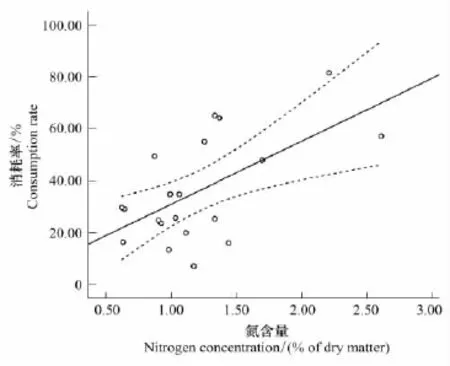
图4 植物叶成分中氮含量与消耗率正相关Fig.4 Positive relationship between N concentration in leaf litter and consumption rateP=0.005,R2=0.358
生物入侵机制的研究复杂多变,如化感作用、土壤微生物群落的改变的影响等也很重要,但这些机制归根结底取决于植物化学成分的分配与作用[36-37]。外来植物中,特别的、新颖的植物化学物质能够赋予这些植物多重优势,并促使多个机制共同作用。因此,只有少量外来种会成为高侵略性的入侵者并对本地种产生严重的负面影响,而大部分外来种并不具有入侵性,仅能演化成为本地植物种群中的一小部分[38]。但探索或明确三者之间某些潜在的重要区别,无疑可以为生物入侵路径、策略的原理研究,为生物入侵性的预测和防治提供依据。
3.2 植物初始性状指标中氮含量作用显著
许多对植物消耗的比较研究显示,叶成分中的某些初始化学物质的含量决定了其被消耗程度。比如说,高氮含量或低碳氮比可导致高消耗率;而高的木质素含量却意味着低消耗率[39-40]。本试验与先前研究结果一致,木本植物的消耗与植物化学成分中氮含量呈正相关,但并未显示出木质素与消耗率的线性关系。事实上有研究指出,木质素浓度与植物落叶蛋白质成分形成复杂关联,一般能够在第1个月抑制消耗,而氮则是随着土壤分解生物克服木质素的复杂障碍之后,从蛋白质中释放出来,成为影响消耗的重要因素之一[41-42]。但本喂养试验历经15 d左右,并未达到1个月的临界值,却突显了氮含量在植物营养成分中的重要作用。此外,欧洲桤木作为研究学者所熟知的固氮植物,虽木质素含量最高,但仍达到了较高消耗率。表明叶氮含量在某些情况下并不是预测植物被消耗速率的唯一指标,植物是否具有固氮共生菌以及相对转移性多酚化合物等也是作用于消耗过程的参考性状[18,22]。
总之,生态系统功能和结构的复杂性注定了生物入侵进程研究的艰难,人类与外来入侵种的较量尤其困难和昂贵[43]。越来越多的研究将本地种,非入侵性外来种、入侵性外来种进行分类比较[44],将逐步理清为什么有些种就能成为入侵种,而大部分外来种成为归化种的机制和原理,能够预测哪些外来种有可能成为自然区域的有害生物,将允许相关管理人员在有害生物广泛传播到远离他们入境口岸的区域之前就采取宏观调控措施加以防治,从而将其对生态系统的危害和经济损耗降到最低。但所有这些都需要开展大量而长期的跟踪调研工作,建议世界各国就现有的数据平台加以完善和系统化,并逐步实现信息的充分共享,期望从中总结和归纳出生物入侵的共同特征。
致谢:美国堪萨斯州恩波利大学生物系John Richard Schrock教授润色英文摘要,特此致谢。
[1] Mack M C,D'Antonio C M.Impacts of biological invasions on disturbance regimes.Cell,1998,13(5):195-98.
[2] Yan Z P,Tong C.Impacts of exotic plant invasions on the terrestrial ecosystem below-ground carbon cycling and carbon pool.Acta Ecologica Sinica,2008,28(9):4440-4450.
[3] Harner M J,Crenshaw C L,Abelho M,Stursova M,Shah J J F,Sinsabaugh R L.Decomposition of leaf litter from a native tree and an actinorhizal invasive across riparian habitats.Ecological Applications,2009,19(5):1135-1146.
[4] Reinhart KO,VandeVoort R.Effect of native and exotic leaf litter on macroinvertebrate communities and decomposition in a western Montana stream.Diversity Distributions,2006,12(6):776-781.
[5] Chen F L,Zheng H,Yang B S,Ouyang Z Y,Zhang K,Tu N M.Effects of exotic species slash pine(Pinus elliottii)litter on the structure and function of the soil microbial community.Acta Ecologica Sinica,2011,31(12):3543-3550.
[6] Quan G M,Zhang J N,Xie J F,Mao D J,Xu H Q,Jiang W B,Wen D J.Impact of Mikania micrantha invasion on soil meso-and microinvertebrate community structure.Chinese Journal of Applied Ecology,2011,22(7):1863-1870.
[7] Walker L R,Smith S D.Impacts of invasive plants on community and ecosystem properties//Luken J O,Thieret J,eds.Assessment and Management of Plant Invasions.New York:Springer,1997:69-86.
[8] Seeber J,Seeber G U H,Langel R,Scheu S,Meyer E.The effect of macro-invertebrates and plant litter of different quality on the release of N from litter to plant on alpine pastureland.Biolology and Fertility of soils,2008,44(5):783-790.
[9] Kurzatkowski D,Martius C,Höfer H,Garcia M,Förster B,Beck L,Vlek P.Litter decomposition,microbial biomass and activity of soil organisms in three agroforestry sites in central Amazonia.Nutrient Cycling in Agroecosystems,2004,69(3):257-267.
[10] Alonso A,Gonzalez-Munoz N,Castro-Diez P.Comparison of leaf decomposition and macroinvertebrate colonization between exotic and native trees in a freshwater ecosystem.Ecological Research,2010,25(3):647-653.
[11] Loranger-Merciris G,Imbert D,Bernhard-Reversat F,Ponge J F,Lavelle P.Soil fauna abundance and diversity in a secondary semi-evergreen forest in Guadeloupe(Lesser Antilles):influence of soil type and dominant tree species.Biology and Fertility of Soils,2007,44(2):269-276.
[12] Seeber J,Seeber GUH,Langel R,Scheu S,Meyer E.The effect of macro-invertebrates and plant litter of different quality on the release of N from litter to plant on alpine pastureland.Biology and Fertility of Soils,2008,44(5):783-790.
[13] Kurzatkowski D,Martius C,Höfer H,Garcia M,Förster B,Beck L,Vlek P.Litter decomposition,microbial biomass and activity of soil organisms in three agroforestry sites in central Amazonia.Nutrient Cycling in Agroecosystems,2004,69(3):257-267.
[14]Tajovsky K,Šantr˚ucˇková H,Háneˇl L,Balik V,Lukesova A.Decomposition of faecal pellets of the millipede Glomeris hexasticha(Diplopoda)in forest soil.Pedobiologia,1992,36:146-158.
[15] Webster J R,Benfield E F.Vascular plant breakdown in freshwater ecosystems.Annual Review of Ecology Evolution and Systematics,1986,17(1):567-594.
[16] Grçca M A S.The role of invertebrates on leaf litter decomposition in streams—a review.International Review of Hydrobiology,2001,86(4/5):383-393.
[17] Hobbie S E,Vitousek P M.Nutrient limitation of decomposition in Hawaiian forests.Ecology,2000,81(7):1867-1877.
[18] Quested H M,Callaghan T V,Cornelissen J H C,Press M C.The impact of hemiparasitic plant litter on decomposition:direct,seasonal and litter mixing effects.Journal of Ecology,2005,93(1):87-98.
[19] Ehrenfeld J G.Effects of exotic plant invasions on soil nutrient cycling processes.Ecosystems,2003,6(6):503-523.
[20] Liao C Z,Peng R H,Luo Y Q,Zhou X H,Wu X W,Fang C M,Chen J K,Li B.Altered ecosystem carbon and nitrogen cycles by plant invasion:a meta-analysis.New Phytologist,2008,177(3):706-714.
[21] Castro-Díez P,González-Muñoz N,Alonso A,Gallardo A,Poorter L.Effects of exotic invasive trees on nitrogen cycling:a case study in Central Spain.Biological Invasions,2009,11(8):1973-1986.
[22] Knight K S,Kurylo J S,Endress A G,Stewart J R,Reich P B.Ecology and ecosystem impacts of common buckthorn(Rhamnus cathartica):a review.Biological Invasions,2007,9:925-937.
[23] Drenovsky R E,Batten K M.Invasion by Aegilops triuncialis(barb goatgrass)slows carbon and nutrient cycling in a serpentine grassland.Biological Invasions,2007,9(2):107-116.
[24] Alonso A,Gonzalez-Munoz N,Castro-Diez P.Comparison of leaf decomposition and macroinvertebrate colonization between exotic and native trees in a freshwater ecosystem.Ecological Research,2010,25(3):647-653.
[25] Kurokawa H,Peltzer D A,Wardle D A.Plant traits,leaf palatability and litter decomposability for co-occurring woody species differing in invasion status and nitrogen fixation ability.Functional Ecology,2010,24(3):513-523.
[26] Yale Center for Environmental law and Policy,Yale University& Center for International Earth Science Information Network,Columbia University.Environmental Performance Index 2008 [EB/OL]http://epi.yale.edu:2008/Contents.
[27] Wittenberg R,Kenis M,Hänggi A,Gassmann A,Weber E.Invasive alien species in Switzerland.Bern:Federal Office for the Environment(FOEN),2006.
[28] Catalan T P,Lardies M A,Bozinovic F.Food selection and nutritional ecology of woodlice in Central Chile.Physiological Entomology,2008,33(1):89-94.
[29] Ihnen K,Zimmer M.Selective consumption and digestion of litter microbes by Porcellio scaber(Isopoda:Oniscidea).Pedobiologia,2008,51(5/6):335-342.
[30] Wandeler H,Bahylova J,Nentwig W.Consumption of two Bt and six non-Bt corn varieties by the woodlouse Porcellio scaber.Basic and Applied Ecology,2002,3(4):357-365.
[31] Cappuccino N,Carpenter D.Invasive exotic plants suffer less herbivory than non-invasive exotic plants.Biology Letters,2005,1(4):435-438.
[32] Cappuccino N,Arnason J T.Novel chemistry of invasive exotic plants.Biology Letters,2006,2(2):189-193.
[33] Mitchell C E,Power A G.Release of invasive plants from fungal and viral pathogens.Nature,2003,421(6923):625-627.
[34] Agrawal A A,Kotanen P M.Herbivores and the success of exotic plants:a phylogenetically controlled experiment.Ecology Letters,2003,6(8):712-715.
[35] Keane R M,Crawley M J.Exotic plant invasions and the enemy release hypothesis.Trends in Ecology and Evolution,2002,17(4):164-170.
[36] Callaway R M,Ridenour W M.Novel weapons:invasive success and the evolution of increased competitive ability.Frontiers in Ecology and the Environment,2004,2(8):419-426.
[37] Kourtev P S,Ehrenfeld J G,Häeggblom M.Exotic plant species alter the microbial community structure and function in the soil.Ecology,2002,83(11):3152-3166.
[38] Williamson M,Fitter A.The varying success of invaders.Ecology,1996,77(6):1661-1666.
[39] Cornwell W K,Cornelissen J H C,Amatangelo K,Dorrepaal E,Eviner V T,Godoy O,Hobbie S E,Hoorens B,Kurokawa6 H,Pérez-Harguindeguy N,Quested H M,Santiago L S,Wardle D V,Wright I J,Aerts R,Allison S D,van Bodegom P,Brovkin V,Chatain A,Callaghan T V,Díaz S,Garnier E,Gurvich D E,Kazakou E,Klein J A,Read J,Reich P B,Soudzilovskaia N A,Vaieretti M V,Westoby M.Plant species traits are the predominant control on litter decomposition rates within biomes worldwide.Ecology Letters,2008,11(10):1065-1071.
[40] Zhang D,Hui D,Luo Y,Zhou G Y.Rates of litter decomposition in terrestrial ecosystems:global patterns and controlling factors.Journal of Plant Ecology,2008,1(2):85-93.
[41] Gallardo A,Merino J.Nitrogen immobilization in leaf litter at two Mediterranean ecosystems of SW Spain.Biogeochemistry,1992,15(3):213-228.
[42] Gallardo A,Merino J.Leaf Decomposition in two Mediterranean ecosystems of southwest Spain:influence of substrate quality.Ecology,1993,74(1):152-161.
[43] Pimentel D,Lach L,Zuniga R,Morrison D.Environmental and economic costs of nonindigenous species in the United States.Bioscience,2000,50(1):53-64.
[44] van Kleunen M,Weber1 E,Fischer M.A meta-analysis of trait differences between invasive and non-invasive plant species.Ecology Letters,2010,13(2):235-245.
参考文献:
[2] 闫宗平,仝川.外来植物入侵对陆地生态系统地下碳循环及碳库的影响.生态学报,2008,28(9):4440-4450.
[5] 陈法霖,郑华,阳柏苏,欧阳志云,张凯,屠乃美.外来种湿地松凋落物对土壤微生物群落结构和功能的影响.生态学报,2011,31(12):3543-3550.
[6] 全国明,章家恩,谢俊芳,毛丹鹃,徐华勤,姜万兵,文杜娟.薇甘菊入侵对中小型土壤动物群落结构特征的影响.应用生态学报,2011,22(7):1863-1870.
