性别、季节和体型大小对吐鲁番沙虎巢域的影响
2013-09-11李文蓉宋玉成
李文蓉,宋玉成,时 磊
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.上海师范大学生命与环境科学学院,上海 200234;3.中南林业科技大学野生动植物保护研究所,长沙 410004)
Rose将巢域定义为一个物种生存和活动所需的特定日常行为(包括觅食、求偶和寻找庇护所等)时所涵盖的区域[1]。通常认为巢域的大小反映动物的需求[2-3],巢域是动物获取资源(如水、食物、隐蔽地和繁殖场所等)和占据良好环境的载体,是动物生存、繁衍和发展的物质基础和首要条件,由于自然环境差异性以及物种本身对其影响方式的不同,形成了不同的巢域利用结构,反映了动物与自然界相互影响、相互作用最直接、最密切的关系[1,3]。相关研究表明,不仅外界条件(包括温湿度、水分、食物分布、季节、气候变化等)的变化会对栖息地产生影响而引发动物的巢域面积变化,而且动物自身性别、体型大小、繁殖状态和活跃度等也会影响其巢域的范围大小[3-5]。
大量的研究证据表明,蜥蜴是爬行类空间利用研究的绝佳材料之一,蜥蜴的巢域研究是其种群生态的重要特征[3,6-7];巢域研究还可为许多生态学和行为学的研究(例如,行为模式、婚配模式、社会结构和系统发生等)提供线索[3,8];巢域也是个体信号系统进化的影响因素之一[3]。在研究尺度上涵盖层次多,构成了较为完整的巢域研究与生态保护结合的理论体系。然而,现阶段国内巢域研究及相关研究较少[8],且多限于简单的巢域面积计算,对其影响因素分析并不多见。
吐鲁番沙虎(Teratoscincus roborowskii)隶属于有鳞目(Squamata),壁虎科(Gekkonidae),沙虎属(Teratoscincus),仅分布于中国西北部的吐鲁番地区,为中国特有种[9]。目前,有关吐鲁番沙虎的研究主要集中在捕食模式[10]、幼体拟态[11]、活动节律[12]、两性异形[13]、年龄鉴定[14]等,吐鲁番沙虎的巢域及其影响因素的研究未见报道。本文基于吐鲁番沙虎野外巢域的调查数据,对繁殖期与非繁殖期巢域面积变化进行了研究,探讨吐鲁番沙虎性别、季节及体型大小对巢域面积的影响。
1 材料和方法
1.1 研究区概况
中国科学院吐鲁番沙漠植物园(E89°11',N42°54'),位于吐鲁番盆地东南部恰特卡勒乡境内,海拔为-80.97 m,中国科学院吐鲁番沙漠植物园区域为极端干旱的大陆性气候,干旱少雨多风,年平均气温在14℃;平均湿度41%,年均降水量16.4 mm,蒸发量3 000 mm,地下水8—10 m,年平均8级以上大风日数为32.2 d,最多达68 d,最大风速超过40 m/s[15]。区域内地带性土壤为原始灰棕漠土,具有特色的植物类群主要有柽柳(Tamarix spp.)、沙拐枣(Calligonum spp.)、沙冬青(Ammopiptanthus spp.)、白刺(Nitraria spp.)和梭梭(Haloxylon spp.)等具有高度耐盐耐寒特性的荒漠优势植物物种[16]。
1.2 样方设置
在研究区设置100 m×100 m样方一个,在样方的4个角用1.2 m长、系以红色布条的竹竿作为标记,并选择样方四角周围的固定物(如植株或沙堆等)进一步确定样方的位置和边界。以样方的西南角为坐标原点(0,0)建立直角平面坐标系,每5 m做一个标记刻度以便快速确立重捕点的横纵坐标数值,整个大样方相应被分成5 m×5 m的小样方400个,每个真实的重捕点都相应地记录在坐标系中[7]。
1.3 数据调查
1.3.1 调查时段
本文将调查期大致分为两季进行:2008年6月份至2008年8月份为繁殖季节(RS),2008年9月份至2009年5月份(冬眠期除外)为非繁殖季节(NRS)。将吻肛长(SVL,±0.01mm)=74.77 mm作为成、幼体划分的依据,SVL≥74.77 mm 的吐鲁番沙虎为成体组,SVL<74.77 mm 的为幼体组[14]。
1.3.2 调查方法
采用截趾法对捕获的个体进行永久性标记,同时记录吻肛长、性别、捕获时间、编号等。累计标记个体共283个,标记后放回最初捕捉点。在再次捕获个体的背部用荧光染料按照永久标记的编号做临时标记,以便快速准确的确定个体[17]。因吐鲁番沙虎为严格的夜行性动物[11],在夜间进行活动位置调查时,可利用其眼睛对手电筒光束的反射确定位置[17]。确定个体位置后,在发现点用木筷系标签做标记,标签注明所发现个体的编号,次日白天将前晚调查的个体位置和编号进行坐标记录。调查工作隔天进行,同一晚的每次调查间隔1h,每只个体每晚仅调查1次,以减少调查工作对样地内个体活动的影响[18]。
1.4 数据处理
1.4.1 巢域面积
选取被捕获次数在3次和/或3次以上个体的位置数据用于进一步统计分析[19],采用最小凸多边形法(MCP)计算巢域面积,该方法下的巢域面积包括动物在特定时期使用和穿越的所有空间[1,20]。利用软件MapGis对吐鲁番沙虎个体重捕样点围成的面积进行绘制测算。
1.4.2 统计处理
统计分析采用SPSS16.0进行,非参数检验Kruskal-Wallis、Mann-Whitney U等方法检验不同性别、不同体型大小和不同季节吐鲁番沙虎巢域面积差异的显著性,spearmen检验吐鲁番沙虎巢域面积和吻肛长的相关性。描述性统计值用平均值±标准误(mean±SE)表示,显著性水平均为α=0.05。
2 结果
2.1 吐鲁番沙虎的巢域面积
繁殖季节24只,非繁殖季节43只吐鲁番沙虎的重捕超过3次(其中13只个体在繁殖季节和非繁殖季节均够3次以上捕捉次数,为重复个体),可以用于计算巢域面积(图1)。
利用软件MapGis计算巢域面积,结果见表1。用Kruskal-Wallis检验不同季节雌、雄成体及幼体3个组间的差异性。从表1可以看出,繁殖季节吐鲁番沙虎的平均巢域面积雄性成体>幼体>雌性成体,各组间差异均不显著(P=0.760);非繁殖季节吐鲁番沙虎的平均巢域面积雄性成体>雌性成体>幼体,各组间差异显著(P=0.011)。
2.2 不同性别间的比较
由于不通过解剖幼体难以仅根据外形鉴别性别,因此只分析雄性成体和雌性成体两组间个体巢域面积的差异性。Mann-Whitney U检验结果表明,同一季节巢域大小性别间差异均不显著(繁殖季节U=12,P=0.432;非繁殖季节U=13,P=0.503),且全年不同性别间巢域大小的差异也都不显著(U=57;P=0.419)。因此,性别不是影响吐鲁番沙虎巢域面积的显著因素。

表1 吐鲁番沙虎巢域面积/m2Table 1 The home range size of T.roborowskii
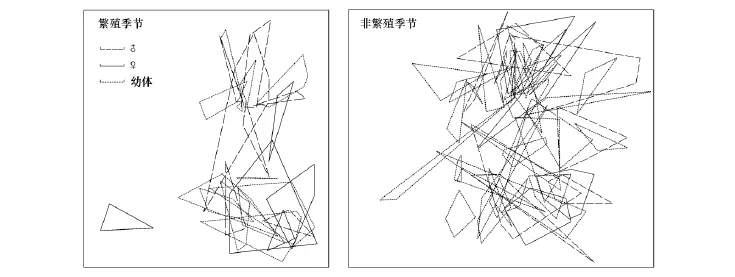
图1 吐鲁番沙虎的巢域示意图Fig.1 Home range polygon clusters diagrams of T.roborowskii标尺=10m
2.3 不同体型大小间的比较
由于吐鲁番沙虎成体雌雄间的巢域面积差异均不显著,因此对繁殖季节和非繁殖季节组内雌雄个体数据分别合并为成体组,并用Spearmen检验相关性、Mann-Whitney U方法检验差异性分析体型大小对巢域面积的影响(图2)。
繁殖季节成体组及幼体组的巢域大小与吻肛长的相关性均不显著(巢域大小-吻肛长,成体r=0.524,P=0.08,幼体 r=-0.147,P=0.649),成幼巢域面积差异不显著(P=0.977);非繁殖季节成体组巢域大小-吻肛长相关性不显著(r=0.456,P=0.117),幼体组的相关性不显著(巢域大小-吻肛长,r=0.252,P=0.179),成幼巢域面积差异显著(P=0.005)。

图2 巢域大小与吻肛长关系图Fig.2 The home range size against snout-vent length for T.roborowskii
不同季节数据合并分析,繁殖季节巢域大小-吻肛长(r=0.107,P=0.619)相关性不显著,而非繁殖季节巢域大小-吻肛长(r=0.488,P=0.001)相关性显著(图2),这种明显的相关说明吐鲁番沙虎受季节因素影响其巢域大小。进一步合并全年数据分析可知,其巢域大小-吻肛长关系(r=0.264,P=0.031)显著相关,巢域面积成幼间差异不显著(P=0.102)(图2)。
2.4 不同季节间的比较
非参数Mann-Whitney U检验显示吐鲁番沙虎繁殖季节与非繁殖季节间个体大小差异不显著(成体U=73.5,P=0.810;幼体 U=159,P=0.573),成体巢域面积季节差异显著(U=41,P=0.046),幼体则没有季节差异(U=159,P=0.537);不分成幼的合并数据分析显示巢域面积季节间差异不显著(U=399,P=0.126)。同一类型季节间差异均不显著(雄性成体季节间U=4,P=0.142,雌性成体季节间U=16,P=0.101,幼体季节间 U=159,P=0.537)。
3 讨论
动物对巢域的占据和利用是一个复杂的生态学现象,巢域是动物各种活动综合作用的产物,动物会在其巢域生境中调整彼此之间的资源利用,因此必须从更宏观的背景和更深层次去分析影响巢域大小的运行机制,包括栖息地、时间、食物、繁殖、种群密度、性别、种群结构、竞争者等[1-8,18]。
3.1 性别
一般而言,具有两性异形的生物雄性体型通常大于雌性,因而较大体型的雄性个体选择更大巢域面积的倾向性导致雄性巢域面积大于雌性的巢域[1,3,7,18],或是具领域性的雄性个体在有意识的择偶系统中需要更大巢域面积去牵制多个潜在交配的雌性个体,抑或是具社会性的雄性个体把提高交配率作为目的,致力于寻觅更多潜在交配的雌性个体,牵制活动和寻觅活动二者均可推动其扩大巢域范围[3,7,21],同时雄性个体追求最优化的生殖状态(增加交配机会、提高生育力、减少外界生殖干扰等)本能地排挤其他个体的冲动意识,协助雄性在组织巢域范围的过程中占有绝对优势[21]。然而,体型大小相同的个体也会表现出雄性巢域比雌性巢域要大[3],雄性巢域扩大主要在于能在繁殖上有更多的选择可能性,雌性巢域缩小主要在于怀孕期运动减少,协调逃避捕食者的威胁等[22]。如青海沙蜥属于卵胎生物种,采用该生殖策略的种群,雌性需要投入大量的生殖能量,而且怀孕时间长,行动不便,因而巢域较雄性小很多[8]。
吐鲁番沙虎的繁殖方式为卵生,野外观察雄性个体保卫领域及争夺雌性交配权等现象比较少见,雄性沙虎投入的生殖代价相对较小;而雌性吐鲁番沙虎是优化而非最大程度利用腹腔空间[13],不需要较大体型进行生殖活动。本研究中雄性的平均巢域面积大于雌性,但差异没有达到显著性水平,这可能和吐鲁番沙虎没有显著的两性异形有关[13]。换言之,性别不是影响吐鲁番沙虎巢域面积的主要因素。
3.2 体型大小
根据能量学说,随着体型大小的增加而能量需求增加,因此不管物种是否具有领域性,蜥蜴的巢域大小与体型大小之间存在着关联[1-3,6,23],总体上讲,表现为体型越大的个体巢域范围越大,因为体型大的个体占据较大的巢域范围以满足自身的需求,如较大体型可提高格斗能力争夺配偶、占据有利资源等[3,5-6]。具体来讲,体型较小的个体巢域比较集中于一个“斑块”[23-24];体型大的个体并非几个小体型个体巢域的“集合斑块”,而是更为精致的大于“斑块”而小于“集合斑块”的优质巢域范围[24]。性别间的体型差异引起的巢域差异、同性别的个体因体型大小差异引起的巢域差异,归根结底在于物种本身的能量代谢需求,但不包括雄性独裁该群体的情况[3,5,21,23]。全年吐鲁番沙虎成体的巢域大小和其吻肛长的相关关系显著;分季节看,吐鲁番沙虎巢域在繁殖季节成幼差异不显著,且巢域与吻肛长相关性不显著,而在非繁殖季节成幼差异显著,巢域与其吻肛长相关性显著。说明体型大小是影响吐鲁番沙虎巢域大小的因素之一。
3.3 季节
对于昼行性且夏季繁殖的蜥蜴来说,夏季巢域要大于其他季节,因为夏季活动时间比体温调节时间要多,随着夏季搜寻食物及躲避场所、寻找配偶等活动的增加,蜥蜴在平常独自生活的基础上需要开辟更大或重构巢域范围[25-27],其他季节个体能量需求减少,调节体温时间较多导致活动时间受到限制[25-26],在食物充足的情况下,蜥蜴在夏季也会比其他季节活动距离更长[27]。总之,温度阈值范围内,昼行性蜥蜴温度越高巢域愈大,光照时间越长巢域越大,而吐鲁番沙虎是严格的夜行性物种,活动受到外界温度和光照双重的影响,在可承受的范围内,繁殖季节比非繁殖季节温度高,活动时间长,巢域大,相应光照时间长,活动时间则短,巢域小,反之亦然。不同因素的权衡可能导致了吐鲁番沙虎季节间总体的巢域面积差异不显著。
季节是一个综合因素,如热环境、蜥蜴的生殖状态、食物可获得性等以复杂的方式影响着吐鲁番沙虎的巢域,这些因素又都是季节性变化的[3,29]。Sceloporus undulatus erythrocheilus雄性个体在繁殖季节后巢域大小明显下降,减少的活动量会主要用于储能越冬[29],吐鲁番沙虎成体间巢域面积季节差异显著,但巢域范围没有缩小而是扩大说明繁殖状态的季节性变化不是影响巢域面积的唯一因素[3,28]。食物资源分配是巢域面积研究的重要方面,蜥蜴面对资源季节性规律变化和分布存在权衡问题[3,22]。体型大小相同的肉食性蜥蜴巢域面积最大,其次是杂食性蜥蜴,草食性蜥蜴巢域面积最小[1,3,21]。野外观察发现,吐鲁番沙虎常出现在植物分布多的沙丘上,可以作为隐蔽场所,也方便采食[12]。在食物可获得性方面,吐鲁番沙虎成体的食性组成随着季节变化发生明显变化,繁殖季节摄入最多的为植物果实(34.84%),而非繁殖季节主要是动物性食物,蚁科占食物比例30%,步甲科占23.81%[13]。繁殖季节吐鲁番沙虎成体主要以生境中刺山柑果实为食,相对于动物性食物分布较集中,定居场所较隐蔽,从而减小了活动范围;而非繁殖季节以动物性食物为主,需要更大的巢域范围去捕食分散的食物,导致非繁殖季节的巢域面积大于繁殖季节,且差异显著,说明季节对成体巢域的影响主要是繁殖状态和食物资源因素。幼体没有繁殖状态的季节变化,活动主要受到热体温调节和食物资源的影响。繁殖季节幼体被成体排挤到食物密度较低的生境中[21],需要在较大的范围搜寻食物,而非繁殖季会有大量的新生个体出现使得幼体平均巢域面积减小,导致吐鲁番沙虎的幼体繁殖季节的平均巢域面积要大于非繁殖季节,但差异不显著。
综合上述,吐鲁番沙虎的巢域大小受性别因素影响不大,体型大小对巢域面积有显著影响,由于繁殖、食物资源等的季节变化是影响吐鲁番沙虎巢域最重要的因素。
致谢:华东理工大学理学院商晨菲帮助数据分析、上海师范大学Rob Lewis润色英文摘要,特此致谢。
[1] Rose B.Lizard home ranges:methodology and functions.Journal of Herpetology,1982,16(3):253-269.
[2] Manteuffel V M,Eiblmaier M.The influence of competitor density on space use in juvenile striped plateau lizards(Sceloporus virgatus).Acta Oecologica,2008,33(3):365-371.
[3] Perry G,Garland T Jr.Lizard home ranges revisited:effects of sex,body size,diet,habitat,and phylogeny.Ecology,2002,83(7):1870-1885.
[4] Basset A.Body size-related coexistence:an approach through allometric constraints on home-range use.Ecology,1995,76(4):1027-1035.
[5] Mace G M,Harvey P H.Energetic constraints on home-range size.American Naturalist,1983,121(1):120-132.
[6] Turner F B,Jennrich R I,Weintraub J D.Home ranges and body size of lizards.Ecology,1969,50(4):1076-1081.
[7] Rocha C.Home range of the tropidurid lizard Liolaemus lutzae:sexual and body size differences.Revista Brasileira de Biologia,1999,59(1):125-130.
[8] Wang S G,Zeng Z Y,Wu P F,Lan Z J,Wang Y Z.Home range of Phrynocephalus vlangalii.Journal of Sichuan University(Natural Science Edition),2004,41(2):403-408.
[9] Shi L,Zhou Y H,Yuan H.Herpetological fauna and zoogeographical division of Xinjiang Uygur Autonomous Region.Sichuan Journal of Zoology,2002,21(3):152-157.
[10] Werner Y L,Okada S,Ota H,Perry G,Tokunaga S.Varied and fluctuating foraging modes in nocturnal lizards of the family Gekkonidae.Asiatic Herpetological Research,1997,7:153-165.
[11] Autumn K,Han B.Mimicry of scorpions by juvenile lizards,Teratoscincus roborowskii(Gekkonidae).Chinese Herpetological Research,1989,2(2):60-64.
[12] Song Y C,Zhao H,Shi L.Daily activity rhythm and its affecting environmental factors of Teratoscincus roborowskii.Journal of Xinjiang Agricultural University,2009,32(1):22-25.
[13] Liu Y,Song Y C,Li W R,Shi L.Sexual dimorphism in head and body size of Teratoscincus roboroskii and its food habits in different seasons.Chinese Journal of Ecology,2010,29(2):333-338.
[14] Li W R,Song Y C,Shi L.Age determination of Teratoscincus roboroskii(Gekkonidae)by skeletochronology.Chinese Journal of Zoology,2010,45(3):79-86.
[15] Yin L K.Turpan Eremophytes Botanic Garden of the Chinese Academy of Sciencesa developing conservation and research base of plant resources diversity in desert area.Arid Zone Research,2004,21(S):1-5.
[16] Yin L K,Zhang J,Wei Y,Yan C.Biodiversity and conservation of plant resources in Xinjiang.Arid Zone Research,2004,21(S):6-12.
[17] Semenov D V,Borkin L J.On the ecology of Przewalsky's Gecko(Teratoscincus przewalskii)in the Transaltai Gobi,Mongolia.Asiatic Herpetological Research,1992,4:99-112.
[18] Sluys M V.Home range of the saxicolous lizard Tropidurus itambere(Tropiduridae)in Southeastern Brazil.Copeia,1997,1997(3):623-628.
[19] Losos J B,Andrews R M,Sexton O J,Schuler A L.Behavior,ecology,and locomotor performance of the giant anole,Anolis frenatus.Caribbean Journal of Science,1991,27(3/4):173-179.
[20] Qi Y,Felix Z,Dai Q,Wang Y,Yang Y,Wang B,Wang Y Z.Post-breeding movements,home range,and microhabitat use of plateau brown frogs Rana kukunoris in Zoige Alpine Wetland.Acta Zoologica Sinica,2007,53(6):974-981.
[21] Verwaijen D,Damme R V.Wide home ranges for widely foraging lizards.Zoology,2008,111(1):37-47.
[22] Miles D B,Sinervo B,and Frankino W A.Reproductive burden,locomotor performance,and the cost of reproduction in free ranging lizards.Evolution,2000,54(4):1386-1395.
[23] Christian K A,Waldschmidt S.The relationship between lizard home range and body size:a reanalysis of the data.Herpetologica,1984,40(1):68-75.
[24] Mysterud A,Pérez-Barbería F,Gordon I.The effect of season,sex and feeding style on home range area versus body mass scaling in temperate ruminants.Oecologia,2001,127(1):30-39.
[25] Christian K A,Weavers B W.Thermoregulation of monitor lizards in Australia:an evaluation of methods in thermal biology.Ecological monographs,1996,66(2):139-157.
[26] Guarino F.Spatial ecology of a large carnivorous lizard,Varanus varius(Squamata:Varanidae).Journal of Zoology,2002,258(4):449-457.
[27] Christian K A,Tracy C R,Porter W.Physiological and ecological consequences of sleeping-site selection by the Galapagos land iguana(Conolophus pallidus).Ecology,1984,65(3):752-758.
[28] Ribeiro L B,Sousa B M,Gomides S C.Range structure,microhabitat use,and activity patterns of the saxicolous lizard Tropidurus torquatus(Tropiduridae)on a rock outcrop in Minas Gerais,Brazil.Revista Chilena de Historia Natural,2009,82(4):577-588.
[29] Ferner J W.Home-range size and overlap in Sceloporus undulatus erythrocheilus(Reptilia:Iguanidae).Copeia,1974,1974(2):332-337.
参考文献:
[8] 王硕果,曾宗永,吴鹏飞,蓝振江,王跃招.青海沙蜥的巢域研究.四川大学学报(自然科学版),2004,41(2):403-408.
[9] 时磊,周永恒,原洪.新疆维吾尔自治区爬行动物区系与地理区划.四川动物,2002,21(3):152-157.
[12] 宋玉成,赵蕙,时磊.吐鲁番沙虎的活动节律及其影响因子分析.新疆农业大学学报,2009,32(1):22-25.
[13] 刘洋,宋玉成,李文蓉,时磊.吐鲁番沙虎头,体大小的两性异形及其食性的季节性变化.生态学杂志,2010,29(2):333-338.
[14] 李文蓉,宋玉成,时磊.基于骨龄学方法鉴定吐鲁番沙虎的年龄.动物学杂志,2010,45(3):79-86.
[15] 尹林克.中国科学院吐鲁番沙漠植物园——发展中的荒漠区植物资源多样性保护研究基地.干旱区研究,2004,21(增刊):1-5.
[16] 尹林克,张娟,魏岩,严成.新疆植物种质资源多样性及其保护.干旱区研究,2004,21(增刊):6-11.
[20] 齐银,Felix Z,戴强,王勇,杨勇,王波,王跃招.若尔盖高寒湿地高原林蛙繁殖后期运动,家域和微生境选择.动物学报,2007,53(6):974-981.
