戊型病毒性肝炎相关性再生障碍性贫血3例及文献复习
2013-09-11王丽佳江宇泳杜宏波杨志云
王丽佳,江宇泳,王 鹏,于 浩,杜宏波,杨志云
首都医科大学附属北京地坛医院1.中西医结合二科;2.病理科,北京 100015
肝炎相关性再生障碍性贫血(hepatitis associated aplastic anemia,HAAA)是一种发生在急性或慢性肝炎后期,以外周血全血细胞减少、骨髓三系细胞增生低下,临床以贫血、出血及感染为特征的骨髓造血衰竭性重症疾病[1],死亡率高达85%[2]。目前世界上已经有200多例报道。HAAA占再生障碍性贫血患者总数的2.2%[3],病毒性肝炎与再生障碍性贫血之间的病因-效应关系是肯定的[4-9],大多数学者认为是由非甲、非乙型肝炎引起。亦有HEV感染相关的HAAA病例个例报道[3,10-11]。现将2000年1月-2013年5月收入我院的3例戊型病毒性肝炎相关性再生障碍性贫血病例总结汇报并进行文献复习。
病例1 患者,李某,男,46岁,职员。主因“皮肤巩膜黄染伴间断发热、纳差、腹痛2周”于2012年3月12日收入我院。急诊查抗 HAV-IgM(-)、HBsAg(-)、抗 HCV(-)、抗 HEVIgM(-)、抗 HEV-IgG(+),血常规示 WBC:9.06 ×109/L,N%:81%,RBC:4.65 ×1012/L,Hb:141 g/L,PLT:206 × 109/L;血淀粉酶:121 IU/L;肝功示 ALT:178 IU/L,AST:74 IU/L,TBIL:136 μmol/L,DBIL:117 μmol/L,ALB:40 g/L,GGT:293 IU/L。入院诊断:肝功异常原因待查。患者入院后给予还原型谷胱甘肽、甘草酸制剂、多烯磷酯酰胆碱、丁二磺酸腺苷氮氨酸、前列腺素E等保肝降酶、退黄治疗,经治疗转氨酶逐渐下降,但黄疸进行性上升,至3月 27日复查肝功示 ALT:46.1 U/L,AST:48.7 U/L,TBIL:463 μmol/L,DBIL:335 μmol/L,PTA:121%,同时发现血红蛋白逐渐下降,至4月17日复查,血红蛋白:70.4 g/L,4月18日复查,血红蛋白:55.2 g/L,RE%:0.09%,骨穿骨髓片示:粒系增生显著,早幼粒易见,中幼粒增多,可见巨变、类巨变、分裂相、中毒颗粒,嗜酸易见,单核增多;红系明显减少,偶见早幼红,成熟红细胞轻度大小不等,部分胞体偏大,可见棘形红细胞;巨核及血小板不少;浆细胞、网状、吞噬细胞易见,偶见异淋(见图1)。骨髓涂片诊断:考虑纯红细胞性再生障碍性贫血。骨髓穿刺活检示:骨髓红系明显减少,HE染色未见明确造红岛,偶见孤立性(1~3个)幼红细胞散布于主质中,粒系和巨核相对轻度增生。间质散在少量含铁血黄素样颗粒沉积。骨髓穿刺活检结果显示:骨髓红系增生低下(见图2)。给予静点免疫球蛋白10 g×6 d加强支持治疗,间断输注红细胞悬液2 u改善贫血,4月25日复查肝功示 ALT:67.7 U/L,AST:57.2 U/L,TBIL:330.4 μmol/L,DBIL:244.5 μmol/L,PTA:110%,血常规示 WBC:6.01 ×109/L,RBC:2.6 ×109/L,Hb:80.1 g/L,PLT:273.4 ×109/L,RE%:0.57%,患者仍自觉乏力、纳差、黄疸下降不明显,转至北大医院感染科治疗,于北大医院住院期间曾两次院内讨论,考虑诊断:戊型病毒性肝炎相关纯血红细胞再生障碍性贫血。8月11日于我院门诊复诊,患者无乏力纳差,复查肝功、血常规均正常范围。患者近3个月病程中均由其配偶陪护,其配偶5月25日因食欲略差、乏力,查及抗 HEV-IgM(+),肝功示 ALT:61.3 U/L,AST:55.3 U/L,TBIL:19.4 μmol/L,DBIL:14.0 μmol/L。服保肝降酶药物治疗1个月,肝功恢复正常。
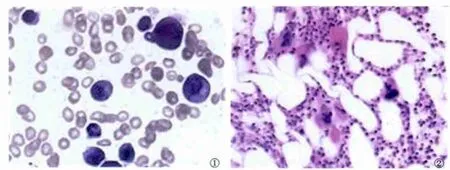
图1 骨髓涂片HE染色(200×) 红系增生明显减少,而粒细胞及巨核细胞并不减少; 图2 骨髓活检切片HE染色(200×)骨髓红系增生低下Fig 1 Bone marrow smears,HE staining(200×)Erythroid hyperplasia was significantly reduced,while granulocytes and megakaryocytes didn’t reduced;Fig 2 Bone marrow biopsy,HE staining(200×)Erythroid hypoplasia of bone marrow was low
病例2 患者,孟某,女,29岁,工程师。主因“发现HBsAg(+)15年,尿黄12 d,发热3 d”于2004年11月5日收入我院。门诊以“病毒性肝炎 慢性 乙型 中度”收入院。入院后查肝功示 ALT:472 U/L,AST:289 U/L,TBIL:219.4 μmol/L,DBIL:154.2 μmol/l,ALB:40.6 g/L,GGT:126 U/L,CHE:3253 U/L;PTA:71.2%;血常规示 WBC:2.9 × 109/L,N%:50.5%,RBC:3.47 ×1012/L,Hb:132 g/L,PLT:19 ×109/L;甲型肝炎抗体-IgM(-),HBsAg(+),HBeAg(+),丙肝抗体(-),抗HDV-IgM、抗HDV-IgG(-),抗 HEV-IgM(+),HBV DNA:2.27 ×107CP/ml,AFP:38.3 ng/ml;酸溶血试验(-),Coombs试验(-);血小板抗体(-);尿Rous试验(+);入院后,给予常规保肝降酶、退黄、胸腺肽调节免疫、贺普丁抗病毒治疗。经治疗患者肝功能逐渐下降,而血常规示三系进行性减少,11月13日复查血常规示 WBC:2.37 × 109/L,N%:34.2%,RBC:3.03 × 1012/L,Hb:111 g/L,PLT:12×109/L,11 月15 日查 RE%:1.8%,骨髓穿刺示骨髓细胞特征:全片以成熟淋巴细胞为主,可见异淋;粒、红两系明显受抑,成熟红细胞轻度大小不等,大部分胞体大,可见异性红细胞;全片未见巨核;全片偶见网状细胞、浆细胞,仅有一个造血岛,以网状纤维细胞为主。考虑诊断:肝炎后再障,予以保肝降酶、退黄、抗病毒、调节免疫治疗,联合静点丙种球蛋白10 g×6 d加强支持治疗6 d,经治疗患者肝功能恢复正常,血象三系较前明显升高,患者临床症状缓解,病情相对平稳,好转出院。
病例3 患者,李某,男,72岁,工人。主因“乏力、纳差、尿黄2个月余,加重10 d”于2003年8月21日收治入院。入院后查肝功示 ALT:83 U/L,AST:198 U/L,TBIL:22.22 μmol/L,ALB:26.4 g/L,CHE:2284 U/L;血常规示 WBC:11.8 ×109/L,N%:86.8%,RBC:2.94 × 1012/L,Hb:108 g/L,PLT:141 × 109/L;PTA:71.2%;甲型肝炎抗体-IgM(-),HBsAg、HBeAg、HBcAb(-),丙肝抗体(-),抗 HDV-IgM、抗 HDV-IgG(-),抗 HEVIgM(+),特种蛋白(-),自身抗体(-),鲎试验(+)。入院诊断:(1)病毒性肝炎急性瘀胆型戊型;(2)酒精性肝病;(3)腹腔感染;(4)腹水。入院后给予常规保肝降酶、退黄、利尿、抗感染等对症及营养支持治疗,疗效欠佳,血常规示三系逐渐下降,2003年 9月 8日复查,血常规示 WBC:1.15×109/L,N%:69.7%,RBC:1.79 ×1012/L,Hb:64 g/L,PLT:59 × 109/L,RE%:0.1%;肝功示 ALT:42 U/L,AST:80 U/L,TBIL:262.7 μmol/L,DBIL:162 μmol/L,ALB:22.6 g/L,CHE:1176 U/L,PTA:67%。骨髓穿刺示骨髓特征:粒系减少,原+早幼粒易见,中幼以下阶段减少,嗜碱易见;红系明显减少,计数中未见有核红,片中偶见巨早红,成熟红细胞大小不等,大部分胞体大,少数中心淡染区扩大;巨核细胞减少,血小板偏少;造血岛空虚,以非造血细胞为主,浆细胞、淋巴、吞噬、组碱为主。考虑诊断:由肝脏疾患引起的继发性再生障碍性贫血。患者及其家属因个人原因,拒绝静点丙种球蛋白治疗,暂给予输全血治疗,此后同时并发严重腹腔感染、尿路真菌感染,抗感染疗效欠佳,患者病情逐渐加重,持续高热,2003年9月16日,突然出现呼吸心跳停止,Bp:0/0 mmHg,抢救无效,最终宣告死亡。
讨论 HAAA的特点:HAAA多为发生于非甲非乙非丙型肝炎后6个月内的再生障碍性贫血(AA)。通常HAAA好发于急性肝炎恢复期,与肝炎严重程度无显著相关,多数患者肝炎症状相对较轻,而再障表现多较重,病情进展快,预后较差[10]。该病发病年龄比普通AA年龄低,且多发于青少年男性,男女比例为2~4∶1[11]。病情凶险,预后较差,早期感染死亡率高,行异基因造血干细胞移植(allo-HSCT)和/或免疫抑制治疗(IST)前,其平均存活期仅为2~5个月。
病因及流行病学:现已发现多种病毒与AA有相关性[12],诸如甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒、庚型肝炎病毒、巨细胞病毒、微小病毒B19、埃克病毒、EB病毒、输血相关性病毒和SEN病毒(环病毒属)等。国外文献[9]报道欧美国家肝炎患者中HAAA发生率约2% ~5%,亚洲国家为4% ~10%。我国上海地区[13]肝炎患者中HAAA的发生率为0.033%,占再障患者的3.2%。
发病机制:HAAA机制相关研究较多,主要为:肝炎病毒感染后随着免疫耐受被打破,Th与Tc细胞向Ⅰ型细胞极化,通过细胞毒性及其释放IFN-γ、IL-2、TNF-β等抑制性细胞因子,直接抑制骨髓造血,或通过凋亡机制导致骨髓造血衰竭。
(1)病毒对造血干细胞的直接抑制作用:肝炎病毒遗传物质可整合到宿主(人类)DNA中,对宿主细胞的增殖及分化产生负调控效应,致全部或大部分祖细胞破坏,骨髓造血功能衰竭。早在1955年就有人提出[13],骨髓与肝脏在胚胎发生学上是同源的。由于肝炎病毒的生物学特性,它们在致肝细胞损伤的同时亦可能使造血干细胞受累(染色体畸变),以致发生HAAA。但再障大多发生在肝炎恢复期、肝功能明显改善或已恢复,所以在发生HAAA时并无其他同一起源器官受累的证据,因此这一论点在后来的研究中已很少被提及。
(2)病毒介导的自身免疫异常或产生T细胞抗体:骨髓细胞与肝细胞有相似的抗原性,亦可充当肝炎病毒的靶细胞而导致细胞免疫和体液免疫功能异常。涂梅峰等[14]对13例HAAA患者进行临床观察,发现HAAA组CD8+T细胞增加,CD4+T细胞减少,CD4+/CD8+T细胞比例下降,说明HAAA患者T细胞免疫异常。病毒介导的自身免疫异常或产生抗T细胞抗体,以Tr细胞病变为主[15],抑制骨髓中 CFU-GM、BFU-E、CFU-E 的形成而发生。
(3)肝炎病毒损伤骨髓造血微环境,导致骨髓基质细胞活性及促造血细胞生长因子的基因损伤:如Dilloo等[16]研究证明,白细胞介素-6(IL-6)是骨髓造血过程中的一种重要正调控因子,但在病毒感染后,骨髓基质中的成纤维细胞内用于合成IL-6的mRNA贮存降低,IL-6蛋白质生成减少;加上另一些基质细胞的功能受到病毒影响,从而使骨髓造血微环境遭到破坏。
(4)肝炎病毒导致凋亡相关基因激活及激酶功能紊乱[16]:在病毒感染所致再障的某些患者的外周血、骨髓中,经流式细胞仪分析发现CD8+T细胞数量明显增加而CD4+T细胞数量则低于正常人,致CD4+/CD8+比例失调[17];同时活性 T细胞释放出畸变的 INF-γ、TNF-β 及淋巴毒素 α(LT-α)[18],这些细胞因子诱导骨髓中CD34+细胞表达出高水平的Fas抗原(Fas-Ag)。Fas-Ag是细胞凋亡的一个信使[19],它在骨髓中的表达一使细胞毒性T细胞对自身造血干细胞造成杀伤;二使骨髓对另一种淋巴因子--克隆抑制因子(clonal inhibitory factor,CIF))现出高度敏感性,从而引起造血障碍。
临床类型为(1)急性型:居多数,起病急,肝炎和再障发病间期平均10周左右,肝炎已处于恢复期,但再障病情重,生存期短,发病年龄轻,大多系在非甲非乙型肝炎基础上发病。诊断标准[20]:发病急,再障重,贫血呈进行性加重,常伴严重感染和内脏出血;血象具有下列3项中的2项:网织红细胞<1%,绝对数<15×106/L;中性粒细胞绝对数<0.5×109/L;血小板绝对数<20×109/L。
(2)慢性型:属少数,大多在慢性乙型肝炎基础上发病,病情轻,肝炎和再障发病间期长,生存期也长。其发病机理仍不清楚。肝炎病毒对造血干细胞有直接抑制作用,还可致染色体畸变,并可通过病毒介导的自身免疫异常。病毒感染尚可破坏骨髓微循环。诊断标准:骨髓象及血象呈慢性再障的表现。本病死亡率国外为83.7% ~87%,国内为57.1%[21]。死亡多发生在肝炎后20周,再障后11周。平均生存期2~5个月。
治疗:根据Gonzalez CR[7]的系统评价及2010年EBMT报告,HAAA的治疗主要包括骨髓移植(HCT)和免疫抑制治疗(IST),其他对症、支持治疗与重型再障基本相同。
(1)急性型HAAA的治疗[22]:重型再生障碍性贫血治疗除了预防和治疗血细胞减少相关的并发症,进行支持治疗(supportive care)外,更重要的则是目标治疗(definitive therapy),即补充和替代极度数量减少和受损的造血干细胞[异基因造血干细胞移植(allo-HSCT)或者免疫抑制治疗,以免损害进一步加重,并使残存的正常或受损干细胞恢复造血。① 支持治疗:输注红细胞、血小板。当血小板<10×109/L(或发热时血小板<20×109/L)时予预防性输注血小板。静脉抗生素和抗真菌药无效的严重全身性感染可考虑短期应用皮下注射粒细胞集落刺激因子(G-CSF)。②目标治疗:主要是异基因造血干细胞移植和免疫抑制治疗。患者年龄越小、造血衰竭程度越重、中性粒细胞绝对值越低则相对于强烈免疫抑制治疗而言HLA相合同胞供者造血干细胞移植治疗获益也越大。免疫抑制治疗适用于年龄大于40岁或无合适供髓者的严重型再障。免疫抑制剂:最常用的是抗胸腺球蛋白(ATG)和抗淋巴细胞球蛋白(ALG)。ATG用量根据不同厂商和免疫动物来源略有不同,来源于马和猪的ATG用量:12~20 mg/(kg·d);来源于兔者:3~5 mg/(kg·d);连用 5 d。
(2)慢性型HAAA的治疗[22]:国内多采用雄性激素和(或)环孢素A(CsA)早期治疗干预。临床常用雄性激素包括睾丸酮类的丙酸睾丸酮,50~100 mg/d,肌肉注射;十一烷酸睾酮,120~240 mg/d,口服;蛋白质同化激素司坦唑,6~12 mg/d,口服。CsA 3~7 mg/(kg·d),分2次口服,或根据血药浓度调节CsA用量,使其维持谷值血药浓度150~250 μg/L。疗程4~6个月。国外则一般仅予密切观察,只有疾病进展患者需要血制品输注支持或进展为重型再生障碍性贫血时才开始予以免疫抑制治疗(immunosuppressive thempy,IST)或造血干细胞移植(hematopoietic stem cell transplantation,HSCT)。目前尚缺乏随机临床试验证明上述哪种处理方法更为合理。
我院的3例戊型病毒性肝炎相关性再生障碍性贫血患者,平均年龄49岁,男性占66.7%,从感染肝炎病毒到发生再障的间隔时间为22~79 d,平均间隔时间为51 d,此时患者肝功能已经明显好转,处于肝炎恢复期。主要临床表现为感染、发热、牙龈出血、贫血、乏力、食欲减退、恶心、呕吐、腹胀痛、黏膜溃疡、肺炎,侵入性真菌感染是常见的死因,特别是那些长期、严重的中性粒细胞减少的患者,3例患者病情进展迅速,发现时血象即表现为重度贫血,骨髓穿刺活检均示有核细胞增生极度低下,粒、红两系细胞增生受抑,骨髓小粒非造血细胞团比例升高,造血面积减少。3例患者均无药物史及化学药品接触史,考虑此次发病与病毒感染相关可能性大,结合临床表现、生化检查及骨髓穿刺活检可明确诊断戊型病毒性肝炎相关性再生障碍性贫血,其中1例为乙、戊型病毒性肝炎重叠感染相关的再生障碍性贫血。该病需加强支持治疗,如输血、补液及增强免疫力等支持,治疗各种可能的感染并发症,预防巨细胞病毒的感染。2例患者诊断明确后均予丙种球蛋白10 g静点6 d,经积极对症治疗后,病情明显缓解,1例患者因个人原因拒绝丙球等再障的特效治疗,最终合并多重感染死亡。大剂量免疫球蛋白(HDIVIG)是近10年来治疗AA的有效疗法之一,其可能机制[23]包括:①清除侵入骨髓干细胞及微环境中并造成干细胞生长抑制的有关病毒;②通过免疫介导机制杀伤某些抑制干细胞生长的淋巴细胞克隆;③与干扰素等一类淋巴因子结合,以去除其对干细胞的抑制作用。王慧歌[24]用康力龙联合大剂量丙种球蛋白、环孢霉素A治疗慢性再生障碍性贫血32例,大剂量静脉丙种球蛋白0.4 g/(kg·d),5 d,静脉输注,每月1个疗程,重复2~3个疗程。其疗效明显高于单用康力龙组(P<0.05),骨髓增生度及外周血网织红细胞的恢复也优于单用康力龙组。
HAAA无明显前驱症状和特殊的临床表现,且常发生在肝炎的恢复期,故不易早期发现,且易漏诊,因此对住院时间长、黄疸持续不退的肝炎患者,特别是肝炎病毒原因未明的年轻男性患者,需密切观察一般生命体征,监测血常规,一旦出现白细胞及血小板计数的下降,需进一步行骨髓穿刺,及早发现HAAA,最大程度降低该病死亡率。
[1]Lu J,Basu A,Melenhorst JJ,et al.Analysis of T-cell repertoire in hepatitis-associated aplastic anemia[J].Blood,2004,103(12):4588-4593.
[2]Farahmand F,Falahi GH,Shahraki T,et al.Mina Izadiar GAR:hepatitis-associated aplastic anemia[J].Govaresh,2005,10:54-58.
[3]Wang CF,Liu GW,Ji AY.Acute hepatitis e virus induced severe aplastic anemia [J]. Chinese GeneralPractice, 2010, 13(11C):3819.王春芳,刘光伟,冀爱英.急性戊型肝炎合并EB病毒感诱发重度再生障碍性贫血一例[J].中国全科医学,2010,13(11C):3819.
[4]Hagler L,Pastore RA,Bergin JJ,et al.Aplastic anemia following viral hepatitis:report of two fatal cases and literature review[J].Medicine(Baltimore),1975,54(2):139-164.
[5]Farahmand F,Falahi GH,Shahraki T,et al.Hepatitis-associated aplastic anemia[J].Govaresh,2012,10(1):54-58.
[6]Pol S,Driss F,Devergie A,et al.Is hepatitis C virus involved in hepatitis-associated aplastic anemia?[J].Ann Intern Med,1990,113(6):435-437.
[7]Crespo J,de las Heras B,Rivero M,et al.Hepatitis G virus infection as a possible causative agent of community-acquired hepatitis and associated aplastic anaemia [J].Postgrad Med J,1999,75(881):159-160.
[8]Gonzalez-Casas R,Garcia-Buey L,Jones EA,et al.Systematic review:hepatitis-associated aplastic anaemia-a syndrome associated with abnormal immunological function[J].Aliment Pharmacol Ther,2009,30(5):436-443.
[9]Perrillo RP,Pohl DA,Roodman ST,et al.Acute non-A,non-B hepatitis with serum sickness-like syndrome and aplastic anemia[J].JAMA,1981,245(5):494-496.
[10]Lu J,Basu A,Melenhorst JJ,et al.Analysis of T-cell repertoire in hepatitis-associated aplastic anemia[J].Blood,2004,103(12):4588-4593.
[11]Bai R,Liu WL.Virus infection and aplastic anemia[J].Journal of Clinical Hematology,1999,12(3):141-144.白融,刘文励.病毒感染与再生障碍性贫血[J].临床血液学杂志,1999,12(3):141-144.
[12]Gonzalez-Casas R,Garcia-Buey L,Jones EA,et al.Systematic review:hepatitis-associated aplastic anaemia-a syndrome associated with abnormal immunological function [J].Aliment Pharmacol Ther,2009,30(5):436-443.
[13]Lin GW,Lin PD,Yang ZW,et al.Clinical epidemiologic study on the relationship between viral hepatitis and aplastic anemia[J].Chin J Hematol,1994,15(4):171-173.林果为,林佩娣,杨子文,等.病毒性肝炎和再生障碍性贫血发病关系的临床流行病学研究[J].中华血液学杂志,1994,15(4):171-173.
[14]Tu MF,Shao ZH,Liu H,et al.The clinical features of hepatitis associated aplastic anemia [J].Chin J Hematol,2005,26(4):239-242.涂梅峰,邵宗鸿,刘鸿,等.肝炎相关再生障碍性贫血的临床特征[J].中华血液学杂志,2005,26(4):239-242.
[15]Zhang Y,Ma XJ,Wang QW,et al.The role of cytokine network in aplastic anemia[J].J Appl Clin Pediatr,2005,20(9):888-889.张岩,马小建,汪奇伟,等.细胞因子网络在再生障碍性贫血发病中的作用[J].实用儿科临床杂志,2005,20(9):888-889.
[16]Dilloo D,Vöhringer R,Josting A,et al.Bone marrow fibroblasts from children with aplastic anemia exhibit reduced interleukin-6 production in response to cytokines and viral challenge[J].Pediatr Res,1995,38(5):716-721.
[17]Brown KE,Tisdale J,Barrett AJ,et al.Hepatitis-associated aplastic anemia[J].N Engl J Med,1997,336(15):1059-1064.
[18]Binder D,van den Broek MF,Kägi D,et al.Aplastic anemia rescued by exhaustion of cytokine-secreting CD8+T cells in persistent infection with lymphocytic choriomeningitis virus[J].J Exp Med,1998,187(11):1903-1920.
[19]Maciejewski JP,Selleri C,Sato T,et al.Increased expression of Fas antigen on bone marrow CD34+cells of patients with aplastic anemia[J].Br J Haematol,1995,91(1):245-252.
[20]Meng GP,Zhang CJ.Viral hepatitis with aplastic anemia:a case[J].Modern Medicine& Health,2011,27(10):1540-1541.孟广萍,张成吉.病毒性肝炎伴再生障碍性贫血1例分析[J].现代医药卫生,2011,27(10):1540-1541.
[21]Jiao JZ,Zhou XP,Wang XL,et al.Acute aplastic anemia caused by EB viral:a case[J].Med J NDFNC,2005,26(6):409.焦建中,周小平,王秀丽,等.EB病毒性肝炎并急性再生障碍性贫血1例[J].西北国防医学杂志,2005,26(6):409.
[22]Zhang FK.Standardization diagnosis and treatment of aplastic anemia[J].Chinese Journal of Practical Internal Medicine,2007,27(14):1100-1104.张凤奎.再生障碍性贫血的规范化诊治[J].中国实用内科杂志,2007,27(14):1100-1104.
[23]He GS,Shao ZH,Zhang YZ,et al.Sequential intensified immuno-suppressive therapy combining with hematopoietic growth factors in the treatment of severe aplastic anemia [J].Chin J Hematol,2001,22(4):177-181.何广胜,邵宗鸿,张益枝,等.序贯强化免疫抑制并用造血生长因子治疗重型再生障碍性贫血[J].中华血液学杂志,2001,22(4):177-181.
[24]Wang HG.Curative effect on chronic aplastic anemia by combination of companison and large dose of gammaglobulin& cyclosporin A[J].Journal of Medical Forum,2006,27(21):14-15.王慧歌.康力龙丙种球蛋白环孢霉素A治疗慢性再障贫血[J].医药论坛杂志,2006,27(21):14-15.
