PATHFAST检测系统检测高敏感心肌肌钙蛋白I的分析性能评价
2013-09-11唐红霞贾克刚韩雪晶尚子轶
唐红霞,贾克刚,韩雪晶,何 聪,尚子轶,甄 利
(天津医科大学泰达国际心血管病医院检验科,天津 300457)
急性心肌梗死(AMI)目前已成为最常见的心脏疾病。高敏心肌肌钙蛋白是目前反映心肌损伤最敏感和最特异的生物学标志物,广泛用于AMI的早期诊治[1]。即时检验(POCT)平台PATHFAST全自动化学发光酶免疫分析仪(简称PATHFAST)检测高敏心肌肌钙蛋白I(hs-cTnI)因其快速和简便易用而成为常用方法。该仪器使用了高灵敏度的化学发光酶免疫方法,以CDP-Star/Sapphire-Ⅱ为化学发光底物,采用磁珠分离纯化技术。这样未结合到磁珠上的非被检物可以在一次性吸液管内通过少量的缓冲液冲洗而被分离剔除来实现快速检测。我们依据ISO15189《医学实验室质量和能力认可》的要求[2],参考美国临床和实验室标准化协会(CLSI)发布的 EP17-A、EP5-A2、EP6-A文件[3-5]、美国临床实验室标准化委员会(NCCLS)C28-A2 文 件[6]和 传 统 方 法[7-8],对PATHFAST进行了分析性能验证。
材料和方法
一、对象
1.hs-cTnI低值样品组 收集无心血管、肺、肾、肝、胆、胰等器质性疾病;心电图检查均正常;均无急性炎症;半年内均无输血和大手术史;血清肌酐和血脂正常;随访半年内均无心血管事件发生的健康人群100名的血浆,年龄18~85岁,其中男65名,女35名,检测10次取均值定值。
2.hs-cTnI高值样品组 收集泰达国际心血管病医院2011年9月至2012年3月急诊和心血管疾病重症监护病房(CCU)住院AMI患者共100例的血浆,检测10次取均值定值。AMI患者确诊依据欧洲心脏病学会(ESC)、美国心脏病学会(ACC)、美国心脏协会(AHA)和世界心脏联盟(WHF)2007年心肌梗死的诊断标准[9]。
二、方法
1.样品采集 所有样品采集后1 h内分离血浆,-80℃保存,仅冻融1次。
2.仪器和试剂 PATHFAST及原装配套hs-cTnI试剂盒(批号 E032)、cTnI校准品(批号E032)由日本三菱化学(Mitsubishi Kagaku Iatron)公司生产。
3.功能灵敏度(FS)评估 收集AMI患者的hs-cTnI高值血浆样品(cTnI浓度约1.0 ng/mL)3 mL,健康人hs-cTnI低值新鲜混合血浆40 mL。以1∶9的比例将高值样品稀释至0.10 ng/mL,共30 mL原液。检测原液3次取均值,用原液配制出最终理论浓度(由高到低)分别为 0.10、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02、0.01 ng/mL。将上述系列浓度血浆各分装10套,-80℃冷冻保存至分析。每天检测1套系列浓度血浆,由同一名操作熟练的工作人员连续检测10 d,计算天间变异系数(CV),以hs-cTnI系列浓度为横坐标、CV为纵坐标作图,求取CV=10%时的 hs-cTnI浓度值,设为该方法的 FS[8]。
4.精密度评估 参照CLSI EP5-A2文件评估精密度。用健康人hs-cTnI低值新鲜混合血浆稀释hs-cTnI高值样品,配制浓度分别为0.025 ng/mL(L)、0.65 ng/mL(M)和2.65 ng/mL(H)的样品,各分装10套,-80℃冷冻保存至分析。1 d内由1名操作熟练的工作人员连续检测20次,评估批内不精密度(CV)。每天取出L、M、H各1套,早晚各检测1次,由同一名操作熟练的工作人员连续检测10 d,评估批间不精密度。分别计算批内、批间检测值的均值()、标准差(s)及CV。
5.空白限(LoB)评估 参照CLSI EP17-A文件确定LoB。每天上、下午各测定一批空白样品(S0或样品稀释液),每批重复测定3次,由同一名操作熟练的工作人员连续10 d,共获得60个测量结果。因仪器直接报告的是浓度值,hs-cTnI在低浓度时往往不呈正态分布,故采用非参数方法估计第95百分位数,即将数据由小到大排列,第95百分位数所在位置为空白样品总数×(95/100)+0.5。
6.检出限(LoD)评估 参照CLSI EP17-A文件确定 LoD。用样品稀释液对 cTnI浓度为0.1 ng/mL的新鲜血浆做系列稀释,配制成一系列低浓度样品,其理论浓度分别为0.002、0.004、0.006、0.008、0.010、0.020、0.030、0.040 ng/mL,介于预期检测限浓度的1~4倍。系列低浓度样品每天上、下午各检测1次,由同一名操作熟练的工作人员连续检测5 d,共获得80个测量结果。因低浓度检测数值常呈非正态分布,故采用非参数方法确定 LoD。LoD=LoB+DS·β,式中 DS·β是低浓度样品测定中位数和第5个百分位数的间距,中位数=检测样品总数×0.5+0.5,第5百分位数的值=检测样品总数×0.05+0.5。
7.定量检测限(LoQ)评估 参照CLSI EP17-A文件,依据临床要求和室间质量评价的允许误差,设定本实验室hs-cTnI的总误差目标,在不考虑分析偏差的条件下,总误差=2CV,如果低浓度样品的CV≤1/2总误差,则LoQ=LoD。
8.传统方法评估检测低限(LLD)LLD为样品单次检测可以达到的检测相应量对应的分析物量。按照国际纯粹和应用化学联合会的规定,在测量置信水平为99.7%时,方法的LLD由公式LLD=S0+3s空白计算,式中s空白为10次空白测定的s。
9.传统方法评估生物检测限(BLD) 在测量置信水平为99.7%且低浓度样品的检测相应量都比空白检测相应量大时,样品中所具有的分析物浓度即为BLD。在系列低浓度实验样品中,某浓度的测定值均值减去3倍该样品浓度值的s,刚大于LLD值时对应的浓度即为BLD。
10.线性范围评估 参照CLSI EP6-A文件中对线性评价实验的要求,取高浓度值cTnI样品和正常人血浆样品各1 份,按照1∶3、2∶2、3∶1 的比例混合,分别编号,随机排列重复测定2次,计算平均值作为最终的测定值,与设定值做线性对比。
11.生物参考区间验证 按NCCLS C28-A2推荐方法,选择健康参考个体20名,采集符合要求的样品,按仪器标准操作程序(SOP)要求进行规范检测并对检测结果进行逐一验证是否落在现用参考区间内。
三、统计学方法
结 果
一、FS评估

表1 hs-cTnI低浓度样品测定结果及CV

图1 hs-cTnI检测浓度与CV的关系
二、精密度评估
高、中、低3个浓度混合血浆批内、批间检测不精密度结果见表2。高值样品(2.65 ng/mL)批内CV和批间CV分别为4.70%、5.05%,中值样品(0.65 ng/mL)批内 CV和批间 CV分别为5.16%、5.23%。将低值样品浓度配制到接近厂商声明的第99百分位值(0.02 ng/mL),其批内和批间 CV 分别为5.30%、6.07%。

表2 hs-cTnI方法批内、批间检测不精密度
三、LoB、LoD、LoQ、LLD、BLD 结果
1.LoB 空白样品的检测结果呈非正态分布,故用非参数程序估计LoB,即估计第95分位数的值,LoB=[Nβ(ρ/100)+0.5]=[60 ×(95/100)+0.5]=57.5位置的结果,即第57和第58个观察值的均数。将60个空白检测值由小到大排序,第57和第58位置均为0.001 ng/mL,故LoB=0.001 ng/mL。见表 3。
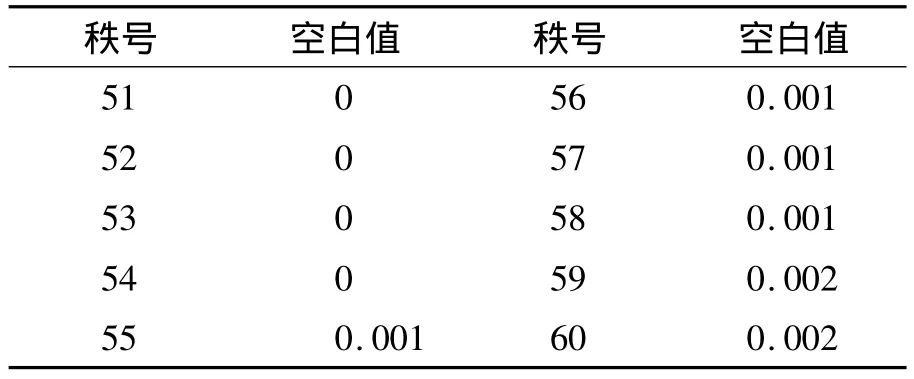
表3 60个空白值中最高的10个值 (ng/mL)
2.LoD 系列低浓度样品测定结果见表4。80个低浓度样品检测结果呈非正态分布,使用非参数程序估计 LoD,即:LoD=LoB+DS·β,式中DS·β是低浓度样品测定中位数和第5个百分位数的间距,低浓度样品中位数=(80×0.5+0.5)=40.5,中位数值为0.009,第5个百分位数的值 =(80× 0.05+0.5)=4.5,第 4.5 秩号的值为0.002,DS·β=0.009 - 0.002=0.007,故 LoD=LoB+DS·β=0.007+0.001=0.008 ng/mL。
3.LoQ 本实验室依据临床需求及权威机构规定的分析质量要求,设定化学发光免疫法检测cTnI的总误差目标为10%,在不考虑分析偏差的情况下,允许总误差(TEa)=2CV,即 CV=1/2TEa。hs-cTnI在0.008 ng/mL时检测的日间CV为9.34%,<10%,符合质量目标要求。因此LoQ=LoD=0.008 ng/mL。见表5。
5.BLD 0.004 ng/mL实验样品的浓度减3s后为0.0029 ng/mL,刚高于 LLD对应的浓度0.001 ng/mL,故 PATHFAST 检测 hs-cTnI的生物检测限为 0.002 ~0.004 ng/mL。见表 6。

表4 系列低浓度cTnI样品测定结果 (ng/mL)
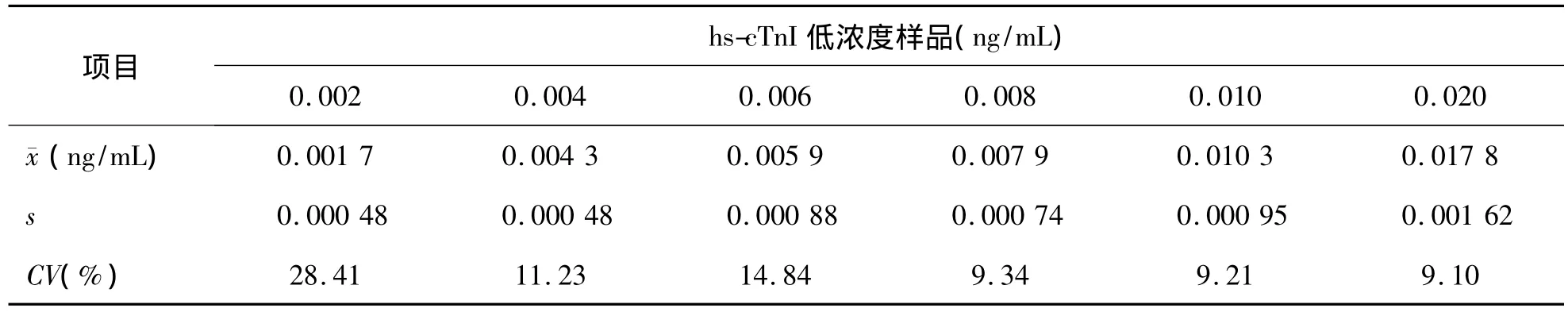
表5 hs-cTnI低浓度样品的日间CV
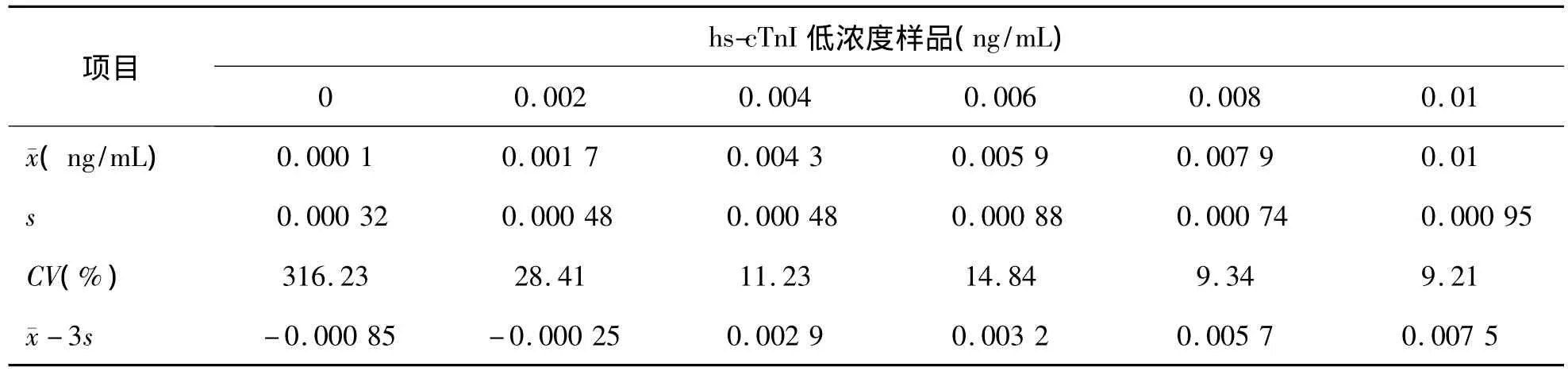
表6 hs-cTnI低浓度样品测定结果及BLD
四、线性范围
将平均值作为最终的测定值,与设定值做线性对比,线性方程为 Y=1.015X+0.152,R2=0.993。各测定样品浓度见表7,线性曲线见图2。

表7 线性范围各浓度cTnI样品的测定值(ng/mL)
五、生物参考区间的验证
按NCCLS C28-A2推荐方法,验证现用厂家提供的生物参考区间。结果显示95%的健康个体(19名)的检测结果落在现用参考区间内,不超过5%(1名)健康个体的检测结果落在现用参考区间外,说明厂家提供的生物参考区间有效,适合本实验室。各健康个体样品浓度详见表8。
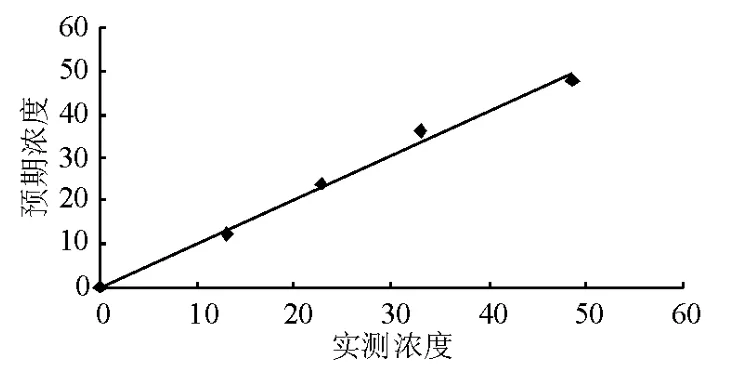
图2 PATHFAST检测hs-cTnI的线性图

表8 20名健康参考个体hs-cTnI检测浓度值
讨 论
心肌肌钙蛋白I(cTnI)是心肌损伤的特异性标志物。cTnI检测方法的分析性能对准确检测和评估cTnI水平及临床诊断心肌损伤至关重要[1]。POCT平台PATHFAST主要用于床边快速定量检测hs-cTnI。在使用前对仪器的主要性能进行验证,是保证检验质量的一个重要措施,这也是实验室认可的要求。因此本研究对PATHFAST检测hs-cTnI的分析性能进行了评价。
本研究结果显示高值样品(2.65 ng/mL)批内CV和批间CV分别为4.70%、5.05%,中值样品(0.65 ng/mL)批内 CV和批间 CV分别为5.16%、5.23%,低值样品 (0.025 ng/mL)批内CV和批间CV分别为5.30%、6.07%。Francesca等[10]依据CLSI EP5-A方案检测40个样品得出PATHFAST检测 hs-cTnI样品浓度为3.1 ng/mL时的批内CV和批间CV分别为5.10%、6.0%,样品浓度为0.66 ng/mL时的批内CV和批间CV分别为5.80%、6.30%,其两浓度水平的批内、批间不精密度与本研究结果较为相似。而厂商提供的高值样品(2.22 ng/mL)的批内CV和批间CV分别为2.8%、3.1%,低值样品(0.09 ng/mL)的批内CV和批间CV分别为3.7%、3.9%。本研究结果高于厂商说明书所提供的CV值,这与本研究纳入样品例数较少有一定关系,也可能是POCT分析仪本身检测的加样随机性大、试剂均一性差等导致的重复性差[11]所致。
文献[12]报道,只有当检测CV<生物学变异1/2时才具有相应的临床意义。根据文献[8]对促甲状腺素FS的评价,其是检测系统或方法可定量报告分析物的具有临床意义的最低浓度。心肌肌钙蛋白(cTn)也引人了FS的概念,参照其他心脏标志物将CV≤10% 时浓度的最低检测限值作为cTn的FS[13],并采用了更符合临床实际检测状况的以批间不精密度为基础的评价FS的方法,对hs-cTnI的FS进行了评估。FS代表的是一个定量的可报告低限。这个值一般要比检测低限高,区分从有到无的分析能力,由于其反映了实际检测中的灵敏度,所以更有临床价值[7]。本研究结果显示CV=10%的最低浓度值为0.0198 ng/mL(见图1),与厂商说明书提供的0.02 ng/mL基本相符,与Francesca等[9]检测系列低浓度样品得出PATHFAST检测 hs-cTnI的 FS为0.02 ng/mL也基本一致。蔡迪娅等[14]对 ADVIA Centaur检测系统检测hs-cTnI的FS进行研究得出其FS为0.042 ng/mL,结果显示 PATHFAST检测 hs-cTnI的FS低于ADVIA Centaur检测系统的FS。
本研究参照 CLSI EP17-A文件确定的LoB、LoD 及 LoQ 分别为 0.001、0.008、0.008 ng/mL。参照温冬梅等[7]用CLSI EP17-A文件建立的AFP的LoB、LoD、LoQ并对其数据作出的解释,本研究结果显示PATHFAST在符合质量要求的情况下能可靠地检出hs-cTnI的最低实际浓度为0.008 ng/mL。本研究用PATHFAST检测hs-cTnI报告时,若hs-cTnI结果低于0.001 ng/mL,则应报告“分析物未检出,浓度 <0.001 ng/mL”;若 hscTnI检测结果 >0.001 ng/mL 且 <0.008 ng/mL,则应报告“有分析物检出,但不能准确定量,浓度<0.008 ng/mL”;若 hs-cTnI>0.008 ng/mL,则直接报告检测结果。临床医生可放心使用浓度高于0.008 ng/mL的hs-cTnI结果。而厂商说明书只提供了一个笼统的检测限0.02 ng/mL,对报告临床结果不够详细。而 Francesca等[9]依据 CLSI EP-17A文件得出PATHFAST检测hs-cTnI的LoB和 LoD 分别为0.0048和0.0066 ng/mL,两者有一定的出入,这可能是在低浓度样品浓度的选择上不同所造成的。
本研究参照常规方法[7-8]确定的 LLD为0.001 ng/mL,BLD 为 0.002 ~ 0.004 ng/mL。国内外未见有PATHFAST的相关报道。常规方法使用光强度值(RLUs)来计算,但目前实验室部份仪器存在局限性,即只能报告分析物的浓度,而没有原始的分析信号。所以常规方法不适用于实验室对所有仪器的灵敏度进行评价。本研究评估的PATHFAST无法读出光强度值(RLUs),参照文献[15]用浓度直接计算得出的LLD与LoB数值一致,而BLD<LoD。参照CLSI EP17-A文件确定的LoB、LoD和LoQ是直接使用检测出的分析物浓度进行计算,符合实验室的实际情况,统计分析输入检测数据时简便易行。
由于厂商提供的PATHFAST检测上限为50 ng/mL,因此本研究评估线性范围时选取的高浓度值样品浓度为48 ng/mL,低值为正常人样品,按比例稀释重复测定后做线性回归分析得出预期浓度和实测浓度的线性方程为Y=1.015X+0.152,R2=0.993,与 Francesca 等[10]根据 EP6-A选取高值样品(42 ng/mL)按比例稀释得出的R2(0.995)基本一致。同时本研究按NCCLS C28-A2推荐的方法,验证了生物参考区间。结果显示,>95%的检测结果在现用参考区间以内,≤5%的检测结果在现用参考区间以外,判定厂家提供的生物参考区间(<0.02 ng/mL)适用于本实验室,可以继续使用。
本研究由于试剂成本过高,目前未对仪器的第99百分位值和样品检测阳性符合率进行研究,希望下一步能对第99百分位值及阳性符合率进行深入的探讨。
综上所述,参照CLSI EP系列文件及常规方法对PATHFAST检测系统检测cTnI分析性能进行了验证,其可为临床提供准确可靠的hs-cTnI结果,为心肌损伤的临床诊治提供重要信息。
[1]鄢盛恺.高敏感心肌肌钙蛋白检测的临床应用[J].中华检验医学杂志,2010,33(9):809-813.
[2]中国国家实验室国家认可委员会.医学实验室质量和能力认可的要求[S].ISO15189,中国国家实验室国家认可委员会,2007.
[3]National Committee for Clinical Laboratory Standards.Protocols for determination of limits of detection and limits of quantitation;approved guideline[S].EP17-A,NCCLS,2004.
[4]National Committee for Clinical Laboratory Standards.Evaluation of precision performance of quantitative measurement methods;approved guideline-second edition[S].EP5-A2,NCCLS,2004.
[5]National Committee for Clinical Laboratory Standards.Evaluation of the linearity of quantitative analytical method:a statistical approach:approved guideline[S].EP6-A,NCCLS,2003.
[6]National Committee for Clinical Laboratory Standards.How to define and determine reference intervalsin clinical laboratory;approved guideline-second edition[S].C28-A2,NCCLS,2000.
[7]温冬梅,张秀明,王伟佳,等.化学发光免疫法检测AFP的空白限、检出限和定量检测限的建立与评价[J].临床检验杂志,2010,28(6):469-471.
[8]杜彦丹,孙 刚,孙 辉,等.Roche E2010检测系统测定促甲状腺激素(TSH)分析灵敏度与功能灵敏度的验证[J].内蒙古医学杂志,2010,42(5):568-570.
[9]Gualandro DM,Caramelli B,Yu PC,et al.Perioperative myocardial infarction has been forgotten[J].J Am Coil Cardiol,2008,51(18):1825-1826.
[10]Di Serio F,Caputo M,Zaninotto M,et al.Evaluation of analytical performance of the Pathfast cardiac troponin I[J].Clin Chem Lab Med ,2009,47(7):829-833.
[11]从玉隆.POCT的临床应用与存在的问题[J].中华检验医学杂志,2007,30(12):1325-1328.
[12]Sadler WA,Murray LM,Turner JG.What dose"functional sensitivity"mean[J].Clin Chem,1996,42(12):2051-2052.
[13]宋凌燕,吴 炯,宋斌斌,等.高敏感方法检测心肌肌钙蛋白T的分析性能评价[J].中华检验医学杂志,2010,33(9):814-818.
[14]蔡迪娅,邱晓明,苏月梅,等.ADVIA Centaur超敏肌钙蛋白I测试法的性能分析及临床应用评价[J].天津医药,2011,39(12):1160-1161.
[15]田秀俊.参照EP方案在不同检测系统评价尿微量白蛋白试剂的分析性能[J].医学检验与临床,2010,21(1):17-19.
[16]La'ulu SL,Roberts WL.Performance characteristics of five cardiac troponin I assays[J].Clin Chim Acta,2010,411(15-16):1095-1101.
[17]Panteghini M,Pagani F,Yeo KT,et al.Evaluation of imprecision for cardiac troponin assays at low-range concentrations[J].Clin Chem,2004,50(2):327-332.
[18]Casals G,Filella X,Augé JM,et al.Impact of ultrasensitive cardiac troponin I dynamic changes in the new universal definition of myocardial infarction[J].Am J Clin Pathol,2008,130(6):964-968.
