加工番茄病毒病田间发生情况及毒原的分子检测
2013-09-11都业娟石宝萍李成亮向本春
都业娟, 石宝萍, 李成亮, 向本春
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室,石河子 832003)
新疆是我国最大的加工番茄种植和加工基地,占全国生产能力的90% 以上。近年来,新疆石河子、玛纳斯、奎屯、博乐等地每年6-8月加工番茄病毒病害发生普遍,田间症状复杂,部分地块发病率高达100%,严重影响番茄的产量和质量,甚至造成全田绝产。2003年农五师八十四团种植加工番茄404hm2,100%的植株都感染了病毒,其中绝产面积达到40.3hm2[1]。
番茄病毒病田间症状主要表现为花叶、线叶和坏死条斑症状,尤以坏死条斑的危害最大。研究表明,烟草花叶病毒(Tobacco mosaic virus,TMV)、马铃薯X 病毒(Potato virus X,PVX)、马铃薯 Y病毒(Potato virus YPVY 番茄花叶病毒(Tomato mosaic virus,ToMV)黄瓜花叶病毒(Cucumber mosaic virus,CMV)以及CMV 与Tobamovirus复合侵染为引起番茄病毒病的主要病原[2-3]。姜玉霞明确新疆加工番茄花叶症状主要由ToMV引起[4];常波研究表明TMV与CMV复合侵染可引起加工番茄表现坏死条斑症状[5];许文博通过血清学方法证明 ToMV、CMV 和蚕豆萎蔫病毒(Broad bean wilt virus,BBWV)复合侵染可能是造成田间坏死条斑病的主要因素[6]。
本研究针对加工番茄病毒病进行研究,明确3种病害症状的田间发生特点;针对危害最重的坏死条斑病,通过对主栽品种‘里格87-5’进行不同播期发病情况的调查及新疆15个主要加工番茄品种发病情况的比较,明确播期与该病害的关系及品种间发病的差异;同时通过分子检测查明其田间毒原的复合侵染情况,从而为该病害的防治提供依据。
1 材料与方法
1.1 材料
1.1.1 供试加工番茄品种
‘新番4’、‘新番9’、‘石番3’、‘石番4’、‘石番8’、‘石番9’、‘石番98-1’、‘石番15’、‘石番18’、‘石番20B’、‘AS9081’、‘美国世纪红’、‘里格87-5’、‘屯河34’和‘Q027’共15个品种。
1.1.2 用于PCR扩增的引物及酶
TMV、ToMV、CMV、PVY、BBWV检测引物分别为 TA/TB、ToA/ToB、CMV1/CMV2、PVY-1/PVY-2和Fab5_1F/Fab5_1R,引物序列见表1;5种病毒质粒由本实验室保存。AMV逆转酶、Taq酶及其他PCR相关试剂均购自TaKaRa公司。
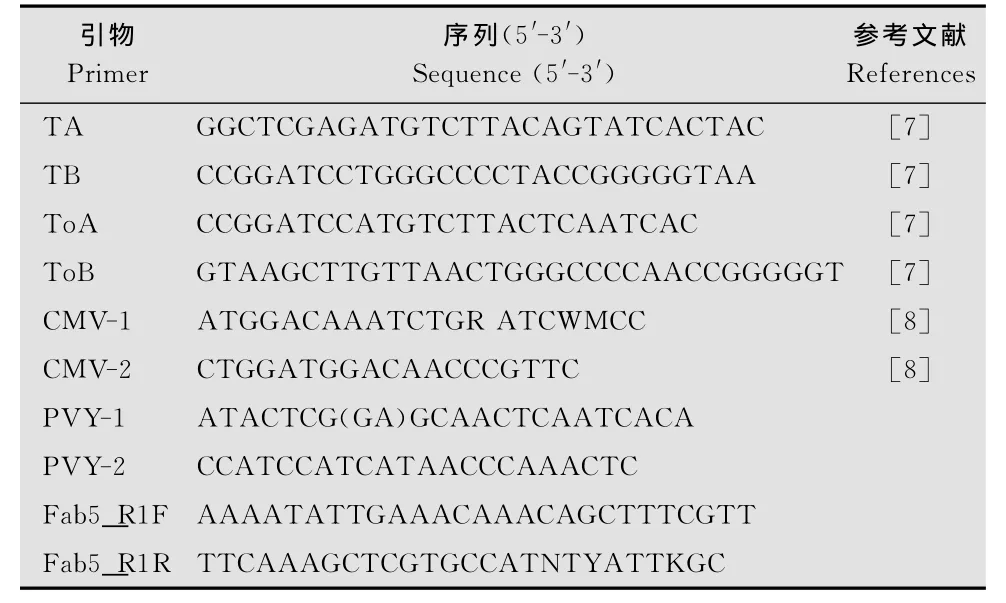
表1 用于PCR检测的引物序列Table 1 Sequences of the primers used for PCR
1.2 方法
1.2.1 田间种植方法
播期试验:石河子大学农学院试验站内,分别于2007、2008、2009年4月5日(早播期)、4月25日(适播期)和5月20日(晚播期)三个时间,分期播种‘里格87-5’,每个播期分别播种4膜8行,约200株。
品种试验:石河子大学农学院试验站内,于2009年5月20日,分别播种15个番茄品种,每品种播种2膜4行,约100株,共设3个重复。
1.2.2 病害调查方法
不同播期发病情况调查:分别于2007、2008、2009年7月28日、8月2日、7日、12日和17日对3个播期所有番茄株调查坏死条斑病的发病率及病情指数,取3年平均值进行分析,并对病情指数调查数据用Duncan新复极差法进行差异显著性分析。
不同品种发病情况调查:分别于2009年7月28日、8月2日、7日、12日、17日调查所种植的15个品种番茄坏死条斑病的发病率及病情指数,取3个重复的平均值进行比较,并对8月17日3个重复的病情指数用Duncan新复极差法进行差异显著性分析。
病情指数调查依据病害严重程度分为5级,分级标准如下。
0级:无症状;Ⅰ级:叶片和茎秆上有不太明显的坏死小斑点;Ⅱ级:叶片和茎秆上的黑色(或褐色)的坏死斑点连成小片;Ⅲ级:植株茎秆病斑连成片,近2/3面积坏死干枯;Ⅳ级:植株顶端坏死(生长点坏死),全株干枯坏死。
发病率和病情指数计算公式如下:

1.2.3 田间病原分子检测样品的采集
于2009、2010、2011、2012年8月5-7日在石河子蔬菜研究所、石河子大学试验站、石河子大学试验场、北泉镇、花园镇分别采集表现病毒病症状(坏死条斑症状为主)的病株,每点采集20株,每年100株,4年共检测400株。
1.2.4 TMVToMVCMVPVYBBWV 5种病毒cDNA合成及PCR反应体系与条件
cDNA合成:5×第一链合成缓冲液4μL,10mmol/L dNTP1μL,RNase Inhibitor (40U/μL)1μL,AMV反转录酶(200U/μL)1μL,随机引物R9(50μmol/L)1μL,植物总 RNA1μL,DEPC水补足20μL,混匀后25℃放置10min,然后于37℃保温1h;70℃保温15min,以使酶失活。
PCR反应:10×PCR Buffer 2.5μL,dNTP(2.5mmol/L)1.0μL,上游引物1.0μL,下游引物1μL,Taq DNA 聚合酶 (2U/μL)0.5μL,cDNA模板2.0μL,加 ddH2O 至25.0μL。预变性温度94℃,4min;变性温度94℃,30s,退火温度50℃,30s,延伸温度72℃,1min,5个循环;变性温度94℃,30s,退火温度55℃,30s,延伸温度72℃,1min 30个循环,最后72℃延伸10min。
2 结果分析
2.1 加工番茄病毒病发生情况
2.1.1 加工番茄病毒病症状调查
通过2007-2012年6年的调查发现,新疆加工番茄病毒病可表现花叶、线叶和条斑3种症状。
6月初开始出现花叶症状,田间发病率为5%~8%,仅表现花叶症状的植株后期产量和品质受影响较小。
7月上旬开始出现线叶症状,发病率为3%~5%发病后植株上部不再结果,早期果实可正常成熟。
7月25日-8月1日条斑症状开始出现,至8月上旬病情迅速发展,早期上部叶片轻微黄化,叶脉坏死并逐渐扩展成褐色坏死斑;后期番茄植株顶端坏死;沿茎表形成不规则褐色长条斑,逐渐扩大,导致植株枯死;褐色条斑可危害果柄,果实明显畸形,表皮散布不规则坏死斑,果实内部组织坏死,幼果、成熟果均可发病。该症状发病晚但病情扩展迅速,重病田发病率高达100%,并可造成全田绝产。
2.1.2 不同播期加工番茄坏死条斑病发病情况
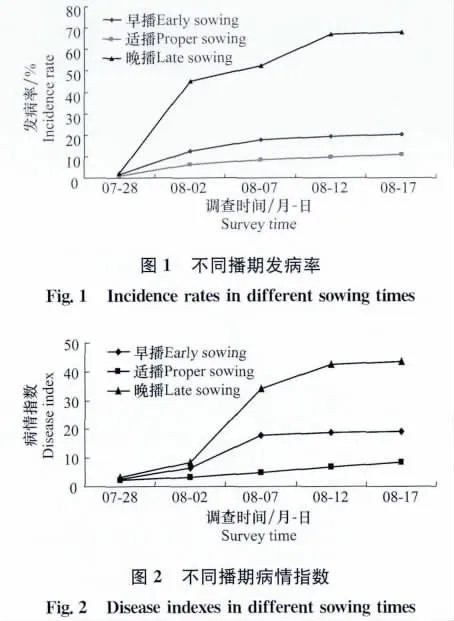
分别对2007、2008、2009年早播期、适播期和晚播期的加工番茄进行发病率及病情指数的调查,结果显示:发病率和病情指数均表现为晚播>早播>适播,晚播明显有利于条斑病的发生,表现为发病率高,植株受害严重,其发病率及病情指数分别达到67.94%和43.47。3个播期中适播期番茄发病率最低,植株受害最轻,发病率和病情指数分别为11.00%和8.46。且3个播期番茄均表现为7月28日至8月2日发病率迅速增高,8月2日至7日病情指数迅速增高,之后表现为逐渐增高(表2、图1、图2)。对5次调查的病情指数进行差异显著性分析,显示在0.05水平上,从8月7日开始,早播、适播、晚播之间存在显著性差异。

表2 不同播期加工番茄坏死条斑病田间发生情况Table 2 Survey of necrotic stripe disease on processing tomato in different sowing times
2.1.3 不同品种加工番茄坏死条斑病发病情况
采用1.2.2不同品种发病情况调查方法,对15个品种加工番茄的发病率及病情指数进行调查比较,结果显示:加工番茄坏死条斑病自2009年7月28日开始出现,至8月2日,所有品种的发病率均高于50%,之后各品种发病率呈现随时间逐渐升高,至8月17日,发病率高达75.21%~82.33%;病情指数的调查显示,7月28日15个品种的病情指数为2.19~4.71,至8月7日则高达39.48~55.71,之后病情指数呈现逐渐升高趋势(表3、图3、图4)。
对8月17日各品种的病情指数进行差异显著性分析,结果表明在0.05水平,‘里格87-5’、‘石番15’、‘屯河34’、‘石番18’与‘石番20B’、‘石番8’、‘石番4’、‘新番9’、‘新番4’、‘Q027’、‘石番3’存在显著性差异;‘美国世纪红’、‘AS9081’与‘石番4’、‘新番9’、‘新番4’、‘Q027’、‘石番3’存在显著性差异;‘石番98-1’、‘石番9’与‘新番9’、‘新番4’、‘Q027’、‘石番3’存在显著性差异。15个品种中,‘里格87-5’、‘石番15’、‘屯河34’、‘石番18’田间发病较重;‘新番9’、‘新番4’、‘Q027’、‘石番3’田间发病相对较轻。
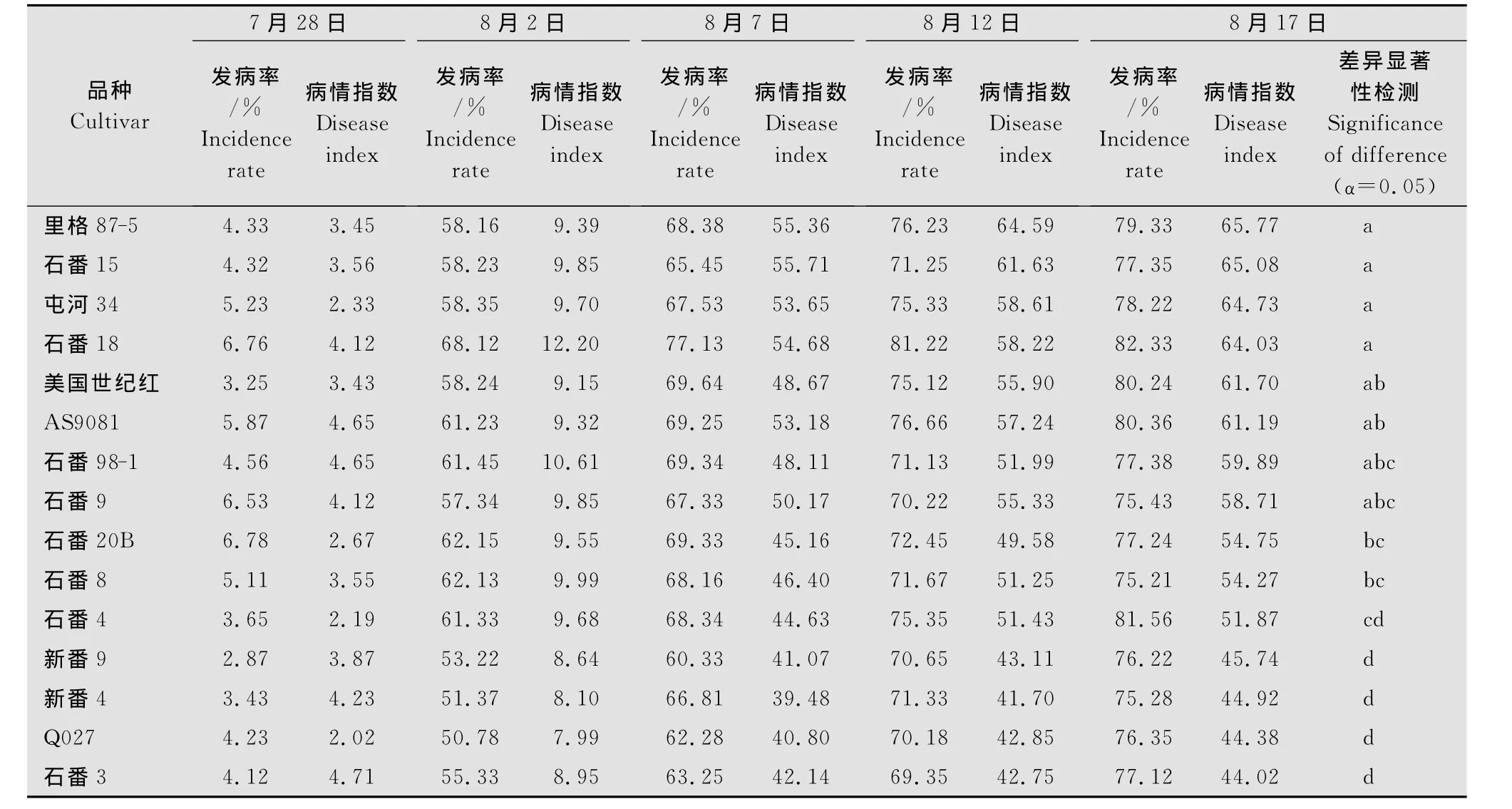
表3 加工番茄不同品种坏死条斑病田间发生情况Table 3 Survey of necrotic stripe disease on processing tomato of different cultivars

图3 不同调查时间各品种发病率Fig.3 Incidence rate of each cultivar in different survey times
2.2 加工番茄病毒病田间病原的分子检测
利用 TMV、ToMV、CMV、PVY、BBWV 5种病毒的特异性引物,参照1.2.4方法,建立其有效检测体系(图5)。利用该体系对供试田间样品进行检测,结果表明:所有病株均可检测到病毒,其中TMV的侵染率为2.50%,ToMV的侵染率为88.75%,CMV的侵染率为71.25%PVY的侵染率为64.75%、BBWV的侵染率为52.50%。各病毒的单一侵染率及2种病毒的复合侵染率均较低,而以CMV、BBWV和PVY 3种病毒中的2种分别与ToMV复合侵染率最高,分别为28.25%、20.75%和15.25%。因此加工番茄病毒病田间主要由多种病毒复合侵染引起(图6)。
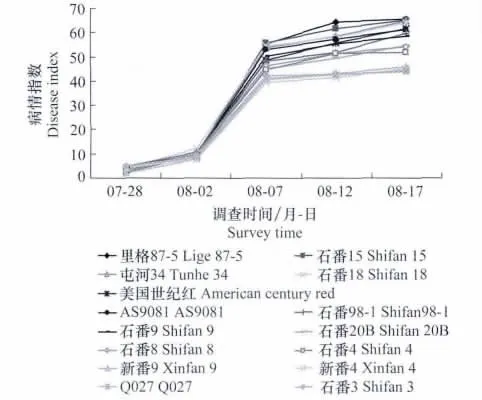
图4 不同调查时间各品种病情指数Fig.4 Disease index of each cultivar in different survey time

图5 加工番茄病毒病田间样品的分子检测Fig.5 Molecular detection of viruses on processing tomato in the field

图6 加工番茄田间病株毒原复合侵染情况Fig.6 The mixed infection of viruses on processing tomato in the field
3 结论与讨论
番茄病毒病在我国各地均有发生,其中尤以坏死条斑病毒病危害最大。新疆作为我国加工番茄主产区,该病害的发生极大地影响了番茄产业的发展。通过连续3年对加工番茄不同播期发病率及病情指数的调查,明确晚播十分有利于该病害的发生,而适期播种可有效减轻该病害发生。同时通过调查发现,不同年份该病害发生程度存在较大的差异,2009年病害发生较2007、2008年明显偏重。
对15个主要加工番茄品种在有利病害发生的晚播条件下进行发病情况调查,所有品种均可发病,至病害后期(8月17日),发病率高达75.21%~82.33%;病情指数调查分析显示‘里格87-5’、‘石番15’、‘屯河34’、‘石番18’4个品种田间发病较重;‘新番9’、‘新番4’、‘Q027’、‘石番3’四品种田间发病相对较轻。‘里格87-5’作为目前新疆加工番茄的主栽品种,对病毒病抗性较差,不利于该病害的有效控制。
通过对病样5种病毒的分子检测,表明侵染加工番茄的Tobamovirus病毒主要是ToMV,而不是TMV,这与周雪平的研究结果一致[7];同时加工番茄病毒病田间发病主要以病毒的复合侵染为主,尤其是ToMV与CMV、PVY、BBWV中任意2种病毒的组合,其侵染率远远高于单独侵染。ToMV可通过种子和田间机械摩擦传播,而CMV、PVY、BBWV田间主要通过蚜虫等昆虫介体进行传播。播期和品种试验均表明7月末至8月初为坏死条斑病发生的关键时期,发病率迅速上升,8月上旬则是该病害产生危害的重要时期,这是否是受到7月上、中旬石河子地区蚜虫迁飞的影响,病毒在潜伏期后集中暴发,有待进一步研究。
[1] 周永强,芦新友,陈国毅,等.加工番茄条斑型病毒病的发生与防治[J].新疆农垦科技,2004(4):33-34.
[2] 杨翠荣,田如燕,姜春晓,等.中国北方六省(市)侵染番茄的烟草花叶病毒株系鉴定[J].植物保护,1992,18(4):18-19.
[3] 陈绍宁,陈集双,吴鹏,等.引起番茄植株坏死病的病毒研究[J].植物病理学报,2007,37(4):377-382.
[4] 姜玉霞,向本春,安仙丽,等.新疆加工番茄上番茄花叶病毒的分子鉴定[J].新疆农业科学,2008,45(3):484-489.
[5] 常波,向本春,刘升学,等.新疆加工番茄条斑坏死病原黄瓜花叶病毒外壳蛋白基因的克隆和序列分析[J].石河子大学学报(自然科学版),2006,24(4):410-414.
[6] 许文博,黄家风,阮涛.石河子地区加工番茄坏死条斑病毒原的ELISA检测及品种抗病性鉴定[J].中国蔬菜,2009(10):41-45.
[7] 周雪平,薛朝阳,刘勇,等.番茄花叶病毒番茄分离物与烟草花叶病毒蚕豆分离物生物学、血清学比较及PCR特异性检测[J].植物病理学报,1997,27(1):53-58.
[8] 席德慧,林宏辉,向本春.黄瓜花叶病毒2个分离物的亚组鉴定及株系分化研究[J].植物病理学报,2006,36(3):232-237.
