辐射对脑海马神经元的影响及其作用机制研究*
2013-09-11刘青杰
高 玲 刘青杰*
人体脑中的海马区由于形状和海马相似,因此被称为海马体(Hippocampus)。海马体主管人类近期主要记忆,将其存入大脑皮层并转变为永久记忆。已知人类出生时,神经元的数量达到1000亿个左右,但从20岁开始逐年下降,到了40岁,神经细胞的数量开始以每天约1万个的速度递减,从而对记忆力、协调性及大脑功能造成影响。海马体在记忆和学习中的重要作用目前已得到了充分的认识,海马萎缩患者的记忆力明显下降,并且可患焦虑症。研究发现,阿尔茨海默病和癫痫与海马体病变有关。功能缺失研究表明,与出生时存在的海马神经元相比,成年小鼠后分化的海马神经元在学习和记忆中发挥作用。可见后分化的海马神经元细胞在维持海马功能中发挥重要作用[1]。
目前,已知辐射对认知可产生损害,进一步发现电离辐射引起的认知损害常表现为海马依赖的认知功能下降,而非海马依赖的认知功能损害不明显。Ferrer等[2]研究表明,大鼠受2 GyX射线单次照射可导致海马区细胞发生死亡。目前,越来越多的脑部放疗患者发生记忆力减退甚至痴呆。有研究表明,电离辐射可能通过诱导小胶质细胞产生炎性因子或引发血管内皮细胞老化等机制导致海马损伤[3-4]。然而,后分化的海马神经元细胞在辐射诱导海马损伤中的作用研究还未涉及,鉴于后分化的海马神经元细胞在海马认知中的重要作用,因此从神经元细胞的角度阐明辐射所致的脑海马损伤及其作用机制具有重要理论意义。
1 辐射对小鼠神经行为和学习记忆能力的影响
海马在多项行为功能及学习记忆中发挥重要作用,因此海马神经元受到损伤后势必会引起神经行为的变化。前期研究发现,妊娠小鼠宫内受到氚水照射后对仔鼠生长发育及反射行为产生影响,0.015 Gy及以上剂量组仔鼠体重、开眼及向亲性行为指标;0.05 Gy及以上剂量组张耳、出牙和感觉功能指标;0.10 Gy及以上剂量组旷场实验食物迷宫、水迷宫实验指标与对照组有明显差异。Y迷宫单向刺激回避反射试验以及条件反射试验结果表明,照射组阳性率和达标率显著低于正常对照组[5-6]。周湘艳等[7]同期研究结果表明,γ射线照射后生长抑素(somatostatin,SOM)含量升高。选择3个不同剂量氚水照射后检测雄性仔代小鼠脑垂体中SOM和下丘脑中精氨酸加压素(Arginine vasopressin,AVP)含量的影响,结果显示:24.09×104Bq/g体重氚水照射组与对照组相比其SOM含量略微增加但无统计学意义;其他2个剂量组则出现了非常显著的升高;AVP含量在144.54×104Bq/g体重氚水照射组与对照组比较显著降低,差异有统计学意义,其他2组亦呈现降低趋势,但无统计学意义[8]。进一步研究表明,照射组的脑体比与对照组相比较显著降低,且海马CA1、CA3及CA4区椎体细胞显著减少[9]。提示辐射可导致生理标志出现延缓,反射行为获得延迟,学习记忆能力下降。
2 辐射对脑海马神经元产生影响并致其细胞凋亡
研究发现,氚照射后海马神经元丢失正确联系、突触的形成减少、树突分支定向障碍、脑神经元树突数目及树突棘减少,这些可能与认知损伤有重要关系[10-11]。研究发现,体外培养13 d的海马神经元144.54×104Bq/g体重氚水照射与对照组比较形态学发生明显的变化(如图1所示)[5]。图1可见对照组神经元胞核和核仁清楚可见,表面光洁,边缘清晰,胞体晕光明显,折光性强并有分枝,形成明显的神经网络。48.18×104Bq/g体重氚水照射组及144.54×104Bq/g体重氚水照射组与对照组相比生长缓慢,细胞体较小,视野中细胞数较少,细胞轮廓不清,界限模糊,胞浆颗粒变多,折光性降低,出现空泡、肿胀、断裂及崩解,形成较稀疏的神经网络。进一步的研究发现,经氚照射过的小鼠海马神经元Ca2+电流显著降低,小鼠脑细胞出现凋亡现象并伴随p53蛋白的表达升高[10]。众多的研究发现,辐射可引起神经元前体细胞死亡,同时还可杀伤分裂后期的未成熟神经元。由此可见,辐射对脑海马产生确定性的影响。
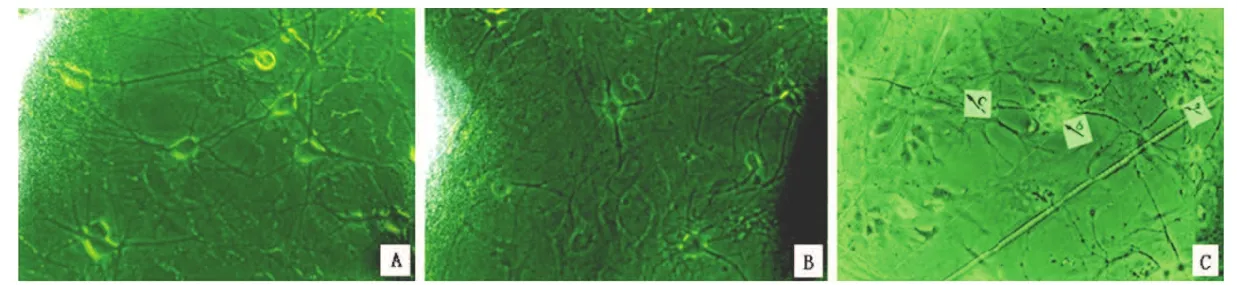
图1 体外培养13 d的海马神经元48.18×104 Bq/g体重氚水照射组与对照组形态学比较
Fritsch等[12]研究发现,处于增殖状态的干细胞或神经元前体细胞对电离辐射很敏感,发育中的幼年鼠脑组织神经元对射线高度敏感,低至0.25 Gy则可导致其发生凋亡。同期研究也发现,加入氚水的中脑培养基12 h可以引起细胞产生凋亡,培养的第4 d凋亡比例可达28.1%[13]。同时,出生前受照的仔鼠在出生6 d后大脑皮质第V层凋亡细胞的百分数较对照组增加,受氚水照射组的凋亡细胞百分数高于X射线照射组(如图2所示)。研究表明,照射后一系列分子生物学和细胞事件将会诱导放射性脑损伤发生,这些事件包括DNA损伤修复信号通路激活、细胞周期检查点变化、细胞凋亡以及基因表达谱改变等[14]。而事件终点将中枢神经系统内具有增殖潜能的细胞作为靶点,引起其数量减少[15]。

图2 受照后仔鼠出生6 d后大脑皮质细胞凋亡情况
神经干细胞(neural stem cell,NSC)是存在于成体脑组织中的一种干细胞,可分化成神经元、星形胶质细胞和少突胶质细胞,也可转分化成血细胞和骨骼肌细胞。可见辐射一旦损伤了具有分化为各种神经细胞潜能的NSC,造成的后果是非常严重的。因此,辐射只要不损伤脑海马NSC(使其凋亡),NSC就可以重新分化出各种功能性神经细胞替代原有的细胞,即海马功能损伤就存在着修复和恢复的可能。
信号转导在NSC的分化以及增殖中十分重要。目前已知的凋亡通路有线粒体依赖途径的凋亡、死亡受体途径的凋亡以及其他形式的凋亡[16]。同时已知当激活Notch信号转导通路时,干细胞进行增殖,Notch活性受到抑制时干细胞进入分化程序。提示利用Notch信号通路,可精确调控NSC向神经功能细胞分化的过程和比例[17]。此外,Janus激酶信号转导递质与转录激活剂(JAK-STAT)信号途径也参与干细胞的调控[18]。
3 分析与展望
阿尔茨海默症患者大脑呈现不同程度的弥漫性脑萎缩,其中脑海马萎缩最为明显。全球阿尔茨海默协会曾经预测,到2010年全球罹患痴呆症的患者数量预计将达到3560万人;2030年达到6570万人;2050年则将上升至11540万人[19]。中国目前患阿尔茨海默症及其他老年期痴呆症的患者接近1000万人,已是全球阿尔茨海默症第一大国[20]。随着人口老龄化,阿尔茨海默症已经成为全世界所关注的公共健康问题。
从上述作者研究中发现:SOM和AVP广泛分布于体内,具有神经递质的典型特征,在脑海马中的含量很高。动物实验研究表明,脑内SOM易受神经元损伤的影响,且以海马区最明显并出现明显的神经细胞凋亡现象[21]。AVP含量显著性减低,可能与这些脑区遭受损伤,细胞变性、坏死、脱落以及AVP投射纤维破坏有关。另外,还可能与氧肽酶(aminopetidaes)的活性增高有关,因为AVP无重摄取机制,主要是酶降解失活,因此一旦氧肽酶活性增高,增加了AVP的降解率,AVP则会降低。当细胞出现凋亡,脑的正常功能势必会受到影响,并引起一系列的后果,如衰老和脑萎缩。神经肽类活性物质含量、海马神经元体外培养形态学观察和细胞凋亡结果是造成神经损伤的原因之一。
4 结语
辐射可致小鼠脑海马神经元细胞凋亡、学习记忆能力下降、以致造成脑海马萎缩。对未来研究的设想:①破解辐射及其他因素导致脑海马损伤的关键分子途径,从神经元干细胞凋亡、脑组织蛋白质异常、神经递质及其受体异常以及自由基损伤等角度深入研究辐射所致脑海马损伤和认知损害的作用机制,对于提高海马体病变患者远期生存质量有着深远意义;②揭示衰老生物钟(线粒体)在脑萎缩中的奥秘,系统探讨线粒体在神经元干细胞维持、分化及细胞重编中的重要作用,分析人类线粒体与此相关疾病的干细胞模型及其在药物筛选中的前景,展望未来利用人类基因靶向修饰技术治疗线粒体相关疾病的可行性,为今后预防和治疗辐射致脑海马损伤提供重要的研究策略。
[1]Snyder JS,Soumier A,Brewer M,et al.Adult hippocampal neurogenesis buffers stress responses and depressive behavior[J].Nature,2011,476(7361):458-461.
[2]Ferrer I,Serrano T,Alcantara S,et al.X-ray-induced cell death in the developing hippocampal complex involves neurons and requires protein synthesis[J].J Neuropathol Exp Neurol,1993,52(4):370-378.
[3]Monje ML,Mizumatsu S,Fike JR,et al.Irradiation induces neural precursor-cell dysfunction[J].Nat Med,2002,8(9):955-962.
[4]Ungvari Z,Podlutsky A,Sosnowska D,et al.Ionizing radiation promotes the acquisition of a senescence-associated secretory phenotype and impairs angiogenic capacity in cerebromicrovascular endothelial cells:role of increased DNA damage and decreased DNA repair capacity in microvascular radiosensitivity[J].J Gerontol A Biol Sci Med Sci,2013,68(12):1443-1457.
[5]高卫民,周湘艳,何湘平,等.出生前氚水照射对仔鼠海马神经元电生理及神经行为的影响[J].辐射防护,1997,17(5):363-372.
[6]Wang B,Takeda H,Gao WM,et al.Induction of apoptosis by beta radiation from tritium compounds in mouse embryonic brain cells[J].Health Phys,1999,77(1):16-23.
[7]周湘艳,高卫民.低剂量氚水对发育中鼠中枢神经系统的影响及其机理研究[J].中华医学杂志,1999,79(7):493-495.
[8]王玉起,李广木,杨国芬,等.小剂量γ射线对仔代小鼠生长发育及脑组织中神经肽含量的影响[J].中华放射医学与防护杂志,1992,12(5):340-342.
[9]高卫民,周湘艳.出生前氚水照射对仔鼠学习记忆行为的影响及机制探讨[J].中国毒理学通讯,1998(1):5-8.
[10]王冰,周湘艳.低剂量氚宫内照射对仔鼠脑神经元发育的影响[J].中华放射医学与防护杂志,1994,14(2):79-82.
[11]高卫民,周湘艳.辐射对脑海马的影响[J].辐射防护,1999,19(1):63-70.
[12]Fritsch P,Richard-Le Naour H,Denis S,et al.Kinetics of radiation-induced poptosis in the cerebellum of 14-day-old rat after acute or during continuous exposure[J].Int J Radiat Biol,1994,66(1):111-117.
[13]Wang B,Takeda H,Gao WM,et al.nduction of apoptosis by beta radiation from tritium compounds in mouse embryonic brain cells[J].Health Phys,1999,77(1):16-23.
[14]Altman J.Autoradiographic and histological studies of postnatal neurogenesis.IV.Cell proliferation and migration in the anterior forebrain,with special reference to persisting neurogenesis in the olfactorybulb[J].J Comp Neurol,1969,137(4):433-457.
[15]Altman J,Das GD.Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats[J].J Comp Neurol,1965,124(3):319-335.
[16]Liu YY,Zheng Q,Fang B,et al.Germacrone induces apoptosis in human hepatoma HepG2 cells through inhibition of the JAK2/STAT3 signalling pathway[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(3):339-345.
[17]Koch U,Lehal R,Radtke F.Stem cells living with a Notch[J].Development,2013,140(4):689-704.
[18]Stine RR,Matunis EL.JAK-STAT signaling in stem cells[J].Adv Exp Med Biol,2013,786:247-267.
[19]Gulland A.Number of people with dementia will reach 65.7 million by 2030,says report[J].BMJ,2012,344:e2604.
[20]王华丽.关注痴呆刻不容缓[J].健康指南,2009(10):46-48.
[21]Tokita K,Inoue T,Yamazaki S,et al.FK962,a novel enhancer of somatostatin release,exerts cognitive-enhancing actions in rats[J].Eur J Pha rmacol,2005,527(1-3):111-120.