顺铂对人舌鳞状细胞癌细胞Tca8113细胞凋亡与自噬的影响
2013-09-11长春医学高等专科学校口腔教研室吉林长春3003
石 璐 苏 静 (长春医学高等专科学校口腔教研室,吉林 长春 3003)
顺铂(CDDP)是临床常用的化疗药物,抗肿瘤效果主要源于其DNA损伤作用,引起细胞的凋亡〔1~3〕。目前认为,由于血供减少,肿瘤细胞特别是肿瘤内部细胞在乏氧和营养受限的状况下,自噬是肿瘤细胞受到损伤因素诱导的细胞应激条件下的一种保护性反应〔4,5〕。使用自噬抑制剂或基因沉默自噬蛋白(Beclin 1或Atg5),均可促进CDDP诱导的半胱氨酸蛋白酶(Caspases)活化和细胞凋亡发生。研究结果显示自噬作为细胞适应性反应,可抑制CDDP诱导的细胞凋亡,促进细胞的存活〔6〕。本研究通过体外培养人舌鳞状细胞癌Tca8113细胞,初步探讨CDDP对其凋亡和自噬的影响,为寻找新的治疗舌鳞状细胞癌的策略以及联合用药提供一定的理论依据。
1 材料与方法
1.1 试剂与细胞 CDDP和二甲基噻唑(MTT)购自Sigma公司;Caspase-3,Cleaved Caspase-3,细胞色素 C(Cytochrome C),人多聚ADP核糖聚合酶(PARP),白噬性溶酶体(LC3),Beclin 1和p62抗体购于Santa公司;人舌鳞状细胞癌Tca8113细胞株用含10% 胎牛血清(Gibco公司)的DMDM(Gibco公司)培养液在37℃、5%CO2的孵箱内孵育培养,胰酶消化传代,隔2 d 1∶3传代,取对数生长期Tca8113细胞进行实验。
1.2 方法
1.2.1 实验分组 实验分为对照组(Control)以及不同剂量CDDP作用的实验组。
1.2.2 细胞存活率检测 取出于对数生长期的Tca8113细胞消化离心后均匀的加入96孔细胞培养板中,每孔中加150 μl约含(1~1.5)×104Tca8113细胞的培养液,CO2培养箱中培养12~18 h,使细胞完全贴壁。设立对照组以及不同浓度CDDP作用组,每个组设置6个重复孔,作用24 h后,每孔加入20 μl MTT,继续孵育4 h后弃掉孔板中的培养液,每孔加150 μl二甲基亚砜(DMSO),利用孔板振荡器振荡10 min,充分融解孔板内结晶物。完全溶解后,在BIO-TEK酶标仪上,选择490 nm波长,测定96孔细胞培养板各孔光吸收值,最后计算细胞增殖率。对照组细胞存活率为100%,其余各组存活率=(各浓度组A值/对照组A值)×100%。
1.2.3 Western印迹检测凋亡和自噬相关蛋白的表达 CDDP作用后,收集细胞。预冷磷酸盐缓冲液(PBS)洗涤细胞2次,每瓶加入120 μl蛋白裂解液(RIPA),充分混匀后利用细胞刮将细胞完全刮下后移入1.5 ml离心管中,放入4℃冰箱中作用45 min,然后低温离心机离心,4 000 r/min离心20 min,收取上清,检测蛋白浓度。取蛋白标准品牛血清白蛋白(BSA,1 mg/ml),用RIPA稀释将其稀释成0.1 mg/ml,将待测蛋白2 μl加入 200 μl Bio-Rad Assay Buffer,震荡混匀,酶标仪测630 nm测量各孔OD值,绘制标准曲线,根据标准曲线计算出各组蛋白浓度。100℃蛋白变性,然后用加样器缓慢加入变性后蛋白样本。上样完成后进行电泳,上层胶90 V,15 min,下层胶 180 V,50 min,电泳结束后转膜,100 V,120 min。转膜结束后将完成转膜的PVDF膜放入5%脱脂奶粉中封闭30 min。封闭结束后用加入相应一抗,4℃过夜。第二天,利用PBS洗膜3次,每次15 min中,加入相应二抗,室温1 h。然后PBS再洗膜3次,每次15 min,二氨基联苯胺(DAB)显色,分析灰度值。然后将PVDF膜晾干后封存。
1.3 统计学方法 应用SPSS11.0统计软件进行分析,资料数据以±s表示,电泳条带灰度值以灰度×面积/对照组表示。
2 结果
2.1 CDDP 对Tca8113细胞生存率的影响 与对照组相比(设为 1.00),1.5、3、6、12、24 μg/ml CDDP 组 Tca8113 细胞生存率分别为(92.5±5.1)%、(78.3±6.8)%、(59.3±4.3)%、(42.1±3.9)%、(28.3±5.2)%。可见不同浓度CDDP可以明显降低细胞的生存率(P<0.05)。
2.2 CDDP对Tca8113细胞凋亡相关蛋白表达的影响 CDDP可以明显的增加活化的Caspase-3表达水平;同时CDDP还可以增加PARP活化片段的表达水平,明显增加Tca8113细胞Cytochrome C表达水平(P<0.01)。见图1。
2.3 CDDP对Tca8113细胞自噬相关蛋白表达的影响Western印迹检测显示,CDDP可以明显增加LC3-Ⅱ以及Beclin 1蛋白的表达水平。同时,CDDP可以降低p62蛋白的表达水平。见图2,图3,图4。
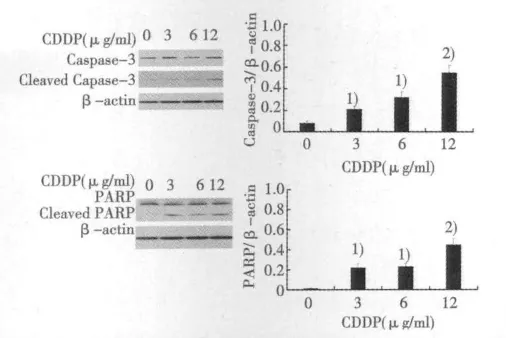
图1 CDDP对Tca8113细胞凋亡相关蛋白表达的影响
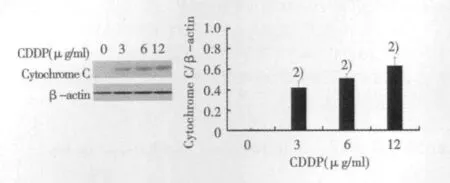
图2 CDDP对Tca8113细胞Cytochrome C蛋白表达的影响

图3 CDDP对Tca8113细胞自噬相关蛋白表达的影响
3 讨论
近年来口腔颌面部恶性肿瘤的发病率在逐年的升高,尤其是老年人更为严重,传统的手术治疗的方法往往不能达到预期的治疗效果并且常常伴随着复发,因此需要寻找新的治疗策略。联合疗法是指在手术治疗的基础上联合应用化学药物进行治疗。CDDP是经典的临床化疗药物,其抗肿瘤机制是引起肿瘤细胞DNA损伤,从而诱导肿瘤细胞发生凋亡,从而达到抑制肿瘤生长和杀伤肿瘤的效果。
本文中,MTT结果显示CDDP可以抑制人舌鳞状细胞癌细胞存活。进一步Western印迹结果显示,不同浓度的CDDP可以明显增加凋亡相关蛋白Caspase-3和PARP活化片段的表达水平,提示CDDP可以诱导人舌鳞状细胞癌Tca8113细胞发生凋亡。细胞内存在多少凋亡信号通路,其中线粒体信号通路在细胞内凋亡中发挥主要的作用〔7,8〕。Western印迹结果显示,不同浓度的CDDP可以明显增加胞浆内Cytochrome C水平,提示CDDP可能通过线粒体凋亡信号通路诱导凋亡的发生。
自噬是将胞质成分(包括细胞器)包裹进双层膜结构的自体吞噬体中,最终与溶酶体融合而被降解的途径。虽然自噬对于损伤细胞器等物质的降解可以促进处于应激环境的细胞的存活,但是自噬对于肿瘤细胞命运的影响还存在争议。饥饿条件下,自噬可以通过降解细胞质成分为细胞提供生产ATP和合成蛋白质所需的原料,促进细胞存活。而在凋亡缺陷的细胞中,自噬又是细胞发生坏死所必需的。一般认为,自噬通过降解损伤的细胞器或者长寿命蛋白来维持营养物质的循环,促进细胞的存活。但是,近来的研究显示自噬对于细胞命运存在双重作用,特别是在抗肿瘤药物引起的细胞死亡中的作用越来越受到人们的关注〔9〕。有报道称,CDDP可以诱导肿瘤细胞发生自噬。LC3,Beclin1和 p62是检测自噬最常用的标志性蛋白〔10〕,本文中Western印迹结果提示CDDP可以诱导Tca8113细胞发生自噬。
综上所述,CDDP在诱导人舌鳞状细胞癌Tca8113细胞发生凋亡的同时可以诱导自噬的发生,但是自噬在CDDP诱导的凋亡中的作用还不是很清楚,需要进一步的探讨。联合CDDP和自噬抑制剂可能成为治疗人舌鳞状细胞癌的新的策略。

图4 CDDP对Tca8113细胞p62蛋白表达的影响
1 Liang XJ,Mukherjee S,Shen DW,et al.Endocytic recycling compartments altered in cisplatin-resistant cancer cells〔J〕.Cancer Res,2006;66(4):2346-53.
2 Mandic A,Hansson J,Linder S,et al.Cisplatin induces endoplasmic reticulum stress and nucleus-independent apoptotic signaling〔J〕.J Biol Chem,2003;278(11):9100-6.
3 Yu H,Su J,Xu Y,et al.p62/SQSTM1 involved in cisplatin resistance in human ovarian cancer cells by clearing ubiquitinated proteins〔J〕.Eur J Cancer,2011;47(10):1585-94.
4 He C,Klionsky DJ.Regulation mechanisms and signaling pathways of autophagy〔J〕.Annu Rev Genet,2009;43:67-93.
5 Turcotte S,Giaccia AJ.Targeting cancer cells through autophagy for anticancer therapy〔J〕.Curr Opin Cell Biol,2010;22(2):246-51.
6 Morselli E,Galluzzi L,Kepp O,et al.Anti-and pro-tumor functions of au-tophagy〔J〕.Biochim Biophys Acta,2009;1793(9):1524-32.
7 Cullen KJ,Yang Z,Schumaker L,et al.Mitochondria as a critical target of the chemotherapeutic agent cisplatin in head and neck cancer〔J〕.J Bioenerg Biomembr,2007;39(1):43-50.
8 Zeng H,Zhang S,Yang KY,et al.Knockdown of second mitochondria-derived activator of caspase expression by RNAi enhances growth and cisplatin resistance of human lung cancer cells〔J〕.Cancer Biother Radiopharm,2010;25(6):705-12.
9 Pan J,Cheng C,Verstovsek S,et al.The BH3-mimetic GX15-070 induces autophagy,potentiates the cytotoxicity of carboplatin and 5-fluorouracil in esophageal carcinoma cells〔J〕.Cancer Lett,2010;293(2):167-74.
10 Rubinsztein DC,Gestwicki JE,Murphy LO,et al.Potential therapeutic applications of autophagy〔J〕.Nat Rev Drug Discov,2007;6(4):304-12.
