冠状动脉搭桥术后静脉桥早期过度扩张的研究进展
2013-09-10强北平AzrielOsherovBradleyStrauss
强北平,Azriel B.Osherov,Bradley Strauss
冠心病一直是现代社会的头号杀手,仅美国1年就有超过40万人死于冠心病[1],冠状动脉搭桥术是冠心病治疗的主要手段之一。近年来,由于介入心脏病学及介入技术的飞速发展,冠心病的介入治疗似大有取代冠状动脉搭桥术的趋势;但基于患者的长期效益以及多支复杂病变的治疗,冠状动脉搭桥术仍有着介入治疗不可替代的优越性[2]。大隐静脉和内乳动脉是最常用的桥血管,随访研究表明内乳动脉桥的10年开通率为85%,大隐静脉桥为61%[3]。尽管内乳动脉有着较好的长期疗效,但由于其资源有限,大隐静脉仍是最主要的桥用血管。静脉桥最主要的问题是其在10年内有近40%的较高全梗阻率,梗阻的原因公认为是血管桥的粥样硬化和内膜增生[4]。平滑肌细胞由血管中膜向内膜不断迁移并大量增生,造成内膜增生和血管狭窄。高脂血症进一步加速了内膜增生的进程。临床和实验研究都表明,在内膜增生的同时甚至更早时期,静脉桥伴之以过度扩张的重塑改变。由于大量的研究集中在血管内膜增生,对于静脉桥极早期的过度扩张现象缺少一个系统的认识,甚至有些临床医师并不认为静脉桥的过度扩张是一个不好的现象。最近的研究表明,静脉桥的早期过度扩张与脂质沉积和内膜增生密切相关[5],很可能是静脉桥搭桥失败的一个早期指证。本文在此对静脉桥的早期过度扩张现象的临床、病生理机制及预防和治疗做一个总结,以期引起心外科对这种现象的进一步重视。
1 静脉桥早期过度扩张的病生理改变
1.1 静脉桥完全梗阻的病生理过程 冠状动脉搭桥术的极早期梗阻往往与手术有关,本文在此并不讨论因手术操作引起的静脉桥梗阻,而是针对那些搭桥手术成功,静脉桥在高流速动脉血流中的病生理演变引起的全梗阻。在搭桥手术第1周内,由于血管内皮细胞的损伤,致血小板黏附和血栓形成。中性粒细胞和单核细胞释放一系列的细胞因子,刺激血管平滑肌细胞增生;基质金属蛋白酶沉积,破坏血管壁细胞外基质,平滑肌细胞由中膜向内膜迁移,造成中膜增厚和内膜大量增生。术后1个月~3年,脂质细胞的沉积在内膜形成粥样斑块;随后内膜进一步增生,粥样斑块进一步扩大,使血管腔逐渐缩小。最终粥样斑块破裂致静脉桥血栓性全梗阻[4]。前文述及,在搭桥术后10年内,这部分病例约占全部搭桥患者的40%左右。
1.2 静脉桥早期过度扩张的实验研究 对于静脉桥早期过度扩张尚无一个明确的定义,应用家兔颈静脉-动脉的血管移植实验表明,在1~4周,血管内超声检查显示静脉桥的管腔面积并无明显变化;而12周时其管腔面积增加超过40%(见图1)。静脉桥的过度扩张伴之以细胞凋亡,胶原合成,胶原总量和基质金属蛋白酶量的显著增加。这些变化与巨噬细胞的浸润和脂质沉积密切相关。静脉桥的早期过度扩张是静脉适应高速动脉血流的一种反应,高脂血症会进一步加速这一进程[5]。猪的颈静脉-动脉移植实验也表明,仅在早期过度扩张的静脉桥发现了粥样斑块[6],提示静脉桥的早期过度扩最终结果很可能是静脉桥全梗阻。
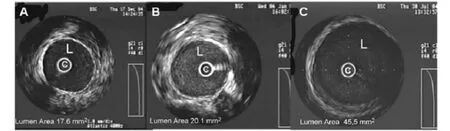
图1 家兔颈静脉-动脉血管移植血管内超声检查Figure 1 Intravascular ultrasound of rabbit jugular vein and arteryblood vessel transplantation
1.3 静脉桥早期过度扩张的临床研究 血管造影一般很难看到静脉桥的早期病生理改变,大部分的早期静脉桥临床研究都是用血管内超声得到的。对于那些静脉桥血管造影正常的病例行血管内超声检查,发现血管横截面积6个月时显著大于1个月时,而管腔面积则低于1个月时。提示静脉桥管壁在前6个月内已开始增加,伴之以血管的代偿性扩张[7]。静脉桥内增生斑块的位置与过度扩张的位置一致,而且斑块的面积与血管横截面积呈线性正相关[8]。尽管这种早期静脉桥过度扩张被认为是对管壁增生的代偿性反应[8],但由于血管增生及粥样硬化一旦开始就不会停止,而血管是不可能无限度代偿扩张的,这种现象应是静脉桥全梗阻的一个预示指标。这种早期的过度扩张形态改变预示着静脉桥后期的粥样硬化甚至全梗阻结局[9]。
2 静脉桥早期过度扩张的发生机制
2.1 血管壁剪切力 当静脉被植入动脉血流后,血流速度很高的动脉血对静脉桥产生的剪切力,是引起桥静脉早期过度扩张,管壁张力增高和内膜增厚的主要因素。剪切力与血流速度和血液黏度呈正比,与血管半径的3次方呈反比。血管所受的剪切力和血管张力越大,血管就更易过度扩张。离体实验表明,桥静脉受到的血流剪切力1周时达最高;随之血管扩张,直径增大。至28d时,由于管腔直径的增大使血管所受到的剪切力逐步减低,二者最后达到平衡,血管停止进一步扩张。血管张力与平均动脉压和血管半径成正比,第3天时管壁张力达到最高。随后由于血管内膜的增生,管腔直径减小,血管张力减低,血管的过度扩张亦减低[10]。
一般认为,动脉血流剪切力是通过改变血管壁内基质金属蛋白酶含量来调节桥静脉的结构重塑。血管细胞外基质是由平滑肌细胞和内皮细胞合成并分泌到细胞外,分布在细胞表明或细胞间的大分子,主要成分是蛋白多糖、胶原蛋白、弹性蛋白及其粘着成分。细胞外基质构成复杂的网状结构,连接细胞,调节细胞的生理活动,并维持血管的稳定性。基质金属蛋白酶(Matrix Metalloproteinases,MMPs)是一组锌离子或钙离子依赖的蛋白酶,其主要作用是在生理和病理情况下降解吸收细胞外基质,维持细胞外环境的稳定。与心血管疾病关系最为密切的是MMP-2和MMP-9,其主要作用是降解各种胶原蛋白、弹性纤维、凝胶和纤连蛋白。MMPs一旦被激活,将迅速降解细胞外基质,破坏血管壁结构,因此对MMPs的控制非常重要[11]。
动物实验表明,在植入静脉桥的4周内,桥静脉内MMP-2和MMP-9前体及活性成分均显着增高[5],使血管壁内细胞外基质大量破坏,造成静脉桥早期过度扩张。有报道在MMPs前体及活性成分增高的同时,VEGF受体量也明显增加;提示组织很可能是通过上调VEGF分泌来增加MMP量及活性的[12]。其他的分子生物学机制也多有报道。
2.2 炎症反应 静脉血管在高压力的动脉血流中由于剪切力和血管张力的作用,势必造成静脉的损伤;而静脉损伤的直接后果就是血管壁大量的炎症反应,家兔颈静脉-动脉的移植实验表明,静脉桥壁在第4周时就有大量巨噬细胞产生,至12周时更多[5]。实验发现血管移植发生大量炎症反应的同时,都会伴有MMPs含量的增加,以及多种MMPs的基因表达[13],提示炎症反应通过炎性细胞分泌更多的MMPs,降解更多的细胞外基质,进一步促进静脉桥的早期扩张重塑。
2.3 高脂血症 对高脂血症一般的概念是脂质在血管壁沉积,形成纤维斑块,随之坏死细胞形成粥样坏死、硬化、堵塞血管造成临床心肌缺血症状;但这些都是高脂血症几年之后在冠心病后期对血管造成的病生理改变。在搭桥手术的极早期,高脂血症对静脉桥的作用是进一步促进血管壁的炎症反应。动物实验结果表明,高脂血症使桥静脉血管壁形成大量的巨噬细胞浸润[5],并伴之以 MMPs的增加[5,13]。提示高脂血症在极早期是通过增加炎症反应,炎症细胞分泌更多的MMPs,破坏血管细胞外基质,来进一步促进静脉桥的早期过度扩张 (见图2)。
2.4 内膜增生 正常的血管内层表明为一单层内皮细胞均匀覆盖,内皮细胞直接与血液接触,是隔开血液和血管基质的屏障;而且对血液的流动性,血小板聚集,血管紧张度和通透性,血管的免疫,炎症及平滑肌增生都有重要的调控作用。内皮细胞的外层是由数层弹力纤维组成的内弹力膜,内弹力膜是阻滞中膜平滑肌细胞向内膜迁移增生的屏障。内皮细胞和内弹力膜的损伤,将会释放各种细胞因子,刺激内皮细胞和平滑肌细胞迅速增生,启动内膜增生过程。同时由于MMPs对血管细胞外基质的降解破坏,细胞外基质减弱了维持血管壁稳定性的作用,平滑肌细胞从中外膜向内膜大量迁移,进而促进内膜增生。内皮细胞、平滑肌细胞在迅速增生的过程中,分泌大量的细胞外基质,胶原纤维亦大量增生,使内膜迅速增厚。
当静脉植入动脉血流后,极早期的静脉过度扩张和内膜增生是两个同时发生的过程。随着内膜的不断增厚,血管壁因剪切力造成的破坏得以修复,血管的过度扩张重塑停止。但内膜增生过程却持续进行,加之以粥样硬化改变,最终造成静脉桥完全堵塞。
3 静脉桥早期过度扩张的防治
3.1 早期血管内超声检查 前文述及,静脉桥早期过度扩张与内膜增生是同时发生的两个过程,其最终的结果极可能是全梗阻,所以静脉桥早期过度扩张的及时检出非常重要,利于尽早应用相应的防治措施。临床研究表明,血管造影并不能很好地显示静脉桥的早期结构重塑[7],血管内超声检查是发现静脉桥早期过度扩张的最有效手段,而且应在搭桥手术的3个月[5]或6 个月内[7]完成这项检查。
3.2 他汀类降脂药物治疗 高脂血症自始至终都对静脉桥产生严重危害;早期加重静脉桥炎症反应,增加MMPs含量,促进静脉桥早期过度扩张;随之形成脂质沉着及粥样硬化改变。后期粥样斑块的坏死破裂至血管完全梗阻。所以降脂药物治疗应尽早并全程给予。最近的动物实验结果表明,大剂量口服他汀药物 (5mg·kg-1·d-1)可显著性地减低静脉桥的早期过度扩张达38%之多,同时明显减低MMPs含量[14]。治疗组血管壁巨噬细胞量显著低于对照组,提示他汀类药物是通过抑制早期的炎症反应来改善静脉桥早期结构重塑。他汀类药物宜在搭桥手术前2周就开始用药,以期在手术时药物浓度已达至治疗水平,以控制早期过度扩张。他汀类药物对于内膜增生的减少有着比较肯定的疗效,这方面的临床和实验研究报道都很多。
3.3 可吸收的多聚物外壳 Polyglyactin是一种由聚乙醇酸组成的多聚物,主要用来制作可吸收的外科缝线,一般在体内60d可完全吸收。应用猪的颈动-静脉移植实验模型,移植手术完成后,在静脉桥外置一可吸收的,非限制性的8mm直径的Polyglyactin外壳,4周后取出静脉桥。病理检查发现应用Polyglyactin外壳组的静脉桥,内膜增生显著低于对照组,在外壳周围有大量的炎性反应。提示可吸收外壳植入后,在外膜形成炎症反应和新生血管,使中外膜的平滑肌细胞向外迁移并增生,内膜的增生则处于相对抑制状态[15]。尽管作者无数据显示可吸收外壳对早期过度扩张的影响,但多聚物外壳的机械作用和引导增生反应向外膜进行的机制,肯定会对静脉桥的早期结构重塑产生一定的作用。多聚物外壳显而易见是一种非常有前途的抑制静脉桥早期过度扩张和内膜增生的方法。有报道药洗支架对静脉桥有着非常好的长期临床效果[16],但对于早期过度扩张却鲜有报道。
3.4 移植静脉表面药物治疗 目前已有很多直接对静脉桥行药物和基因治疗来预防静脉桥完全梗阻的尝试。一般是术前将移植静脉在药物中培育30min后再植入动脉血流中。经分裂激活蛋白激酶抑制剂处理过的静脉桥,其内膜增生明显减低[17]。这不失为一种潜在的药物预防静脉桥失败的有效方法,进一步的实验研究仍在进行中。
4 小结
静脉桥的极早期过度扩张与内膜增生是同时出现的两个过程,其最终的结局是移植静脉的完全梗阻。血管剪切力、炎症反应以及MMPs的增多是早期结构重塑的主要机制。高脂血症对早期过度扩张和内膜增生起着促进作用。静脉桥早期过度扩张的及时诊断以及相应治疗,尤其他汀类降脂药物的治疗,对预防静脉桥的失败起着非常重要的作用。
1 Roger VL,Go AS,Lloyd-Jones DM,et al.Heart disease and stroke statistics——2011 update:a report from the American Heart Association[J].Circulation,2011,123(4):e18-e209.
2 Soran O,Manchanda A,Schueler S.Percutaneous coronary intervention versus coronary artery bypass surgery in multivessel disease:a current perspective [J].Interact Cardiovasc Thorac Surg,2009,8(6):666-671.
3 Goldman S,Zadina K,Moritz T,et al.Long-term patency of saphenous vein and left internal mammary artery grafts after coronary artery bypass surgery:results from a Department of Veterans Affairs Cooperative Study[J].J Am Coll Cardiol,2004,44(11):2149 -2156.
4 Shukla N,Jeremy JY.Pathophysiology of saphenous vein graft failure:a brief overview of interventions[J].Curr Opin Pharmacol,2012,12(2):114-120.
5 Wong AP,Nili N,Jackson ZS,et al.Expansive remodeling in venous bypass grafts:novel implications for vein graft disease[J].Atherosclerosis,2008,196(2):580 -589.
6 Thim T,Hagensen MK,Horlyck A,et al.Oversized vein grafts develop advanced atherosclerosis in hypercholesterolemic minipigs[J].BMC Cardiovasc Disord,2012,12:24.
7 Higuchi Y,Hirayama A,Shimizu M,et al.Postoperative changes in angiographically normal saphenous vein coronary bypass grafts using intravascular ultrasound [J].Heart Vessels,2002,17(2):57 -60.
8 Mendelsohn FO,Foster GP,Palacios IF,et al.In vivo assessment by intravascular ultrasound of enlargement in saphenous vein bypass grafts[J].Am J Cardiol,1995,76(14):1066 -1069.
9 Murphy GJ,Angelini GD.Insights into the pathogenesis of vein graft disease:lessons from intravascular ultrasound [J].Cardiovasc Ultrasound,2004,2:8.
10 Fernandez CM,Goldman DR,Jiang Z,et al.Impact of shear stress on early vein graft remodeling:a biomechanical analysis[J].Ann Biomed Eng,2004,32(11):1484-1493.
11 Dollery CM,McEwan JR,Henney AM.Matrix metalloproteinases and cardiovascular disease[J].Circ Res,1995,77(5):863-868.
12 Misra S,Fu AA,Puggioni A,et al.Increased shear stress with upregulation of VEGF-A and its receptors and MMP-2,MMP-9,and TIMP-1 in venous stenosis of hemodialysis grafts[J].Am J Physiol Heart Circ Physiol,2008,294(5):H2219 -2230.
13 Sharony R,Pintucci G,Saunders PC,et al.Matrix metalloproteinase expression in vein grafts:role of inflammatory mediators and extracellular signal-regulated kinases-1 and-2[J].Am J Physiol Heart Circ Physiol,2006,290(4):H1651 -1659.
14 Qiang B,Toma J,Fujii H,et al.Statin therapy prevents expansive remodeling in venous bypass grafts[J].Atherosclerosis,2012,223(1):106-113.
15 Jeremy JY,Bulbulia R,Johnson JL,et al.A bioabsorbable(polyglactin),nonrestrictive,external sheath inhibits porcine saphenous vein graft thickening [J].J Thorac Cardiovasc Surg,2004,127(6):1766-1772.
16 Ramana RK,Ronan A,Cohoon K,et al.Long-term clinical outcomes of real-world experience using sirolimus-eluting stents in saphenous vein graft disease [J].Catheter Cardiovasc Interv,2008,71(7):886-893.
17 Gulkarov I,Bohmann K,Cinnante KM,et al.Topical mitogen-activated protein kinases inhibition reduces intimal hyperplasia in arterialized vein grafts[J].J Surg Res,2009,154(1):150 -156.
