32例化疗后接受手术治疗的晚期胃癌患者的临床分析
2013-09-10孙永琨依荷芭丽周爱萍袁兴华蔡建强王金万
孙永琨 杨 林 依荷芭丽·迟 黄 镜 周爱萍 袁兴华 蔡建强王金万
32例化疗后接受手术治疗的晚期胃癌患者的临床分析
孙永琨①杨 林①依荷芭丽·迟①黄 镜①周爱萍①袁兴华②蔡建强①王金万①
目的:对晚期胃癌一线化疗后接受手术治疗的患者进行分析,寻找影响该组患者生存的因素。方法:回顾性分析2007年8月至2011年7月32例一线化疗后接受手术治疗的晚期胃癌患者的资料,分析多种临床病理因素对生存的影响。生存分析采用Kaplan-Meier法,并以Log-rank法比较组间差异,应用Cox模型进行多因素分析。结果:全组患者中位年龄46岁(22~74岁),中位生存期为19个月(4~59个月)。生存分析显示化疗疗效(PR,SD患者分别为23个月和14.5个月,P=0.045)和原发灶是否切除(切除,未切除患者分别为23个月和5.5个月,P=0.017)与总生存相关。多因素分析未显示单一的因素与患者的生存相关。结论:化疗有效、原发病灶可切除的经过选择的晚期胃癌患者,可以尝试进行原发病灶的手术治疗。
晚期胃癌 化疗 手术治疗 总生存
胃癌是世界范围内最常见的恶性肿瘤之一,其发病人数居恶性肿瘤的第四位,而死亡人数仅次于肺癌,居第二位[1]。我国是胃癌高发的国家,全世界约有35%的胃癌发生在我国,根据全国抽样调查结果显示,我国胃癌的死亡率为25.16/10万人[2]。由于世界上多数国家没有开展胃癌筛查,胃癌经常到晚期才得以诊断。对于失去手术根治机会或复发转移的患者,目前公认应采取以化疗为主的综合治疗。晚期胃癌的化疗已经取得了显著的进步:5-氟尿嘧啶(5-Fu)和/或顺铂(DDP)仍然是胃癌化疗的基础性药物;以紫杉类、伊立替康、卡培他滨、S-1、奥沙利铂等新药组成的联合化疗方案,相对于以前的方案能够提高有效率,减轻临床症状,生存期也有所延长,逐渐成为主流方案,比较突出是 DCF[3]和 EOX[4]方案;曲妥珠单抗已经在晚期胃癌患者的靶向治疗方面取得了突破,其他靶向治疗药物也处于临床研究中[5]。此前,有回顾性研究表明晚期胃癌行姑息手术可能有生存获益[6],但目前为止,姑息性手术的意义仍不明确。本文旨在分析一线化疗后接受姑息手术的晚期胃癌患者的临床特点,以发现哪些患者可能从姑息手术中获益。
1 材料与方法
1.1 一般资料
收集本院2007年8月至2011年7月收治的32例经组织学证实的、有完整病历记录的晚期胃癌患者资料。这些患者均为伴血行转移和/或腹腔种植转移和/或非区域淋巴结转移的Ⅳ期患者,至少有一个单径>1 cm的可测量肿瘤病灶。均在化疗后进行了手术治疗。
1.2 方法
1.2.1 治疗和疗效评价 32例患者均接受了一线化疗。化疗方案采用2药或3药联合方案。每2个周期评价疗效。近期客观疗效评价应用RECIST标准[7]。
外科医生根据患者的身体状况、化疗后影像学检查及自己的经验判断能否手术切除及切除范围。手术方式包括全胃或胃大部切除术,单纯探查或吻合术或造瘘术,以及转移灶的切除术。术后行化疗和/或放疗及最佳支持治疗。
1.2.2 随访 采用门诊复诊和电话随访的方式进行随访,所有患者均有完整随访资料,随访截止日期为2013年2月5日。中位随访时间19个月(4~59个月)。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析。总生存期(OS)指化疗开始至任何原因导致死亡的日期。生存分析采用Kaplan-Meier法,并以Log-rank法比较组间差异,应用Cox模型进行多因素分析。显著检验水准α=0.05。
2 结果
2.1 一般情况
本组32例患者的中位年龄为46岁(22~74岁)。所有患者病理均为腺癌。一线化疗方案中含有铂类与氟尿嘧啶类的联合方案最常用(29例,91%)。化疗至手术的中位时间为3个月(0.5~10.5月),其中1例患者第1周期化疗中出现梗阻,行急诊手术。中位化疗周期数为4个周期(1~10个周期)。4例患者在术后的治疗中接受过姑息放疗。患者的临床及治疗特征见表1。
2.2 生存情况
全组患者的中位生存期为19个月(4~59个月),1年、2年生存率分别为71.5%和37.7%(图1)。根据文献资料,选择年龄、性别、肝脏转移、腹膜种植转移、家族史、是否应用紫杉类药物、化疗疗效(部分缓解PR对比稳定SD)及原发灶是否切除进行单因素分析。生存分析显示化疗疗效和原发灶是否切除与总生存相关(表2)。化疗疗效、原发灶是否切除对生存的影响见图2、3。多因素分析未显示单一的因素与患者的生存相关。

表1 32例患者的临床及治疗特征Table 1 Clinical and therapy characteristics of 32 patients
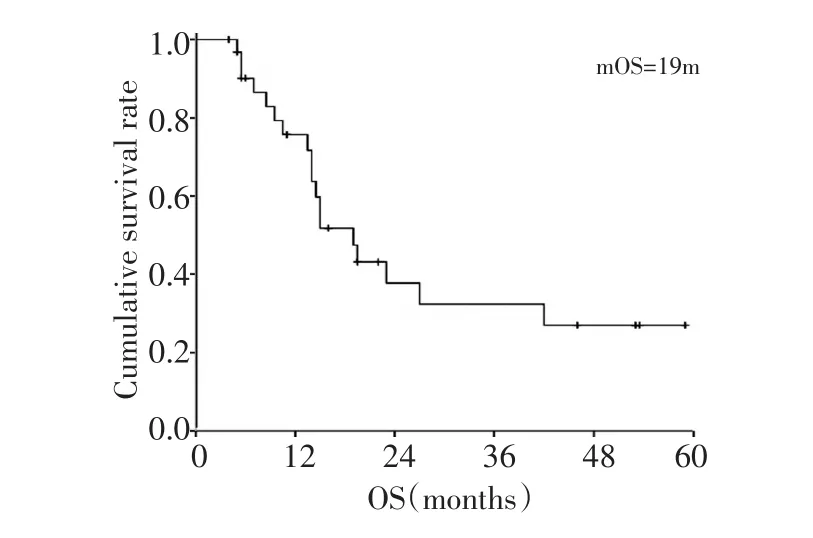
图1 32例患者的生存曲线Figure 1 OS curve of 32 patients
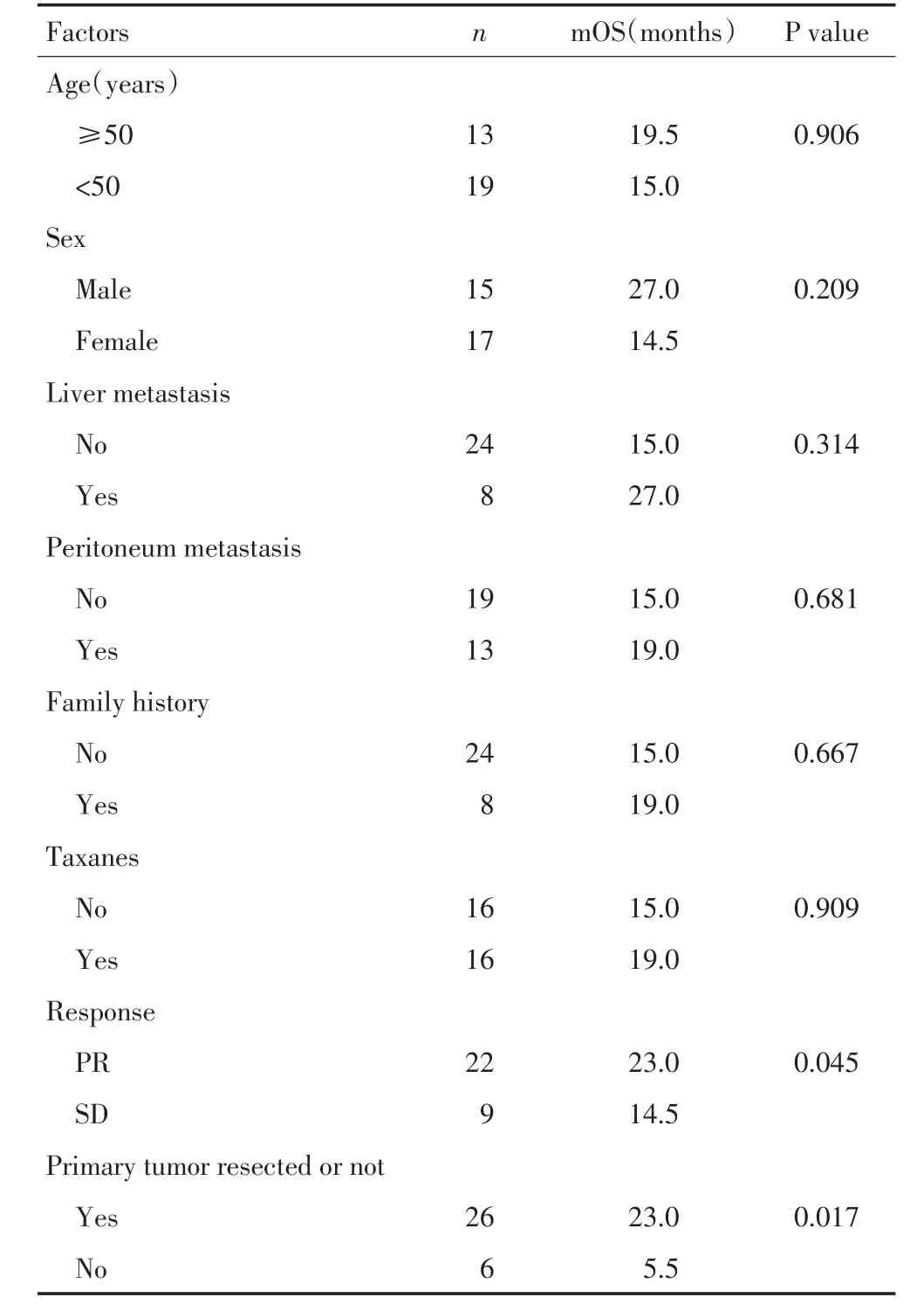
表2 影响患者预后的单因素分析Table 2 Single-factor analysis of patients through Kaplan-Meier method
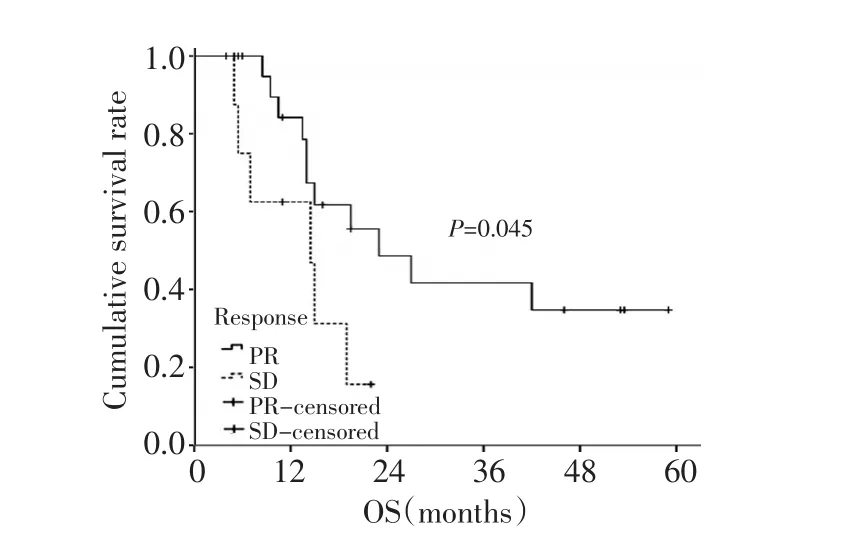
图2 化疗疗效对患者生存的影响Figure 2 Curves of overall survival rate of patients with different responses to chemotherapy
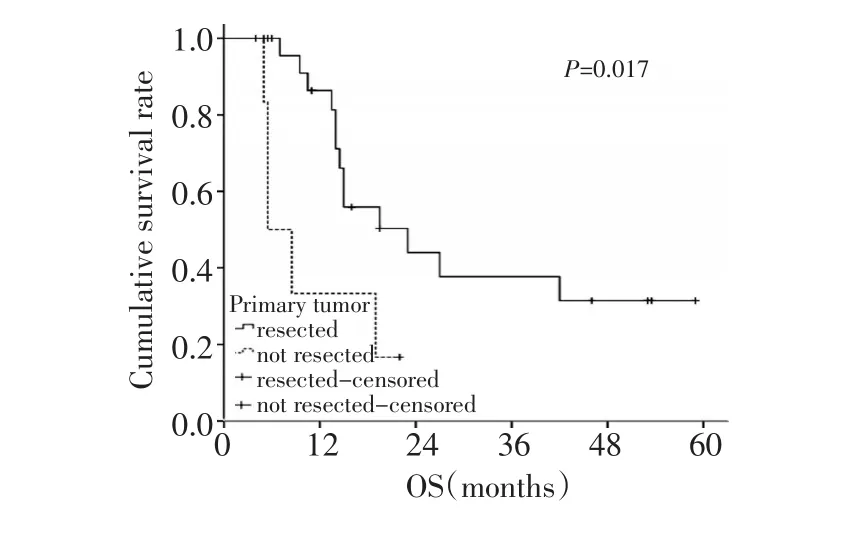
图3 原发灶是否切除对患者生存的影响Figure 3 Curves of overall survival rate of patients with regard to whether the primary tumor can be resected
3 讨论
晚期胃癌的姑息手术治疗长期存在争议。多数学者认为只有出现不能控制的并发症如出血、穿孔、梗阻等时才进行姑息性胃部手术,也有部分学者认为姑息性手术能够减少严重的肿瘤相关并发症,减轻症状,延长患者的生存[8-9]。
Shridhar等[10]根据SEER数据库回顾了5 072例晚期胃癌患者的临床治疗,结果显示中位生存时间在3 069例未接受手术或放疗的患者中为7个月;806例仅接受放疗的患者中为8个月;957例仅接受手术治疗的患者中为10个月;而在240例接受手术和放疗的患者中为16月。不良预后因素包括:年龄、T4或N3肿瘤、印戒细胞癌和腹膜转移。这提示接受过姑息性手术切除和(或)放疗的患者生存时间较长。
Sougioultzis等[11]回顾了311例晚期胃癌的病例资料,发现姑息手术、化疗方案、组织学分级、肝转移、腹膜转移等9个因素会影响患者的总生存。接受姑息性手术及采用联合化疗方案能够有生存获益。这与本组资料的情况基本一致。但本组资料未发现肝转移、腹膜转移与生存的关系,可能与病例数较少、人群选择偏倚有关。
Lim等[12]回顾了63例经过手术治疗的晚期胃癌患者的资料,随访18.7个月,1年和3年的生存率分别为52%和12%。国人人种和年龄<60岁是影响生存的因素,而性别、肿瘤位置、血行转移、手术范围等与生存期无关。
Dittmar等[13]回顾了290例胃癌患者的资料,其中晚期患者119例,原发病灶姑息性切除的患者中位生存期15个月,胃肠短路手术的患者中位生存期9个月,未接受手术治疗的患者中位生存期6个月。原发病灶切除能够降低严重的肿瘤相关并发症的发生率。年龄、肿瘤部位的数量以及是否化疗是影响生存期的因素。
从上述回顾性资料可以看出,姑息手术可能有生存获益。但影响生存的因素在各资料中不尽相同。这就需要对本研究的资料进行分析,选择出可推荐进行手术治疗的合适人群。目前晚期胃癌总体的OS在8~12个月[5],本组患者的中位生存达19个月,高于文献报道的数据,提示手术对生存的作用。但本组对象排除了化疗无效的患者,是经过高度选择的人群。在经过选择的人群中,年龄、性别、家族史、肝转移、腹膜转移、化疗药物的选择均不是影响预后的因素。
化疗疗效(PR或SD)显著影响生存期。本组32例患者,22例有效,有效率达68.7%;而SD的患者只有9例,这提示化疗有效的患者更容易也有更多的机会接受手术治疗。因此,对于有潜在手术机会的患者,可考虑有效率较高的方案。随着紫杉类、蒽环类、卡培他滨、替吉奥等新药的应用,晚期胃癌的化疗有效率能达到40%以上。在Ⅱ期研究中,多西他赛联合铂类及替吉奥的有效率甚至能接近70%[14]。而Her-2阳性的患者,应用曲妥珠单抗有效率也显著提高,ToGA试验中,化疗联合曲妥珠单抗与化疗组的有效率分别为47.3%和34.5%[15]。因此,为了获得更高的有效率,身体状况良好的患者,可考虑三药联合方案;Her-2阳性患者,可考虑加用曲妥珠单抗。本组资料发现原发灶是否切除影响患者的生存,未能切除原发灶的患者预后差,这部分患者的原发肿瘤没有消退至可以切除的程度,从侧面反应了化疗疗效对于生存的价值。另外,原发灶未切除的患者随着病情发展,容易出现出血、梗阻等急性并发症,也会影响生存。
原发病灶姑息手术治疗在晚期胃癌中具有潜在的应用价值,但目前只有回顾性分析的结果。由于接受姑息手术的患者是高度选择的,并经过多学科讨论,目前对此还不能够进行随机对照研究。当前,应根据患者肿瘤转移的程度、化疗反应、患者体能状况及切除可能性等影响局部治疗效果的因素进行多学科讨论以制定个体化治疗方案,争取给患者带来最大的获益。
1 Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137-2150.
2 邹小农,孙喜斌.2003-2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
3 Van Cutsem E,Moiseyenko VM,Tjulandin S,et al.Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer:a report of the V325 Study Group[J].J Clin Oncol,2006,24(31):4991-4997.
4 Cunningham D,Starling N,Rao S,et al.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Engl J Med,2008,358(1):36-46.
5 高丹丹,刘 磊,白玉贤.晚期胃癌化疗及分子靶向治疗研究进展[J].中国肿瘤临床,2012,39(23):1978-1981.
6 Hartgrink HH,Putter H,Klein Kranenbarg E,et al.Value of palliative resection in gastric cancer[J].Br J Surg,2002,89(11):1438-1443.
7 杨学宁,吴一龙.实体瘤治疗疗效评价标准-RECIST[J].循证医学,2004,4(2):85-90.
8 Miner TJ,Jaques DP,Karpeh MS,et al.Defining palliative surgery in patients receiving noncurative resection for gastric cancer[J].J Am Coll Surg,2004,198(6):1013-1021.
9 Moehler M,Galle PR,Gockel I,et al.The multidisciplinary management of gastrointestinal cancer.Multimodal treatment of gastric cancer[J].Best Pract Res Clin Gastroenterol,2007,21(6):965-981.
10 Shridhar R,Almhanna K,Hoffe SE,et al.Increased survival associated with surgery and radiation therapy in metastatic gastric cancer:A Surveillance,Epidemiology,and End Results database analysis[J].Cancer,2013,[Epub ahead of print].
11 Sougioultzis S,Syrios J,Xynos ID,et al.Palliative gastrectomy and other factors affecting overall survival in stage IV gastric adenocarcinoma patients receiving chemotherapy:a retrospective analysis[J].Eur J Surg Oncol,2011,37(4):312-318.
12 Lim S,Muhs BE,Marcus SG,et al.Results following resection for stageⅣgastric cancer;are better outcomes observed in selected patient subgroups[J]?J Surg Oncol,2007,95(2):118-122.
13 Dittmar Y,Rauchfuss F,Goetz M,et al.Non-curative gastric resection for patients with stage 4 gastric cancer-a single center experience and current review of literature[J].Langenbecks Arch Surg,2012,397(5):745-753.
14 周爱萍,李玉升,杨 林,等.多西紫杉醇联合铂类和替吉奥治疗晚期胃癌的Ⅱ期临床研究[J].中华医学杂志,2012,92(24):1777-1779.
15 Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
(2013-04-17收稿)
(2013-08-07修回)
Clinical analysis of 32 metastatic gastric cancer patients who underwent surgery after chemotherapy
Yongkun SUN1,Lin YANG1,Yihebali CHI1,Jing HUANG1,Aiping ZHOU1,Xinghua YUAN2,Jianqiang CAI2,Jinwan WANG1
Lin YANG;E-mail:lyang69@sina.com
1Department of Medical Oncology,Cancer Hospital,ChineseAcademy of Medical Sciences,Beijing 100021,China
2Department ofAbdominal Surgery,Cancer Hospital,ChineseAcademy of Medical Sciences,Beijing 100021,China
Objective:To examine metastatic gastric cancer patients who underwent surgery after chemotherapy and to determine the factors affecting survival.Methods:Clinical data on metastatic gastric cancer patients who underwent surgery after chemotherapy were retrospectively analyzed.The overall survival data were evaluated through the Kaplan-Meier method,Log-rank test,and Cox hazards regression.Results:The median age was 46(22~74),and the median overall survival rate(OS)was 19 months(4~59 months).Response to chemotherapy(23.0 m for PR and 14.5 m for SD,P=0.045)and resection of the primary tumor(23.0 and 5.5 m,respectively,P=0.017)affected OS.No single factor was related to OS according to Cox regression.Conclusion:Surgical removal of the primary tumor is recommended for metastatic gastric cancer patients with positive response to chemotherapy and with a primary tumor that can be resected.
metastatic gastric cancer,chemotherapy,surgery,overall survival
10.3969/j.issn.1000-8179.20130603
①中国医学科学院北京协和医学院,肿瘤医院内科(北京市100021);②腹部外科
杨林 lyang69@sina.com
(本文编辑:杨红欣)
