EphrinA1-Fc对人肾透明细胞癌786-O细胞EphA2和ERK表达影响的研究*
2013-09-10徐金升白亚玲张俊霞崔立文张慧然张胜雷
徐金升 白亚玲 张俊霞 崔立文 张慧然 张胜雷
EphrinA1-Fc对人肾透明细胞癌786-O细胞EphA2和ERK表达影响的研究*
徐金升 白亚玲 张俊霞 崔立文 张慧然 张胜雷
目的:探讨EphrinA1-Fc对人肾透明细胞癌786-O细胞系促红细胞生成素产生肝细胞受体A2(EphA2)和细胞外调节蛋白激酶1/2(ERK1/2)磷酸化程度的影响。方法:应用可溶性配体EphrinA1-Fc干预人肾透明细胞癌786-O细胞系,采用Wstern blot方法分析不同时间点细胞内EphA2和ERK1/2的磷酸化程度。结果:EphrinA1-Fc干预5、10、30、60 min后,p-EphA2、p-ERK的相对表达量逐渐增加(F=9.392,P=0.025;F=4.428,P=0.041),p-EphA2、p-ERK在EphrinA1-Fc干预前均未见表达。结论:EphrinA1-Fc抑制肿瘤转移复发的可能机制之一是其促使肾透明细胞癌786-O细胞EphA2磷酸化而导致其降解实现。
EphrinA1-Fc 肾透明细胞癌细胞786-O EphA2 ERK 磷酸化
受体酪氨酸蛋白激酶是外界刺激信息传递至细胞核,转化成细胞效应信号通路的关键组成部分,参与细胞生长、增殖、转化及胚胎发育和肿瘤形成,具有重要生理功能。促红细胞生成素产生肝细胞受体(erythropoietin producing hepatocellular receptor,Eph)家族是一类新发现的酪氨酸蛋白激酶受体(receptor tyrosine kinase,RTK),近年来其在肿瘤发生和发展中所起的作用备受关注[1-2]。EphA2是其中最早被发现的一个成员,正常情况下,EphA2与其配体EphrinA1结合后导致二者均发生酪氨酸磷酸化而产生双向信号转导,通过其下游信号调节细胞正常的生长、发育,同时也促进EphA2受体自身降解。但在肿瘤组织中,因EphA2定位异常,不能与其配体正常结合,导致其无法正常降解而在肿瘤组织中异常堆积,促使肿瘤的转移复发。Nakamura等[3]研究显示用EphA2人工可溶性配体EphrinA1-Fc刺激胃癌细胞系可以导致EphA2蛋白表达降低以及EphA2磷酸化水平增加,并能够抑制肿瘤细胞的生长。但目前有关EphrinA1-Fc对肾癌细胞系影响的研究报道较少,本研究就EphrinA1-Fc对人肾透明细胞癌786-O细胞EphA2和ERK1/2磷酸化的影响进行探讨,以明确其抗肿瘤机制。
1 材料与方法
1.1 材料
1.1.1 裸鼠 SPF(无特定病原体)级雌性BALB/c-nu/nu小鼠8只,4~6周龄,体质量16~20 g,购自北京康蓝生物科技有限公司。BALB/c-nu/nu小鼠在河北医科大学第四医院动物实验中心屏障环境中饲养,以备后续实验使用。本动物实验已获河北医科大学第四医院伦理委员会认可。
1.1.2 主要仪器和试剂 EphA2、ERK1、ERK2兔抗人多克隆抗体及p-ERK鼠抗人单克隆抗体均购自Santa Cruz公司(美国),APDH兔抗人多克隆抗体购自上海晶美公司,重组鼠抗人EphrinA1-Fc嵌合体购自SYSTEMS公司(英国),IgG-Fc购自Jackson Immunoresearch Laboratiries Inc公司(美国),鼠抗人磷酸化酪氨酸单克隆抗体购自Cell Signaling公司(英国)。
1.2 方法
1.2.1 细胞培养 人肾透明细胞癌786-O细胞系由上海中科院细胞库提供。人肾透明细胞癌786-O细胞系使用含100 mL/L胎牛血清、100 U/mL青霉素和100 U/mL链霉素RPMI 1640培养液,于37℃、5%CO2、湿度饱和的培养箱培养,以0.25%胰蛋白酶消化细胞传代,每1~2天更换培养液1次,取对数生长期细胞随机分为实验组和对照组,分别用EphrinA1-Fc和IgG-Fc进行干预。
1.2.2 裸鼠移植瘤模型建立 收集对数生长期的肾透明细胞癌786-O细胞株,1 000 r/min离心5 min,制成单细胞悬液。调整细胞浓度为3×107/mL。用1 mL空针将细胞悬液注入裸鼠左、右腋皮下,0.2 mL/只,含细胞数6×106个,接种后观察注射部位出现结节时间。待裸鼠生长至接种后8周,出现清楚肿瘤界限,将接种成功的8只裸鼠随机分为2组,4只/组。实验组:肿瘤周围注射EphrinA1-Fc(2 mg/mL),0.1 mL/次,3次/周;对照组:注射IgG-Fc,0.1 mL/次,3次/周。实验于肿瘤细胞接种12周结束,干预治疗时间为4周。4周后取出瘤组织,福尔马林固定、石蜡包埋,以备后续实验。
1.2.3 Wstern blot 将收集的细胞加入细胞裂解液200 μL混匀,冰上静置30 min,4℃,11 000 r/min离心20 min,取其上清即为细胞总蛋白,测定细胞总蛋白的浓度。加入蛋白40 μg/孔,10%SDS-PAGE凝胶电泳,蛋白转移到PVDF膜上。5%脱脂奶粉的TTBS室温封闭1 h,一抗稀释于封闭液中,4℃摇晃过夜,TTBS漂洗3次,二抗稀释于封闭液中,室温摇晃1 h,TTBS漂洗3次。蛋白信号由DAB试剂盒检测。采用美国Kodak公司D凝胶成像分析系统对各区带进行定量分析。
1.2.4 EphA2免疫组织化学判断标准 按照S-P试剂盒说明书进行,EphA2免疫组织化学染色以胞浆或胞膜中出现棕黄色颗粒为阳性。结果由两位有经验的病理医师独立双盲评估,每张切片至少观察200个目的细胞的免疫反应情况,在高倍视野(×400)下观察每个目的细胞的染色强度并进行评分。阴性为0分(未着色),弱阳性为1分(浅黄色),阳性为2分(黄色),强阳性为3分(黄褐色)。计算每张切片的阳性细胞百分数,阳性细胞率(%)=(≥1分细胞数量)/(观察细胞总数)×100%。按文献报道的方法[4-5]计算每张切片的HSCORE分值。HSCORE=(i+1)π,其中i代表细胞染色的阳性强度(阳性强度采用0、1、2、3分表示),π代表阳性细胞的百分数(采用0~100%表示)。HSCORE分值>100%为高表达,≤100%为低表达。
1.3 统计学处理
2 结果
2.1 EphrinA1-Fc干预后肾透明细胞癌786-O细胞形态学变化
正常条件下培养的人肾透明细胞癌786-O细胞接受可溶性配体EphrinA1-Fc刺激1 min,细胞形态即发生改变,细胞由梭形伸展状态开始回缩;5 min时部分细胞变圆;30 min时90%细胞变圆,与瓶壁结合疏松;40 min时部分细胞重新伸展、粘附于瓶壁;60 min时90%细胞恢复到刺激前状态,对照组细胞形态学未发生明显变化。
2.2 EphrinA1-Fc对人肾透明细胞癌786-O细胞内EphA2和p-EphA2、ERK和p-ERK表达的影响
EphrinA1-Fc干预5、10、30、60 min后,p-EphA2相对表达量(p-EphA2/EphA2比值)在5 min时开始出现,并逐渐增高,30 min时达最高。EphrinA1-Fc干预前未见p-EphA2表达(P>0.05)。p-ERK的相对表达量(p-ERK与ERK1/2比值)在5 min时开始出现,并逐渐增高,30 min时达最高。EphrinA1-Fc干预前未见p-ERK表达(图1,2)。
2.3 EphrinA1-Fc对裸鼠人肾癌细胞移植瘤体积及移植瘤EphA2表达的影响
EphrinA1-Fc干预治疗4周后,移植瘤体积较对照组明显减小,差异有统计学意义(P<0.05,图3)。免疫组织化学结果显示:EphA2蛋白阳性表达于胞浆或胞膜,实验组移植瘤组织内EphA2蛋白高表达率明显低于对照组,差异有统计学意义(P<0.05,图4,表1)。
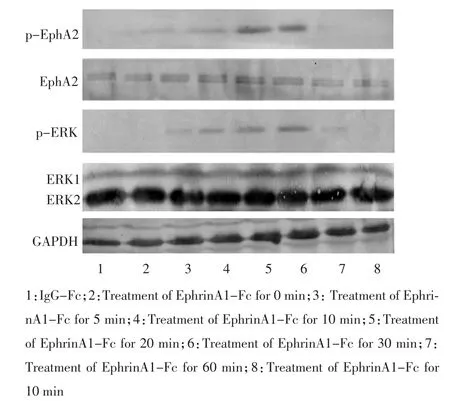
图1 Western blot检测EphrinA1-Fc干预肾透明细胞癌786-O细胞后胞浆内p-EphA2、EphA2、p-ERK和ERK1/2表达情况Figure 1 Expression of p-EphA2,EphA2,p-ERK,and ERK1/2 in the renal clear cells 786-O stimulated by EphrinA1-Fc(Western blot)
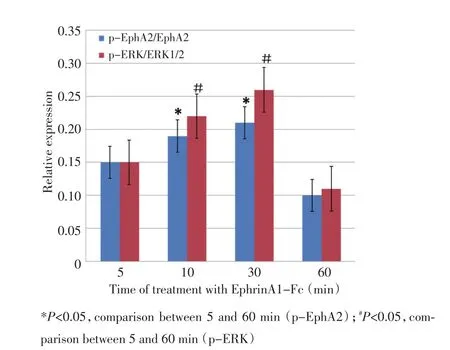
图2 EphrinA1-Fc干预肾透明细胞癌786-O细胞后胞浆内p-EphA2、p-ERK相对表达量Figure 2 Comparison of the expression of p-EphA2,EphA2,p-ERK,and ERK1/2 in the renal clear cells 786-O stimulated by EphrinA1-Fc
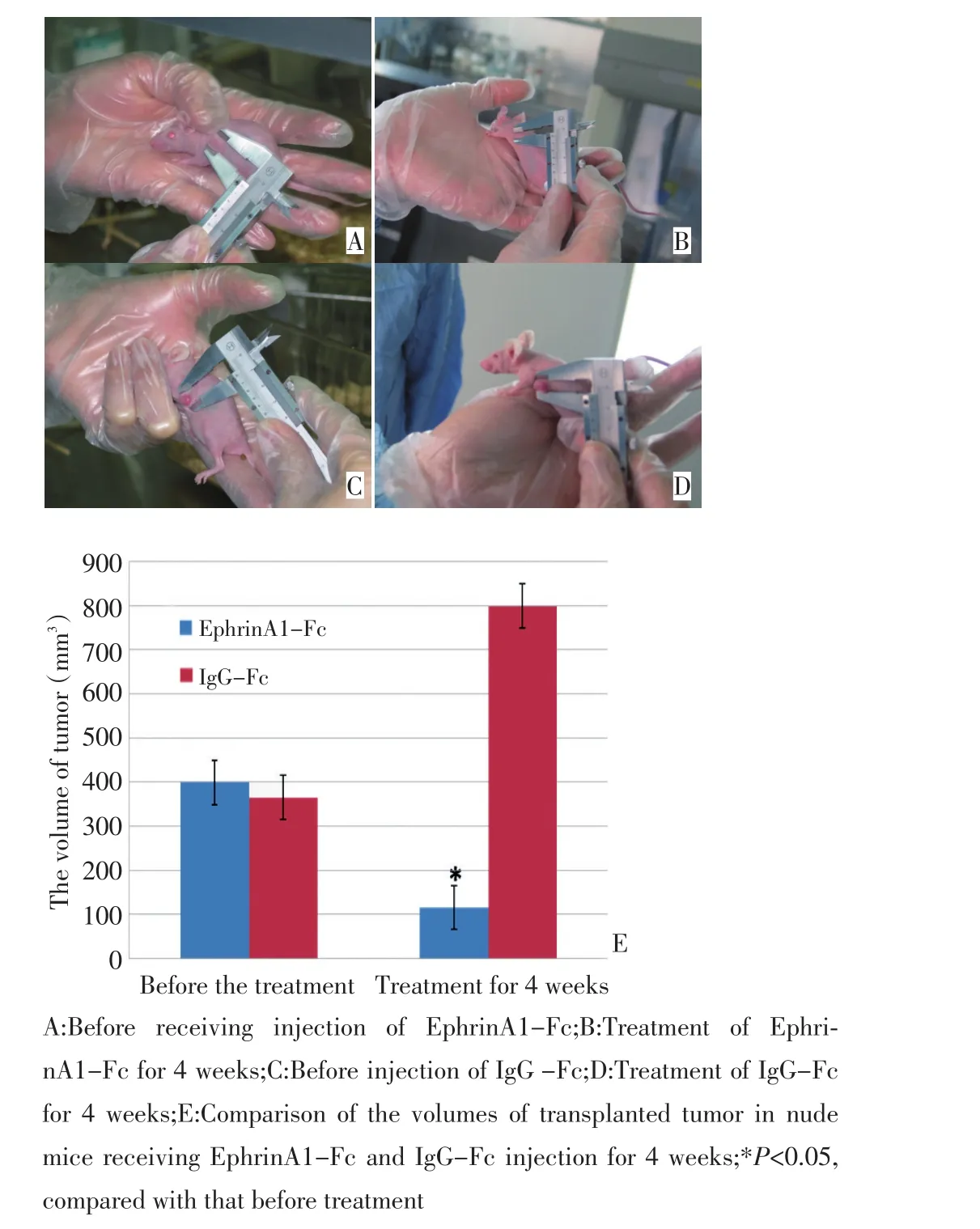
图3 EphrinA1-Fc和IgG-Fc干预移植瘤4周前后移植瘤体积的变化Figure 3 Change in the volumes of transplanted tumor in nude mice receiving EphrinA1-Fc and IgG-Fc injection for 4 weeks
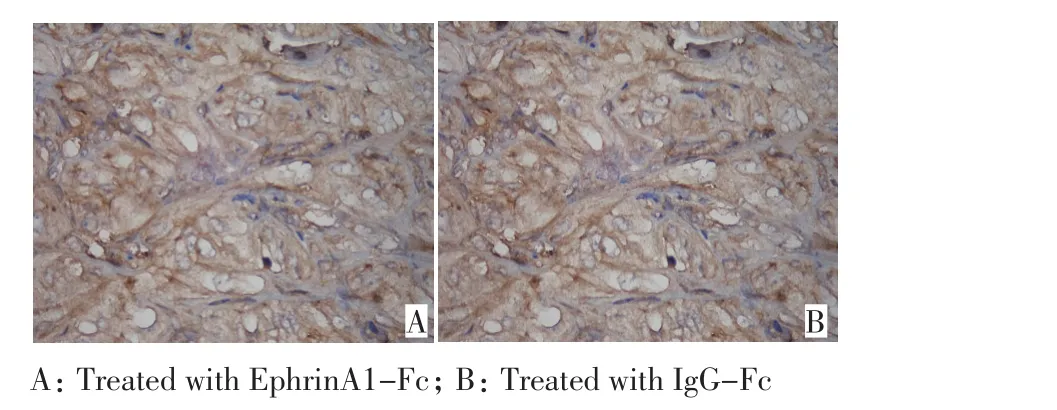
图4 EphrinA1-Fc和IgG-Fc干预移植瘤4周后EphA2表达情况(S-P×400)Figure 4 Expression of EphA2 in the transplanted tumor stimulated by EphrinA1-Fc and IgG-Fc for 4 weeks(S-P×400)
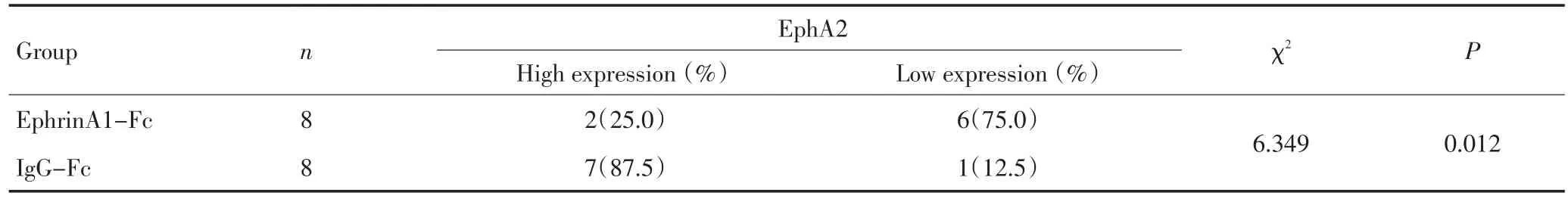
表1 EphrinA1-Fc和IgG-Fc对移植瘤EphA2表达影响的比较Table 1 Expression of EphA2 in the transplanted tumor stimulated by EphrinA1-Fc and IgG-Fc
3 讨论
本课题前期研究成果显示:EphA2/EphrinA1在肾癌中高表达,并且随着肾癌恶性程度的增加其表达增高。EphA2/EphrinA1在肿瘤的转移复发过程中起着重要作用[6]。近期研究发现,EphrinA1-Fc单克隆抗体刺激恶性肿瘤细胞能阻止肿瘤细胞在软琼脂上聚集[7-8]。EphrinA1-Fc是EphrinA1的模拟配体,是由鼠源EphrinA1胞外区的多聚肽链连接到人源IgG羟基末端的Fc区域而形成[9],EphrinA1-Fc可与肿瘤细胞膜上的EphA2受体特异性结合而发挥生物学效应。本研究通过观察EphrinA1-Fc干预肾透明细胞癌786-O细胞后形态学改变,与对照组比较发现EphrinA1-Fc对肿瘤细胞具有一定的抑制作用,其作用特点是快速而短暂。又根据EphrinA1-Fc作用的特点,利用EphrinA1-Fc反复干预裸鼠移植瘤,治疗4周后与对照组比较,治疗组的移植瘤体积明显缩小,进一步验证了EphrinA1-Fc抑制肿瘤的作用。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路代表了一连串磷酸化级联事件,涉及3种关键激酶,即MAPK激酶的激酶(MAPKKK)、MAPK激酶(MAPKK)、MAPK[10]。在真核细胞中,已经发现细胞外调节蛋白激酶(ERK),JNK/SAPK及p38MAPK三条MAPK信号转导通路。其中JNK和p38MAPK两条通路主要与细胞的应激和凋亡有关;ERK(包括ERK1和ERK2)通路是细胞外信号转导至细胞核的关键,其主要与细胞的增殖和分化有关[11-12]。鉴于此,本研究观察了EphrinA1-Fc对肾癌细胞EphA2和ERK及其磷酸化的影响。本研究发现,EphrinA1-Fc干预后EphA2、ERK1/2在各时间点的表达无明显差别,而磷酸化EphA2、ERK却不同,其磷酸化程度呈时间依赖性,随着时间的延长,磷酸化程度逐渐增强,在30 min时效应达到最大,提示EphrinA1-Fc可促使EphA2磷酸化,也提示其作用时间是快速和短暂的,此种现象与研究观察的细胞形态变化是一致的,同时在裸鼠移植瘤模型上证实了EphrinA1-Fc可降低裸鼠移植瘤EphA2的表达。Yang等[13]研究发现,EphA2配体或抗体的刺激能快速而显著地降低细胞与细胞外基质的粘附,本实验结果与其近似。但本研究还发现EphrinA1-Fc可促使ERK发生磷酸化,ERK的磷酸化通常代表Ras/Raf/MAPK通路的激活,细胞增殖加快,粘附性增强,使癌细胞更容易发生侵袭和转移,与EphrinA1-Fc表现出来的抗肿瘤效应相矛盾,分析原因可能是EphrinA1-Fc降解EphA2而抑制细胞生长,进而反馈性激活细胞内Ras/Raf/MAPK通路而对抗EphrinA1-Fc抑制细胞增殖作用,其具体机制有待于进一步研究。
综上所述,EphrinA1-Fc通过促使肾透明细胞癌786-O细胞EphA2受体发生磷酸化而使其降解加速,下调细胞中总EphA2蛋白,进而抑制肿瘤细胞的生长。EphrinA1-Fc有望成为特异性针对EphA2蛋白的抗肿瘤特效药。
1 Lema Tomé CM,Palma E,Ferluga S,et al.Structural and functional characterization of monomeric EphrinA1 binding site to EphA2 receptor[J].J Biol Chem,2012,287(17):14012-14022.
2 Himanen JP,Goldgur Y,Miao H,et al.Ligand recognition by A-class Eph receptors:crystal structures of the EphA2 ligand-binding domain and the EphA2/ephrin-A1 complex[J].EMBO Rep,2009,10(7):722-728.
3 Nakamura R,Kataoka H,Sato N,et al.EPHA2/EFNA1 expression in human gastric cancer[J].Cancer Sci,2005,96(1):42-47.
4 Singh M,Zaino RJ,Filiaci VJ,et al.Relationship of estrogen and progesterone receptors to clinical outcome in metastatic endometrial carcinoma:a Gynecologic Oncology Group Study[J].Gynecol Oncol,2007,106(2):325-333.
5 Merritt WM,Lin YG,Han LY,et al.Dicer,Drosha,and outcomes in patients with ovarian cancer[J].N Engl J Med,2008,359(25):2641-2650.
6 徐金升,王悦芬,李亚林,等.肾癌中EphA2/EphrinA1和E-cadherin的表达及其意义[J].中国肿瘤临床,2008,35(22):1276-1280.
7 Gökmen-Polar Y,Toroni RA,Hocevar BA,et al.Dual targeting of EphA2 and ER restores tamoxifen sensitivity in ER/EphA2-positive breast cancer[J].Breast Cancer Res Treat,2011,127(2):375-384.
8 Ishikawa M,Miyahara R,Sonobe M,et al.Higher expression of EphA2 and ephrin-A1 is related to favorable clinicopathological features in pathological stage I non-small cell lung carcinoma[J].Lung Cancer,2012,76(3):431-438.
9 Tognolini M,Giorgio C,Hassan Mohamed I,et al.Perturbation of the EphA2-EphrinA1 system in human prostate cancer cells by colonic(poly)phenol catabolites[J].J Agric Food Chem,2012,60(36):8877-8884.
10 Huang D,Ding Y,Luo WM,et al.Inhibition of MAPK kinase signaling pathways suppressed renal cell carcinoma growth and angiogenesis in vivo[J].Cancer Res,2008,68(1):81-88.
11 Poddar R,Paul S.Novel crosstalk between ERK MAPK and p38 MAPK leads to homocysteine-NMDA receptor-mediated neuronal cell death[J].J Neurochem,2013,124(4):558-570.
12 An J,Liu H,Magyar CE,et al.Hyperactivated JNK is a therapeutic target in pVHL-deficient renal cell carcinoma[J].Cancer Res,2013,73(4):1374-1385.
13 Yang NY,Fernandez C,Richter M,et al.Crosstalk of the EphA2 receptor with a serine/threonine phosphatase suppresses the Akt-mTORC1 pathway in cancer cells[J].Cell Signal,2011,23(1):201-212.
(2013-03-14收稿)
(2013-06-17修回)
Effect of EphrinA1-Fc on phosphorylation of EphA2 and ERK in 786-O renal carcinoma cells
Jinsheng XU,Yaling BAI,Junxia ZHANG,Liwen CUI,Huiran ZHANG,Shenglei ZHANG
Yaling BAI;E-mail:snbyl@163.com
Department of Nephrology,The Fourth Hospital of Hebei Medical University,Shijiazhuang 050000,China
Objective:To detect the effect of EphrinA1-Fc on the phosphorylation of EphA2 and extracellular signal-regulated kinase(ERK)in 786-O renal carcinoma cells(RCCs).Methods:The soluble ligand EphrinA1-Fc was used to inhibit the 786-O RCCs in vitro.Western blot analysis was used to examine the phosphorylation of EphA2 and ERK1/2 in the 786-O RCCs at different time points.Results:After the intervention with EphrinA1-Fc for 5,10,30,and 60 min,the expression of p-EphA2 increased(F=9.392,P=0.025)as well as that of p-ERK(F=4.428,P=0.041).No p-EphA2 and p-ERK expression was observed in the pre-intervention group.Conclusion:One of the possible mechanisms of the inhibitory effect of EphrinA1-Fc on tumor metastasis and recurrence involves the phosphorylation of EphA2 by EphrinA1-Fc,leading to the degradation of EphA2.
EphrinA1-Fc,786-O renal carcinoma cells,EphA2,ERK,phosphorylation
10.3969/j.issn.1000-8179.20130415
河北医科大学第四医院肾内科(石家庄市050000)
*本文课题受河北省科技计划项目(编号:10276177)资助
白亚玲 snbyl@163.com
This work was supported by the Project of Hebei Natural Science Fund(No.10276177)
(本文编辑:张亻 刡)
