羽衣甘蓝甘油-3-磷酸酰基转移酶基因的克隆及序列分析
2013-09-08李丽丽祝红艳陈丽静郭志富
马 慧 李丽丽 祝红艳 陈丽静 钟 鸣 郭志富
(沈阳农业大学生物科学技术学院,辽宁省农业生物技术重点实验室,辽宁沈阳 110161 )
羽衣甘蓝甘油-3-磷酸酰基转移酶基因的克隆及序列分析
马 慧 李丽丽 祝红艳 陈丽静 钟 鸣 郭志富
(沈阳农业大学生物科学技术学院,辽宁省农业生物技术重点实验室,辽宁沈阳 110161 )
以羽衣甘蓝品种白孔雀为试验材料,通过同源克隆和RACE方法从低温诱导的羽衣甘蓝幼苗中分离得到了羽衣甘蓝甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)基因的全基因序列,采用生物学软件对该序列 进行生物信 息学分析。结果表明:该基因全长1 558 bp,推测其编码451个氨 基酸,并命名为BaGPAT。序列分析发现,羽衣甘蓝BaGPAT基因推导的氨基酸与已知其他植物GPAT基因序列有54%~85%的相似性。聚类分析结果显示:羽衣甘蓝GPAT(BaGPAT)基因与拟南芥和宽叶独行菜GPAT基因亲缘关系较近。
羽衣甘蓝;冷诱导;甘油-3-磷酸酰基转移酶(GPAT);基因克隆
低温是限制植物生长和产量形成的重要因素之一,生物膜的膜脂不饱和度是植物抗寒性的重要生理指标。甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)基因是磷酰甘油生物合成过程中的第1个酰基酯化酶基因,对决定植物膜的不饱和度起关键作用,与植物抗寒性密切相关。目前已从许多植物如豌豆、拟南芥、红花、南瓜、黑籽南瓜、水稻、菠菜、黄瓜、柑橘类植物、百合(Lyons,1973;Murata et al.,1992;Wolter et al.,1992;Ishitani et al.,1998;杨明挚 等,1999;刘继梅 等,2000;Ariizumi et al.,2002;Tamura et al.,2007;吴波和刘勇,2010;陈丽静 等,2011)中克隆到GPAT基因片段甚至全基因序列,并研究了其部分功能,但是在甘蓝类植物中未见该基因克隆和功能分析的报道。
羽衣甘蓝(Brassica oleraceaL. var.acephalaDC.) 为十字花科芸薹属甘蓝种的一个变种,喜冷凉气候,耐寒性强,适于冬季花坛美化和盆栽,是我国北方冬季重要的观赏植物。近年来对羽衣甘蓝的抗寒性研究多集中在生理生化方面,对于羽衣甘蓝的抗寒性分子机理以及如何提高其对低温胁迫的抗性等方面的研究均较少。本试验以耐寒性较强的羽衣甘蓝品种白孔雀为试材,通过同源克隆和RACE技术克隆得到其GPAT基因,经测序正确后对该序列进行了同源性分析,并且根据对应氨基酸序列进行了聚类分析,以期为羽衣甘蓝抗寒机制研究提供分子生物学依据。同时,本试验获得了羽衣甘蓝抗寒功能基因,对今后利用基因工程技术改良植物抗寒性,培育抗寒新品种具有潜在的重要意义。
1 材料与方法
1.1 材料
供试羽衣甘蓝品种为白孔雀,由沈阳农业大学林学院祝鹏芳老师提供。试验于2012年春季在沈阳农业大学进行,将羽衣甘蓝种子播于育苗穴盘中,置于大棚中培养。当幼苗长至2~3片叶时,进行4 ℃低温处理,16 h后取 样,置于超低温冰箱中保存备用。
1.2 菌株与质粒
大肠杆菌菌株E.coliTop10为沈阳农业大学140实验室保存;T载体 pGM18-T vector 购于天根生化科技(北京)有限公司。
1.3 酶和试剂
DNA marker、T4DNA连接酶、pGM-18T载体、IPTG、X-Gal、PrimeScriptTM反转录试剂盒为宝生物工程(大连)公司产品,M-MLV反转录酶购自Promage公司,琼脂糖凝胶回收试剂盒购自Axygen公司,RNAprep pure Plant Kit试剂盒、Taq酶为天根生化科技(北京)有限公司产品,DEPC为Promaga公司产品。
所用引物(表1)的合成由赛百盛公司完成,测序由天根生化科技(北京)有限公司、上海美吉生物医药科技有限公司完成。

表1 羽衣甘蓝GPAT基因克隆所用引物
引物设计采用Primer 5.0软件,序列分析采用DNAMAN和MAGE 4.0软件。
1.4 试验方法
1.4.1 羽衣甘蓝总RNA的提取及cDNA第一链的合成 利用植物总RNA提取试剂盒( RNAprep pure Plant Kit)提取经冷诱导处理的羽衣甘蓝总RNA。cDNA第一链的合成采用M-MLV Reverse Transcriptase试剂盒合成,-20 ℃保存。
1.4.2 羽衣甘蓝GPAT基因的克隆、鉴定及测序 在Genbank中广泛查询GPAT基因的相关序列信息,设计GPAT基因的简并性引物GPATF1、GPATR1、GPATF2、GPATR2。以反转录得到的cDNA为模板,进行巢式扩增,得到中间片段。
扩增中间保守区片段反应体系(25 μL):cDNA/第1轮产物2 μL,10×PCR buffer 2.5 μL,dNTP 0.5 μL(10 mmol·L-1),上下游引 物 各 1 μL(10 μmol·L-1),TaqDNA 酶 0.5 μL,加ddH2O至25 μL。反应条件:94 ℃,5 min;94 ℃,30 s,53 ℃,45 s,72 ℃,60 s,35个循环;72 ℃,10 min。以3′通用引物1反转录获得的cDNA为模板,以GPAT3-1、GPAT3-2为上游引物,以3′通用引物2为下游引物进行巢式扩增,直到得到单一清晰的3′目的片段。
3′RACE 反应体系(25 μL)同上。反应条件: 94 ℃,5 min;94 ℃,30 s,60 ℃,30 s,72 ℃,60 s,34 个循环;72 ℃,10 min。
根据已克隆出的GPAT基因序列,在起始密码子处设计上游引物,采用嵌套PCR扩增GPAT 5′端。反应条件:94 ℃,5 min;94 ℃,30 s,58 ℃,30 s,72 ℃,90 s,34个循环;72 ℃,10 min。
PCR产物经1%琼脂糖凝胶电泳检测,回收纯化目的片段。将回收的PCR产物与pGM-18T vector连接,转化大肠杆菌Top10感受态细胞,菌落在含有X-gal和IPTG的LB(Amp+)固体培养基上进行蓝白斑筛选,随机挑取8~10个阳性克隆,在LB(Amp+)固体培养基上划线培养后进行菌落PCR鉴定。
鉴定结果为阳性的克隆菌株穿刺到含有LB(Amp+)固体培养基的离心管中,由天根生化科技(北京)有限公司进行序列测定。用Blast 和DNAMAN软件进行序列比较,用MEGA4.0软件构建进化树。
2 结果与分析
2.1 羽衣甘蓝GPAT基因的克隆
以羽衣甘蓝cDNA为模板,简并引物G PATF、GPATR扩增出约700 bp的部分保守区片段(图1),在获得的保守区设计反向引物和正向引物分别进行5′RACE和3′RACE扩增,得到3′端片段约680 bp(图2)和5′端片段约750 bp(图3)。
使用DNAMAN软件进行序列拼接后,得到羽衣甘蓝甘油-3-磷酸酰基转移酶基因的全长cDNA序列,命名为BaGPAT。
2.2 羽衣甘蓝BaGPAT基因序列分析
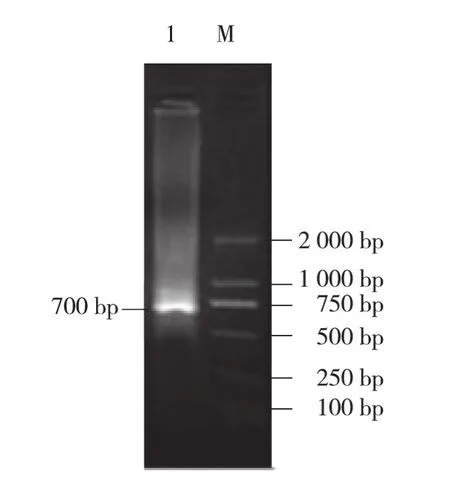
图1 保守区序列扩增结果
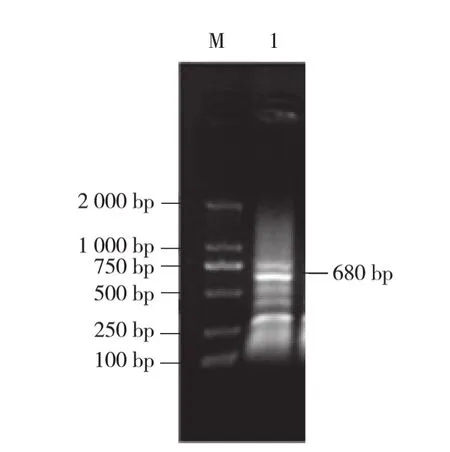
图 2 3′ RACE 扩增结果

图 3 5′ RACE 扩增结果
将拼接得到的羽衣甘蓝GPAT基因(BaG-PAT)经DNAMAN软件分析,找到起始密码子和终止密码子,发现是2个具有完整编码区的cDNA,由此得出GPAT基因是基因家族。用 Blast 软件进行同源性比较,发现这2个基因的核苷酸序列与拟南芥、宽叶独行菜、南瓜、蓖麻、甜椒等植物中的GPAT基因均具有较高的同源性,这表明已经成功地克隆到了羽衣甘蓝GPAT基因序列。
羽衣甘蓝GPAT1和GPAT2基因序列已经在GenBank注册(KC013241和KC013242),并分别命名为BaGPAT1和BaGPAT2。初步分析羽衣甘蓝GPAT1和GPAT2基因全长均为1 558 bp,编码451个氨基酸。
从氨基酸比对结果可以看出(图4),羽衣甘蓝GPAT1和GPAT2对应的氨基酸序列在N末端差异比较大,氨基酸序列间有90%的相似度。
将得到的BaGPAT1和BaGPAT2基因的氨基酸序列进行多序列比对分析,截取部分相似性较高的比对结果。由图5可以看出:存在1个高度保守的区域(WIAPSGGRDRP),这段保守区域为LPLAT基因超级家族酶类的催化活性区,此家族多为催化酰基辅酶A(acylCoAs)或者酰基载体蛋白(acylCoACPs)中的酰基与受体蛋白结合的酰基转移酶类。
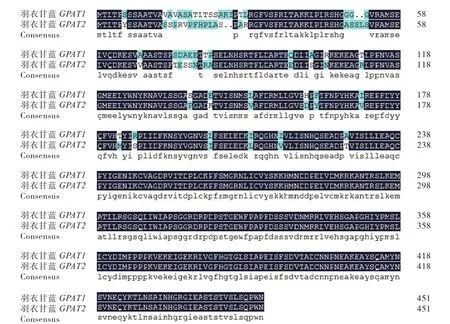
图4 羽衣甘蓝GPAT1与GPAT2基因氨基酸序列比对结果

图5 羽衣甘蓝BaGPAT基因氨基酸序列比对的部分结果
分别将由BaGPAT1和BaGPAT2基因推导的氨基酸序列和已知其他植物的GPAT基因推导的氨基酸序列进行相似性比较。由表2可见,BaGPAT1和BaGPAT2与已知其他植物GPAT基因序列的相似性为54%~85%;其中与拟南芥相似性最高,为85%和84%;其次是宽叶独行菜、日本蜜柑和南瓜,相似性都在60%以上。由此比对结果可以看出,羽衣甘蓝GPAT基因与拟南芥、宽叶独行菜等十字花科植物基因的同源性较高。
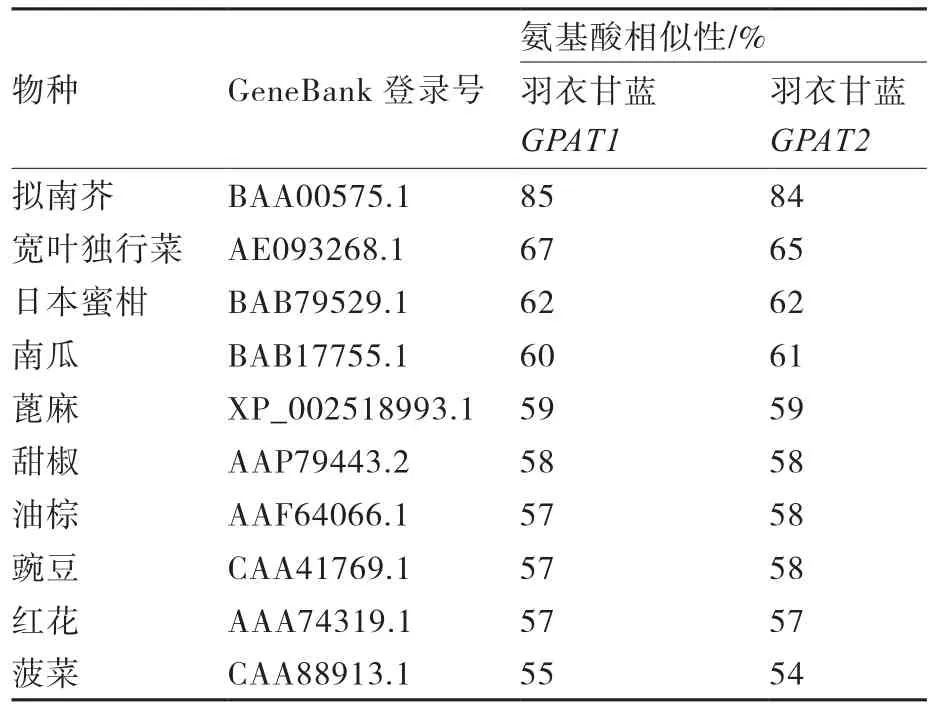
表2 羽衣甘蓝BaGPAT基因氨基酸序列相似性比对结果
2.3 羽衣甘蓝BaGPAT基因氨基酸序列聚类分析
为了进一步研究不同物种GPAT蛋白之间的进化关系,使用Clustalx软件和njpot软件进行聚类分析。结果显示(图6):羽衣甘蓝GPAT(BaGPAT)基因与拟南芥和宽叶独行菜GPAT基因的亲缘关系较近,氨基酸相似性分别达到80%、60%以上,和红花、菠菜GPAT基因的亲缘关系较远,这与序列同源性比对结果一致。
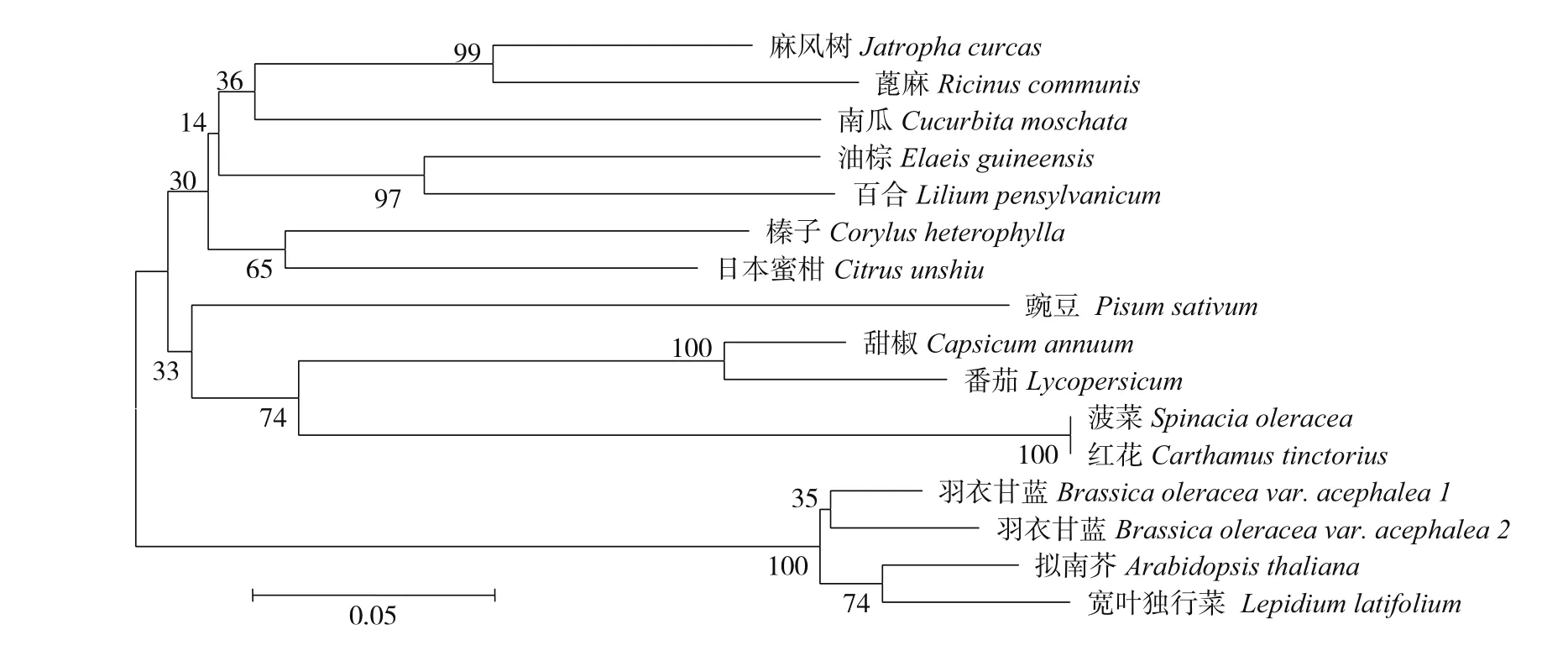
图6 羽衣甘蓝BaGPAT基因氨基酸序列的系统进化树
3 结论与讨论
本试验中克隆的羽衣甘蓝BaGPAT基因编码蛋白的氨基酸序列在260~270 Da、30 0~320 Da、380~390 Da 3个氨基酸区段多为疏水性、带电荷或有活性基团等的氨基酸,如丝氨酸、赖氨酸、组氨酸、半胱氨酸,大多位置比较集中。这些氨基酸极可能与抗寒性植物中GPAT对C18∶1的优先选择性有关。由氨基酸序列比对分析结果可以看出:羽衣甘蓝GPAT基因上述3个位点上的氨基酸序列与拟南芥等植物相似性较高,这与系统进化分析结果一致,从而推知羽衣甘蓝具有较强的抗寒性。研究表明:GPAT基因间的差异不仅与生长环境和自身的抗寒性有着密切的联系,并且可能存在多基因家族。Frentzen 等(1987)在南瓜叶绿体中发现了3种不同的GPAT基因,它们在对应氨基酸的N端有明显的差异。说明基因的重复、置换或缺失在进化过程中实际上是频繁发生的,直接导致了所编码的氨基酸产生差异(Kianian & Quiros,1992)。本试验克隆得到的两个GPAT基因cDNA序列,虽然都编码451个氨基酸,但是在N末端出现差异。完全相同的氨基酸残基有407个,约占90%。氨基酸序列N末端的差异对于羽衣甘蓝抗寒能力是否产生影响需要通过进一步的功能验证。
在GPAT氨基酸序列中还存在1个高度保守的区域(WIAPSGGRDRP),在NCBI上经过Blast比对分析,发现这段保守区域序列为LPLAT基因超级家族酶类的催化活性区,此家族多为催化酰基辅酶A(acylCoAs)或者酰基载体蛋白(acylCoACPs)中的酰基与受体蛋白结合的酰基转移酶类,用于将脂肪酰基转移到3-磷酸甘油的C-1位上合成1-酰基-sn甘油-3-磷酸(溶血磷脂酸),对决定植物膜PG的不饱和度起关键作用,从而决定了植物的抗寒性。
本试验从羽衣甘蓝中克隆到甘油-3-磷酸酰基转移酶基因(GPAT),下一步将进行GPAT基因功能研究,为全面了解羽衣甘蓝的抗寒机理,进一步通过转基因途径提高羽衣甘蓝抗寒能力奠定理论基础。
陈丽静,孙春玉,钟鸣,阮燕晔,明军,雷家军.2011.冷胁迫下王百合GPAT基因保守区克隆及表达分析.西北植物学报,31(9):1726-1731.
刘继梅,陈善娜,鄢波,黄兴奇,杨明挚.2000.不同抗冷性水稻中编码甘油-3-磷酸转酰酶的部分cDNA的序列比较研究.云南植物研究,22(3):317-321.
吴波,刘勇.2010.柑橘类植物GPAT基因片段克隆和SNP分析.江西农业大学学报,32(1):51-56.
杨明挚,陈善娜,鄢波,刘继梅,黄兴奇.1999.黑籽南瓜甘油-3-磷酸酰基转移基因的克隆及系列分析.云南植物研究,21(2):139-143.
Ariizumi T,Kishitani S,Inatsugi R,Nishida I,Murata N,Toriyama K.2002.An increase in unsaturation of fatty acids in phosphatidylglycerol from leaves improves the rates of photosynthesis and growth at low temperatures in transgenic in rice seedlings.Plant & Cell Physiology,43(7):751-758.
Frentzen M,Nishida I,Murata N.1987.Properties of the plastidial acyl-(acyl-carrier-protein):glycerol-3-phosphate acyltransferase from the chilling-sensitive plant squash Cucurbita moschata.Plant Cell Physio,28:1195-1201.
Ishitani M,Xiong L,Lee H,Stevenson B,Zhu J K.1998.HOS1a genetic locus involved in cold-responsive gene expression in Arabidopsis.Plant Cell,10:1151-1161.
Kianian S F,Quiros C F.1992.Generation of aBrassica oleraceacomposite RFLP map:linkage arranagements among various population and evolutionary implications.Theoretical and Applied Genetics,84:544-554.
Lyons J M.1973.Chilling injury in plants.Ann Rev Plant Physiol,24:445-466.
Murata N,Ishizaki N O,Higashi S.1992.Genetically engineered alteration in the chilling sensitivity of plants.Nature,36(6371):710-713.
Tamura K,Dudley J,Nei M,Kumar S.2007.MEGA4:molecular evolutionary genetics analysis(MEGA) software version 4.0.Mol Biol Evol,24:1596-1599.
Wolter F P,Schmidt R,Heniz E.1992.Chilling sensivity ofArabidopsis thalianawith genetically engineered membrane lipids.Eur Mol Biol Organ J,11(13):4685-4692.
Cloning and Sequencing Analysis of Glycerol-3-phosphate Acyltransferase Gene of Brassica oleracea L. var. acephalea DC.
MA Hui,LI Li-li,ZHU Hong-yan,CHEN Li-jing,ZHONG Ming,GUO Zhi-fu
(College of Biological Science and Technology,Shenyang Agricultural University,Key Laboratory of Agricultural Biotechnology of Liaoning Province,Shenyang 110161,Liaoning,China)
WithBrassica oleraceaL. var.acephaleaDC. variety‘Baikongque’as experimental material,by homology cloning and RACE method,we isolated from low temperature induction ofBrassica oleraceaL. var.acephaleaDC. seedlings the full gene sequences ofBrassica oleraceaL. var.acephaleaDC. glycerin-3-phosphate acyltransferase (GPAT) gene,and analyzed the sequences for bioinformatics by biology software.The results show that this gene is 1 558 bp in length,speculated encoding 451 amino acids,and is namedBaGPAT.TheBaGPATgene sequence has 54%-85%similarities in amino acids,when compared with other species in sequencing analysis.The results of clustering analysis show that the genetic relationship ofBaGPAT,Arabidopsis thalianaGPATandLepidium latifolium GPATis closer.
Brassica oleraceaL. var.acephaleaDC. ;Cold induced;Glycerin-3-phosphate acyltransferase (GPAT);Gene cloning
S635.9
A
1000-6346(2013)08-0032-07
2013-01-06;接受日期:2013-02-28
辽宁省重点实验室项目
马慧,女,副教授,主要从事细胞分子生物学方面的研究,E-mail:mahui1972@163.com
致谢:本试验材料由沈阳农业大学林学院祝鹏芳老师提供,特此表示感谢。
