基质养分对寄生植物南方菟丝子生长的影响
2013-09-07李钧敏
张 静,李钧敏,闫 明
(1.山西师范大学生命科学学院,临汾 041004;2.台州学院生态研究所,临海 317000)
群落中各营养级的交互作用及其在群落结构形成中的重要作用是生态学研究的一个热点[1]。上行效应是指较低营养阶层的密度、生物量等决定较高营养阶层的种群和群落结构。上行效应调控的驱动力包括资源的供给和环境因素等,前者如供给捕食动物资源的被捕食者;而后者如温度等。现已有一些研究关注不同营养级在个体水平的上行效应与下行效应[2-3],以期为群落的上行与下行效应提供基础理论依据。近年来,营养级联效应即多营养级(三营养级以上)之间的相互作用受到了较多的关注[4],但总体来说这一领域的研究并不多。
寄生植物是生态系统的特殊组成类群之一,常见于天然群落中[5]。寄生植物由于根系或叶片退化,或是缺乏足够的叶绿素,常寄生于寄主植物的根或茎上吸取水分、营养和碳水化合物而存活[6]。寄生植物作为一种特殊的消费者,与天然群落中的其它营养级之间也存在一定的相互作用[7],如寄生植物可间接影响食草昆虫、草食动物及土壤微生物等[5]。但是目前尚未见资源供给对寄生植物生长的影响的相关报道。已有一些研究发现资源供给,如氮素等,可以影响草食动物的生长、发育和繁殖能力[8-9]。寄生植物与寄主植物的相互作用与草食动物与植物之间的相互作用在多方面存在相似性,是一种平行的行为[10]。根据寄生植物的这一特性及营养级联的相关理论,可以推测资源供给可以促进寄生植物的生长。
菟丝子属植物为旋花科(Convolvulaceae)全寄生植物[11]。研究发现菟丝子属(Cuscuta)植物是一种良好的入侵植物防治剂,如田野菟丝子为菟丝子属的全寄生植物,可以通过降低薇甘菊的光合速率、蒸腾速率、叶绿素含量、生物量等,进一步严重影响薇甘菊茎叶生长及开花结实,抑制入侵植物薇甘菊的生长与繁殖,从而降低薇甘菊在群落中的优势地位,恢复本地群落的生物多样性,达到防治薇甘菊持续蔓延的目的[12-15]。野外调查发现南方菟丝子(Cuscuta australis R.Br.)可以寄生入侵植物,抑制入侵植物生长,促进本地植物群落的恢复,达到防治入侵植物的目的[14,16]。本文以南方菟丝子和入侵植物三叶鬼针草(Biden pilosa L.)为研究对象,采用盆栽实验分析基质养分(施肥与不施肥)对寄生植物生长的影响,分析资源供给对寄生植物各部分生长的影响,并分析寄生植物生物量与寄主生长、生物量分配格局及光源捕获能力的相关性,以阐明两个科学问题:1)基质养分是否可以促进寄生植物的生长?2)其可能的机制是什么?本研究结果不仅可以为研究寄生植物与其它营养级之间的相互作用提供理论参考,而且可以为在群落水平进一步研究资源供给对寄生植物的上行效应提供基础理论依据。同时,本研究结果对采用寄生植物防治入侵植物具有一定实践指导价值。
1 材料和方法
1.1 实验材料
土壤采集于临海市野外本地群落,与河砂2∶1混合,备用。土壤pH值为7.12±0.02,有机质含量为(19.93±4.46)g/kg,总氮含量为(45.85±0.96)mg/kg,速效磷含量为(39.92±8.37)mg/kg,速效钾含量为(62.33±3.06)mg/kg。
三叶鬼针草种子于2009年11月在浙江省临海市野外收集,贮存于低湿种子贮藏箱中。
南方菟丝子由本实验室培养在台州学院生态园的植物人工群落中(2 m×2 m)。
1.2 实验处理
2010年7月在温室中进行三叶鬼针草种子的萌发和幼苗的培养。2010年8月,选取长势一致的三叶鬼针草幼苗(株高15 cm)移栽到塑料花盆(直径28 cm,高38 cm,盆底有孔以正常漏水)中,每盆1株。将花盆随机放置在温室中,每天早晚各浇灌等量的水1次。幼苗存活1周后,采用完全随机的区组实验设计方法,将植株分为两组:对照组和处理组。对照组不施肥,处理组施加短期缓释奥绿肥(Scotts公司,N/P/K含量为20∶20∶20)2.8 g/盆。待幼苗株高30 cm左右(施肥第10天)时,从生态园中采集南方菟丝子的营养丝(保证南方菟丝子顶端完整),按顺时针方向缠绕三叶鬼针草的嫩茎进行寄生,每株分别寄生15 cm左右南方菟丝子营养丝3段。每个处理重复6盆。整个实验过程当中对照组与处理组每天早晚各浇灌适量的水1次。
1.3 指标测定
于寄生后第2、4、6、8天统计南方菟丝子的缠绕圈数和吸器数,并以目测法估算南方菟丝子相对于寄主的覆盖度。接着每隔1周统计南方菟丝子的相对盖度。寄生34 d后,在南方菟丝子生长到达旺盛期后,用相对叶绿素含量计CCM-200 plus(美国,Opti-Science公司)测定成熟叶片的相对叶绿素含量,并测定三叶鬼针草的株高。收获时,将南方菟丝子与三叶鬼针草分开,并将菟丝子按茎与果实,三叶鬼针草按根、茎、叶分开,用WinFOLIA叶面积仪测定叶面积。将南方菟丝子及三叶鬼针草各部位105℃杀青20 min,70℃烘干至恒重,称量,测定菟丝子营养器官生物量、生殖器官生物量(包括花与果实)以及三叶鬼针草根生物量、茎生物量和叶生物量,计算菟丝子总生物量和三叶鬼针草的总生物量;同时按照公式计算比叶面积(SLA)=叶面积/叶生物量。
1.4 数据分析
数据采用平均数±标准差的形式表示。采用SPSS(16.0)软件的单因素方差分析(One way ANOVA)模块,对不同基质养分条件下三叶鬼针草及南方菟丝子的数据进行差异的显著性检验。
2 结果与分析
2.1 基质养分对南方菟丝子生长的影响
2.1.1 对南方菟丝子寄生动态的影响
从第2天开始,施肥处理组三叶鬼针草植株上南方菟丝子的缠绕圈数与吸器数量明显高于不施肥处理组,在第8天时两者之间呈现显著差异(图1;缠绕圈数:F=8.081,P<0.05;吸器数量:F=5.601,P<0.05)。施肥处理组南方菟丝子相对盖度也高于对照组,且两者之间在第15天(F=14.401,P<0.01)和22d(F=40.584,P<0.01)时的差异均显著(图2)。
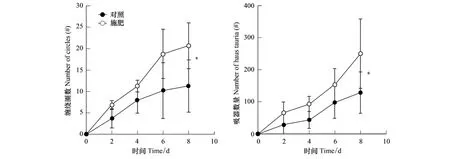
图1 施肥处理对寄生植物南方菟丝子生长的影响Fig.1 Effect of fertilization on the growth of parasitic Cuscuta australis
2.1.2 对南方菟丝子生物量的影响
施肥处理组南方菟丝子营养器官生物量(F=57.326,P<0.01)、生殖器官生物量(F=221.045,P<0.01)和总生物量(F=344.085,P<0.01)均显著高于不施肥对照组,但施肥处理对生殖器官生物量比没有显著影响(图3;F=1.646,P>0.05),表明南方菟丝子对生殖器官的投资比例不受外界养分的影响。
2.2 基质养分对寄主生长的影响
2.2.1 对寄主生物量及分配格局的影响
与对照相比,施肥处理组的寄主叶生物量(F=120.528,P<0.01)、茎生物量(F=38.148,P<0.01)、根生物量(F=15.784,P<0.01)和总生物量(F=72.455,P<0.01)均显著增加(图4)。施肥处理引起寄主三叶鬼针草根冠比(F=22.740,P<0.01)与根生物量比(F=23.166,P<0.01)显著下降,而叶生物量比(F=8.084,P<0.05)显著上升,但对茎生物量比没有影响(图5)。南方菟丝子营养器官生物量、生殖器官生物量与总生物量与三叶鬼针草的根、茎、叶和总生物量之间均存在显著正相关,且与叶生物量比之间存在显著正相关,与根生物量比和根冠比存在显著负相关(表1)。

图3 施肥处理对寄生植物南方菟丝子生物量的影响(平均数±标准差)Fig.3 Effect of fertilization on the biomass of parasitic Cuscuta australis(mean ± standard deviation)
2.2.2 对寄主植物光源捕获能力的影响
与对照相比,施肥处理组的三叶鬼针草相对叶绿素含量(F=9.222,P<0.05)和比叶面积(F=39.907,P<0.01)显著升高(图6)。南方菟丝子营养器官生物量、生殖器官生物量及总生物量与三叶鬼针草相对叶绿素含量及比叶面积存在显著正相关(表1)。
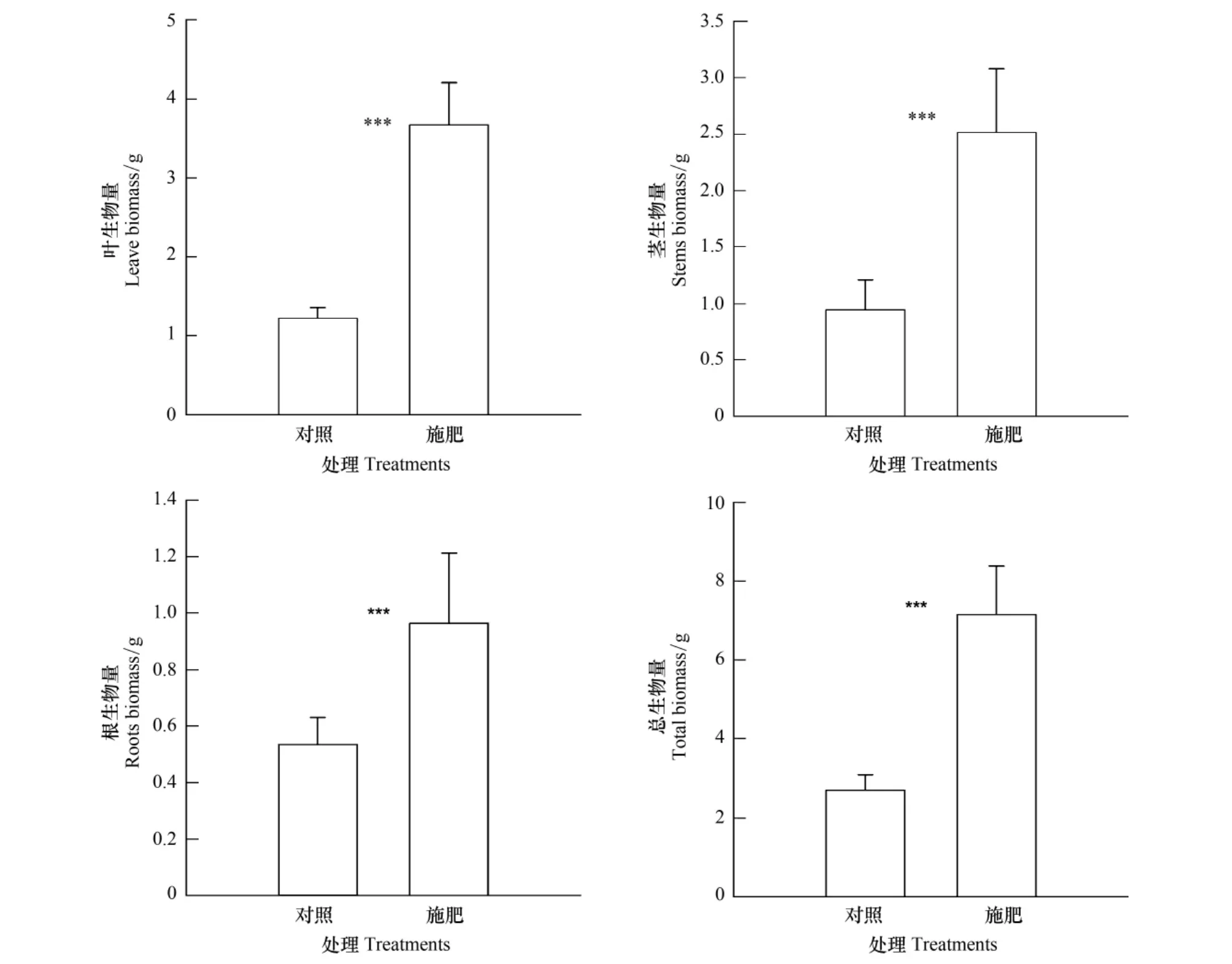
图4 施肥处理对寄主植物三叶鬼针草生物量的影响(平均数±标准差)Fig.4 Effect of fertilization on the biomas of host Bidens biplosa L.(mean ± standard deviation)
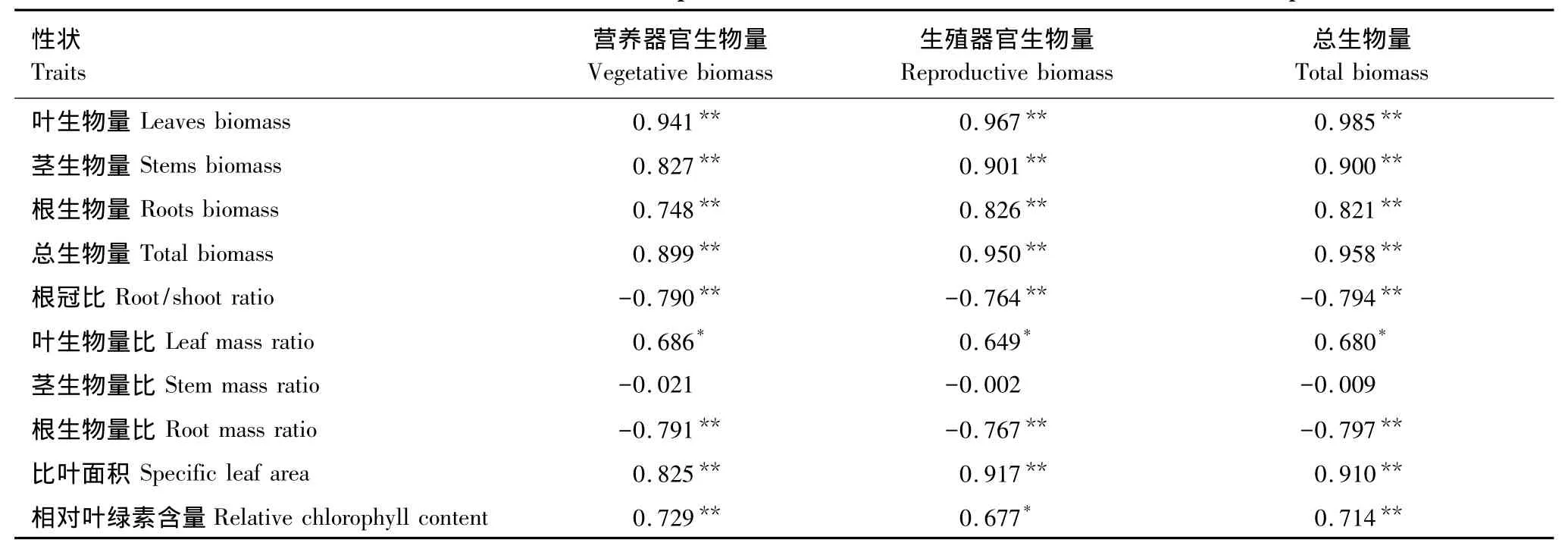
表1 寄生植物南方菟丝子生物量与寄主植物三叶鬼针草生物量的相关性Table1 Correlation between the biomass of parasitic Custuca australis and the traits of host Bidens biplosa L.
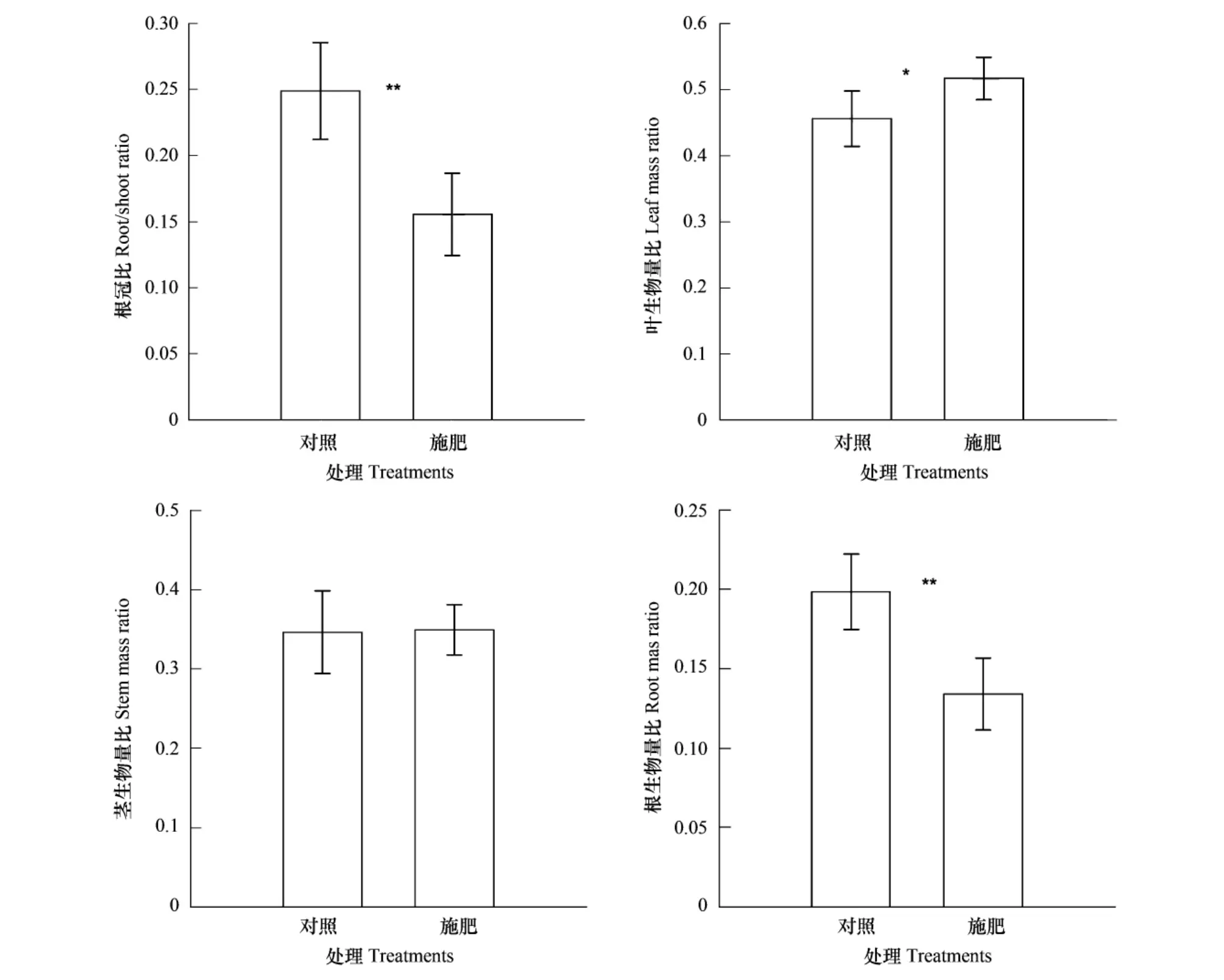
图5 施肥处理对寄主植物三叶鬼针草生物量分配格局的影响(平均数±标准差)Fig.5 Effect of fertilization on the biomass allocation patterns of host Bidens biplosa L.(mean ± standard deviation)
3 讨论
寄主植物是生态系统中的生产者,而寄生植物直接寄生在寄主上,依赖并吸取寄主的养分和水分来生存,除了脱离寄主条件下可以进行微弱的光合作用外[17-18],其余大部分能量几乎全部来自于生产者,因此被认为是生态系统中的初级消费者[19]。本研究采用南方菟丝子寄生入侵植物三叶鬼针草,结果显示施肥可以显著增加寄生植物南方菟丝子的生物量。同时,本研究还发现施肥可以显著增加寄主三叶鬼针草的生物量,而南方菟丝子的生物量与三叶鬼针草的生物量之间均存在显著的正相关,表明施肥可以通过增加寄主植物的生物量,从而间接促进寄生植物的生长。这一结果与添加营养对部分草食动物(初级消费者)的影响相一致[2,20]。Borowica等发现添加氮可以增强草食动物根象鼻虫(Diaprepes abbreviatus)的行为,提高其生物量[2]。Lu等发现添加氮肥可以影响稻谷的生长和产量,继而影响昆虫害虫的生长及行为[3]。这些个体水平的实验结果符合营养添加对群落中草食动物的上行级联效应理论,即添加营养可以促进植物(生产者)的生长,从而促进草食动物(初级消费者)的生长,甚至是捕食者(次级消费者)的生长[21-22]。这也表明营养添加对寄生植物的影响也符合上行级联效应理论。
一些研究结果发现施加氮肥可以使寄主植物上的食草动物的生殖器官数量增加[23-24]。而本研究的结果却显示,施肥对南方菟丝子生殖器官的生物量比并无显著影响,这表明寄生植物对生殖器官的投资比例不受营养添加的影响,即添加营养的情况下寄生植物的生长与生殖之间不存在权衡,并没有增加寄生植物对后代生殖的投资消耗。虽然草食动物的生殖器官的投资比例会随着营养的增加而增加,但这种效果依赖于植物的质量[25],如植物的氮含量[26]。随着营养的增加,寄生植物的生物量增加,同时对寄主植物的危害也增加(未发表数据),导致寄主植物的质量下降,这可能是导致寄生植物的生殖器官投资比例不受营养添加的影响的主要原因。但确切的原因仍需进一步的实验验证。
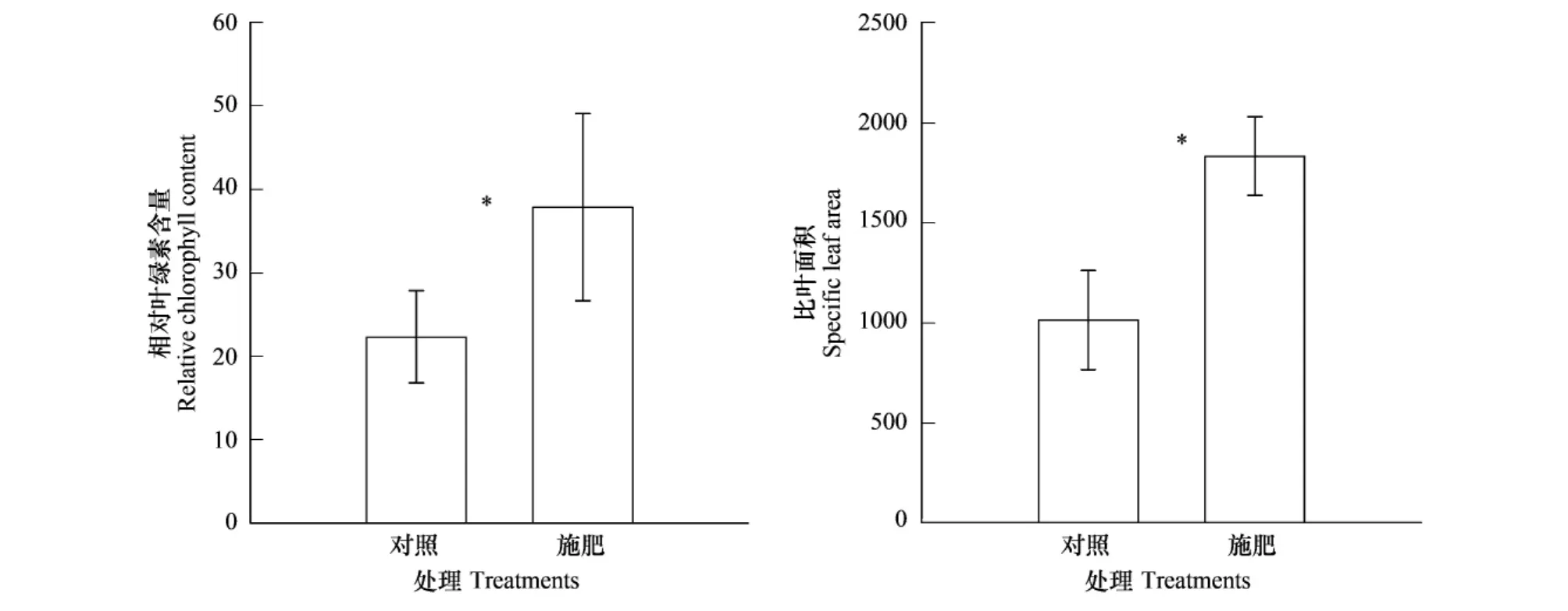
图6 施肥处理对寄主植物三叶鬼针草相对叶绿素含量及比叶面积的影响(平均数±标准差)Fig.6 Effect of fertilization on the relative chlorophyll content and specific leaf area of host Bidens biplosa L.(mean ± standard deviation)
有关外界养分对寄生植物的生长的影响及机制的相关报道很少,如王东等[18]研究发现光照对日本菟丝子(C.japonica Choisy)的生长具有显著影响。这与菟丝子属植物在进化过程中虽然形成了以吸取寄主营养维持其生长发育的异差方式,但同时也保存着与光合作用相关的基因与超微结构有关[17-18]。另外,胡飞等研究发现光线中的远红外光也对日本菟丝子寄生寄主及形成吸器等过程具有显著影响[27]。本研究的结果显示施肥使寄主三叶鬼针草的比叶面积和相对叶绿素含量显著增加,表明施肥可以促进寄主植物的光资源捕获能力,以产生更多的光合同化产物;同时,施肥可以显著降低寄主三叶鬼针草的根生物量比与根冠比,显著增加叶生物量比,表明寄主将更多的生物量分配到叶的生长上,以产生更多的碳水化合物。这些研究结果表明施肥所引起的寄主植物生物量的增加与施肥改变寄主的光资源捕获能力及改变寄主植物生物量分配的格局有关,这些变化可以促使寄主植物获取更多的资源,产生更多的碳水化合物,并将其提供给寄生植物。本研究结果还显示在施肥及寄生植物的共同作用下,寄主植物三叶鬼针草将更多的资源投资到光合机构上,增强其光源捕获能力,以使自己对寄生植物具有更强的耐受能力,但同时这种补偿效应也提供了寄生植物更多的碳水化合物,促进了寄生植物的生长。一般情况下,土壤养分的增加会减少植物的根生物量分配,增加植物的叶生物量分配[28-30]。而植物组织在受到草食动物损害后,可以提高受损害后叶片的光合补偿能力,以提高植物对草食动物的耐受能力[31]。研究发现寄生植物的光合色素含量与寄主植物的光合色素含量成反比,即当寄主植物具有高的光合色素含量、强的光合作用能力时,寄生植物将从寄主植物吸收更多的养分来维持自身的生长[18]。这种效应会进一步促进寄主植物将更多的资源投入到光合机构上,增强其对寄生植物损害的补偿能力。
本研究虽然是基于个体水平,但与基于群落水平的基质养分对草食动物的上行级联效应相似[21-32],因此,基质养分可以通过影响寄主植物(生产者)而对寄生植物(初级消费者)产生显著的上行级联效应,并对寄生植物群落的生产力和多样性的提高产生一定的促进作用,进一步的研究将基于群落水平对相关假设进行验证。同时,作为初级消费者的寄生植物与基质养分如何交互作用影响生产者的生产力及植物群落的结构与动态?寄主植物对寄生植物的防御及耐受的权衡如何?这些问题均需要在后续的研究中进一步探讨。
[1] Dyer L A,Stireman J O III.Community-wide trophic cascades and other indirect interactions in an agricultural community.Basic and Applied Ecology,2003,4(5):423-432.
[2] Borowicz V A,Albrecht U,Mayer R T.Effects of nutrient supply on citrus resistance to root herbivory by Diaprepes abbreviatus L.(Coleoptera:Curculionidae).Environmental Entomology,2003,32(5):1242-1250.
[3] Lu Z X,Yu X P,Heong K L,Hu C.Effect of nitrogen fertilizer on herbivores and its stimulation to major insect pests in rice.Rice Science,2007,14(1):56-66.
[4] Jamieson M A,Knochel D,Manrique A,Seastedt T R.Top-down and bottom-up controls on Dalmatian toadflax(Linaria dalmatica)performance along the Colorado Front Range,USA.Plant Ecology,2012,213(2):185-195.
[5] Li JM,Dong M.Impacts of plant parasitism on structure and function of ecosystems.Acta Ecologica Sinica,2011,31(4):1174-1184.
[6] Smith D.The population dynamics and community ecology of root hemiparasitic plants.The American Naturalist,2000,155(1):13-23.
[7] Press M C.Dracula or robin hood?A functional role for root hemiparasites in nutrient poor ecosystems.Oikos,1998,82(3):609-611.
[8] White T CR.The Inadequate Environment:Nitrogen and the Abundance of Animals.Berlin and NewYork:Springer-Verlag,1993.
[9] Slansky F Jr.Nutritional ecology of endoparasitic insects and their hosts:An overview.Journal of Insect Physiology,1986,32(4):255-261.
[10] Pennings SC,Callaway R M.Parasitic plants:parallels and contrasts with herbivores.Oecologia,2002,131(4):479-489.
[11] Sheng JH,Zhang X J,Liu H Y,Li L.Parasitic plant overview.Bulletin of Biology,2006,41(3):9-13.
[12] Deng X,Feng H L,Ye W H,Yang Q H,Xu K Y,Cao H L,Fu Q.A study on the control of exotic weed Mikania micrantha by using parasitic Cuscuta campestris.Journal of Tropical and Subtropical Botany,2003,11(2):117-122.
[13] Lian J Y,Ye W H,Cao H L,Lai Z M,Wang Z M,Cai C X.Influence of obligate parasite Cuscuta campestris on the community of its host Mikania micrantha.Weed Research,2006,46(6):441-443.
[14] Yu H,Yu F H,Miao SL,Dong M.Holoparasitic Cuscuta campestris suppresses invasive Mikania micrantha and contributes to native community recovery.Biological Conservation,2008,141(10):2653-2661.
[15] Yu H,He W M,Liu J,Miao SL,Dong M.Native Cuscuta campestris retrains exotic Mikania micrantha and enhances soil resources beneficial to natives in the invaded communities.Biological Invasions,2009,11(4):835-844.
[16] Wang R K,Guan M,Li Y H,Yang B F,Li J M.Effect of the parasitic Cuscuta australis on the community diversity and the growth of Alternanthera philoxeroides.Acta Ecologica Sinica,2012,32(6):1917-1923.
[17] Choudhury N K,Sahu D.Photosynthesis in Cuscuta reflexa:a total plant parasite.Photosynthetica,1999,36(1/2):1-9.
[18] Wang D,Hu F,Chen Y F,Yang J,Kong C H.Photosynthetic characteristics of Cuscuta japonica and its hosts during parasitization and after detachment.Chinese Journal of Applied Ecology,2007,18(8):1715-1721.
[19] Hershey D R.Myco-heterophytes& parasitic plants in food chains.The American Biology Teacher,1999,61(8):575-578.
[20] Herms D A.Effects of fertilization on insect resistance of woody ornamental plants:reassessing an entrenched paradigm.Environmental Entomology,2002,31(6):923-933.
[21] Fountain M T,Brown V K,Gange A C,Symondson W O C,Murray P J.Mutitrophic effects of nutrient addition in upland grassland.Bulletin of Entomological Research,2008,98(3):283-292.
[22] Moksnes P O,Gullström M,Tryman K,Baden S.Trophic cascades in a temperate seagrass community.Oikos,2008,117(5):763-777.
[23] Chu Y I,Horng SB.Effect of slag and nitrogen fertilizer on the damage of Asian corn borer to field corn.Memoirs of the College of Agriculture,National Taiwan University,1994,34(1):45-53.
[24] Bentz J A,Reeves J III,Barbosa P,Francis B.Within-plant variation in nitrogen and sugar content of poinsettia and its effects on the oviposition pattern,survival,and development of Bemisia argentifolii.Environmental Entomology,1995,24(2):271-277.
[25] Center T D,Dray F A Jr,Jubinsky G P,Grodowitz M J.Biological control of water hyacinth under conditions of maintenance management:can herbicides and insects be integrated?Environmental Management,1999,23(2):241-256.
[26] Center T D,Dary F A Jr.Bottom-up control of water hyacinth weevil populations:do the plants regulate the insects?Journal of Applied Ecology,2010,47(2):329-337.
[27] Hu F,Kong C H,Zhang C X,Liang W J,Wang P.Selection behavior of Cuscuta japonica on their hosts.Chinese Journal of Applied Ecology,2005,16(2):323-327.
[28] Meziane D,Shipley B.Interacting components of interspecific relative growth rate:constancy and change under differing conditions of light and nutrient supply.Functional Ecology,1999,13(5):611-622.
[29] Fichtner K,Schulze E D.The effect of nitrogen nutrition on growth and biomass partitioning of annual plants originating from habitats of different nitrogen availability.Oecologia,1992,92(2):236-241.
[30] McConnaughay K D M,Coleman J S.Can plants track changes in nutrient availability via changes in biomass partitioning?Plant and Soil,1998,202(2):201-209.
[31] Gassmann A J.Effect of photosynthetic efficiency and water availability on tolerance of leaf removal in Amaranthus hybridus.Journal of Ecology,2004,92(5):882-892.
[32] Turkington R.Top-down and bottom-up forces in mammalian herbivore-vegetation systems:an essay review.Botany,2009,87(8):723-739.
参考文献:
[5] 李钧敏,董明.植物寄生对生态系统结构和功能的影响.生态学报,2011,31(4):1174-1184.
[11] 盛晋华,张雄杰,刘宏义,李莉.寄生植物概述.生物学通报,2006,41(3):9-13.
[12] 邓雄,冯惠玲,叶万辉,杨期和,徐凯扬,曹洪麟,傅强.寄生植物菟丝子防治外来种薇甘菊研究初探.热带亚热带植物学报,2003,11(2):117-122.
[16] 王如魁,管铭,李永慧,杨蓓芬,李钧敏.南方菟丝子寄生对喜旱莲子草生长及群落多样性的影响.生态学报,2012,32(6):1917-1923.
[18] 王东,胡飞,陈玉芬,杨军,孔垂华.日本菟丝子及其寄生前后寄主的光合特征.应用生态学报,2007,18(8):1715-1721.
[27] 胡飞,孔垂华,张朝贤,梁文举,王朋.日本菟丝子对寄生的选择行为.应用生态学报,2005,16(2):323-327.
