蒙古栎、白桦根系分解及养分动态
2013-09-07靳贝贝国庆喜
靳贝贝,国庆喜
(东北林业大学生态研究中心,哈尔滨 150040)
树木地下庞大的根系是其地上光合生长的基础,直径较粗的根主要起到支撑和运输的作用,直径相对较小的细根负责养分和水分的吸收[1]。因此,根系在发挥植物功能和生态系统能量流动与养分循环中扮演重要角色,是林木重要的养分“源”和光合产物的“汇”[2-3]。林木根系处于不断生长、衰老、死亡和再生长的动态过程中[4],具有很高的周转率,尤其是细根在这一过程可消耗陆地生态系统初级生产力的10%—75%[5]。根系分解是周转的主要环节,与季节性凋落的枯枝落叶相比,根系的死亡和分解一年四季随时发生,能够持续向土壤输入养分,构成生物地球化学循环的重要环节[6-7],对于恢复和增加土壤肥力、提高森林生产力和维持森林生态系统的持续发展具有重要作用。若森林生态系统物质循环中不考虑根系产量、死亡及分解,则有机质和养分的周转量将被低估20%—80%[8]。同时,根系分解释放出二氧化碳(CO2),其分解速率的快慢关系到碳(C)在土壤中的滞留时间,因而根系分解是全球C预算的重要组分[9]。
根系分解速率主要受根系环境和根系化学成分的影响[10]。在环境条件相对一致的情况下,根系的化学成分是影响分解的主要因子[11-12]。树木种类、根系直径大小等都影响根系化学成分[13],因此,不同直径的根系分解速率可能不同。目前国内有关细根分解开展了不少研究,这些研究主要包括细根分解的动态变化[14]、养分释放[15]和能量归还[16]等几个方面,但是系统研究不同径级根系,尤其是粗根分解的报道很少。粗根作为地下生物组成的一部分,在整个生物地球化学循环中发挥的作用同样不可忽视。本文主要对东北地区蒙古栎、白桦两个树种4个直径等级根系进行研究,探讨不同径级根系分解速率及养分变化情况,为了解根系分解自然过程和养分循环提供基础。
1 研究地概况与研究方法
1.1 研究地概况
试验地位于黑龙江省帽儿山森林生态系统国家野外科学观测站——老爷岭森林生态系统定位站(127°30'—127°34'E,45°20'—45°25'N),即我国温带落叶阔叶林与温带针阔混交林过渡类型的中心地带。该地区属于温带大陆性季风气候,四季较为分明,冬长夏短;全年气候受高低压轮流控制,起伏变化大。年平均温2.8 ℃,1月均温-19.6 ℃,7月均温20.9 ℃;年均湿度70%,年降水量723.8 mm,年蒸发量1093.9 mm,年日照时数2471.3 h,无霜期120—140d。该地区地带性土壤为典型暗棕壤,其亚类还有草甸暗棕壤、白浆化暗棕壤、潜育暗棕壤和原始暗棕壤,它们多分布在300 m以下的低山丘陵地带,其中以典型暗棕壤所占的地形部位较高。
1.2 研究方法
1.2.1 埋袋实验
本实验采用埋袋法研究根系的分解[17-18]。实验标准地设在63年生蒙古栎(Quercus mongolica)和白桦(Betula platyphylla)天然混交林内,标准地面积40 m×10 m。目前蒙古栎胸径和树高分别为23.4 cm和11.8 m,白桦分别为15.1 cm 和12.3 m。下木层有:暴马丁香(Syringa reticulata)、色木槭(Acer mono)、刺五加(Acanthopanax senticosus)、东北山梅花(Philadelphus schrenkii)、东北鼠李(Rhamnus yoshinoi)等。于2011年5月,在林地内随机挖取蒙古栎和白桦根系(根系直径不超过20 mm),洗净,去除颜色发暗、无弹性的死亡根系,晾至自然含水量。按直径将根系划分为4个级别:粗根(>10 mm)、中粗根(5—10 mm)、中根(2—5 mm)和细根(<2 mm),剪成5 cm长的根段,称取各级别根系6.0 g,分别装入长、宽均为10 cm的尼龙网袋(80目)内。每个直径等级的根系装21袋,4个级别共84袋,两个树种共168袋。埋在标准地由下到上的3个样方(2 m×2 m)内,样方间距离12—15 m左右。每个样方内埋4个径级根系各7袋,平埋入10 cm深的土层中,表层覆盖林地凋落物。在2011年6—10月和2012年4—5月,每月20日,将每个样方每个直径根系各取出1个样品,即每次每个直径共取出3个样品,带回实验室备用。
1.2.2 室内分析实验
将取回的分解网袋打开,清除附着的泥土、杂物等非根系物质和新长入的根,采用土壤筛(40目)冲洗根系,剩余的根系于75℃烘箱中烘48 h后测定干重,粉碎、过筛,用于化学成分分析。样品的化学成分分析项目包括全N及可溶性糖。全N采用凯氏法,可溶性糖采用苯酚法测定。
1.2.3 重量保持率和养分保持率的计算
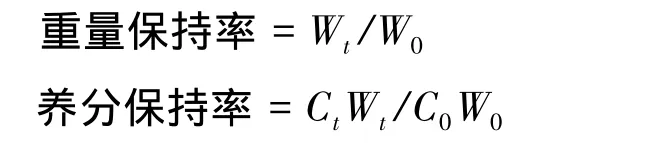
式中,W0为根系初始干重(g),Wt为根系分解t时间后的干重(g),C0为根系初始养分浓度,Ct为根系分解t时间后的养分浓度。
1.2.4 根系分解过程的拟合
根系的分解过程是一个动态过程,通常情况下,根系的重量保持率和时间不成线性关系,Olson提出指数衰减模型描述凋落物的分解,其衰减模型为:Xt/X0=e-kt,式中t为分解时间,X0为根系初始干重,Xt为分解t时间的残留干重,k为年分解系数,本研究利用此模型拟合根系残留率和时间的关系,并计算年分解系数k。
1.2.5 统计分析
采用SPSS11.5统计软件拟合根系分解过程重量保持率与时间的关系,运用LSD法方差分析检验同一树种不同径级以及同一径级不同树种之间根系分解速率差异和初始养分含量差异。
2 结果与分析
2.1 蒙古栎、白桦根系的分解速率
在蒙古栎和白桦根系分解过程中,根系的重量保持率总体上随时间而下降(图1),但也有因实验误差和空间异质性等原因出现负分解现象。分解360d后,蒙古栎细根约分解26%,中根和粗根的分解在20%左右,中粗根的分解接近15%。白桦细根约分解33%,中根、中粗根、粗根分解在20%左右。
依据Olson的指数衰减模型建立根系指数分解方程,结果(表1)显示,蒙古栎细根和中粗根年分解系数相差很大(P<0.05),但它们与中根和粗根年分解系数均无差异。白桦根系年分解系数随着根系直径的增加而减小,粗根与其它3个径级年分解系数均差异显著(P<0.05),其中,与细根年分解系数差异极为显著(P<0.01),中粗根与细根年分解系数也有差异(P<0.05)。各径级根系的年分解系数在种间差异均不显著。
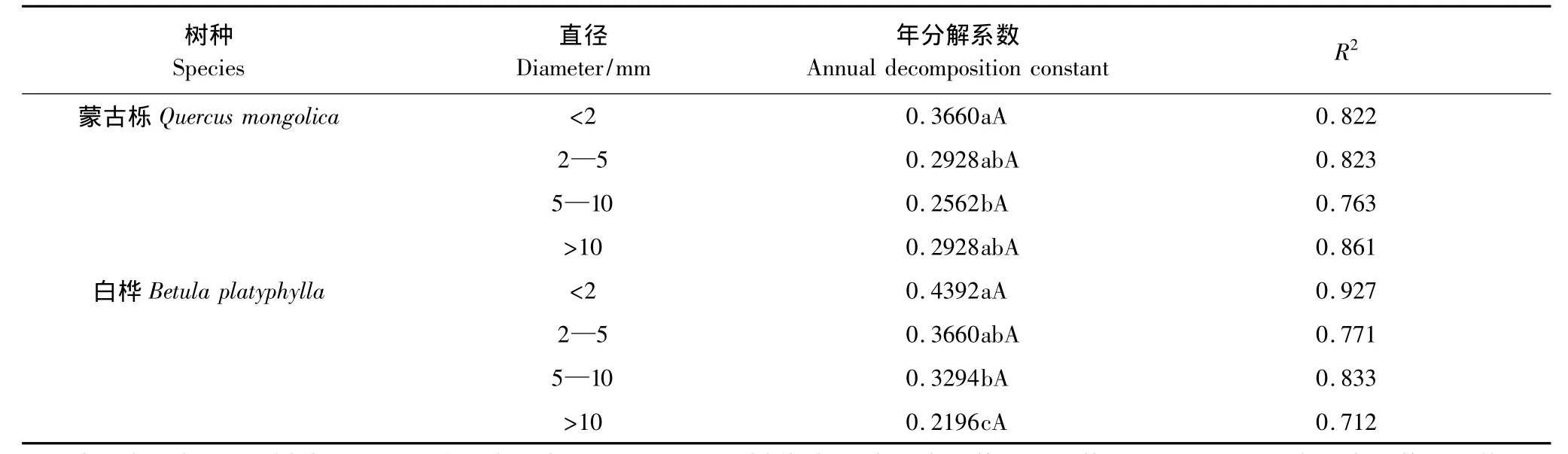
表1 蒙古栎、白桦不同径级根系年分解系数Table1 Annual decomposition constant(k)in different diameters roots of Quercus mongolica and Betula platyphylla
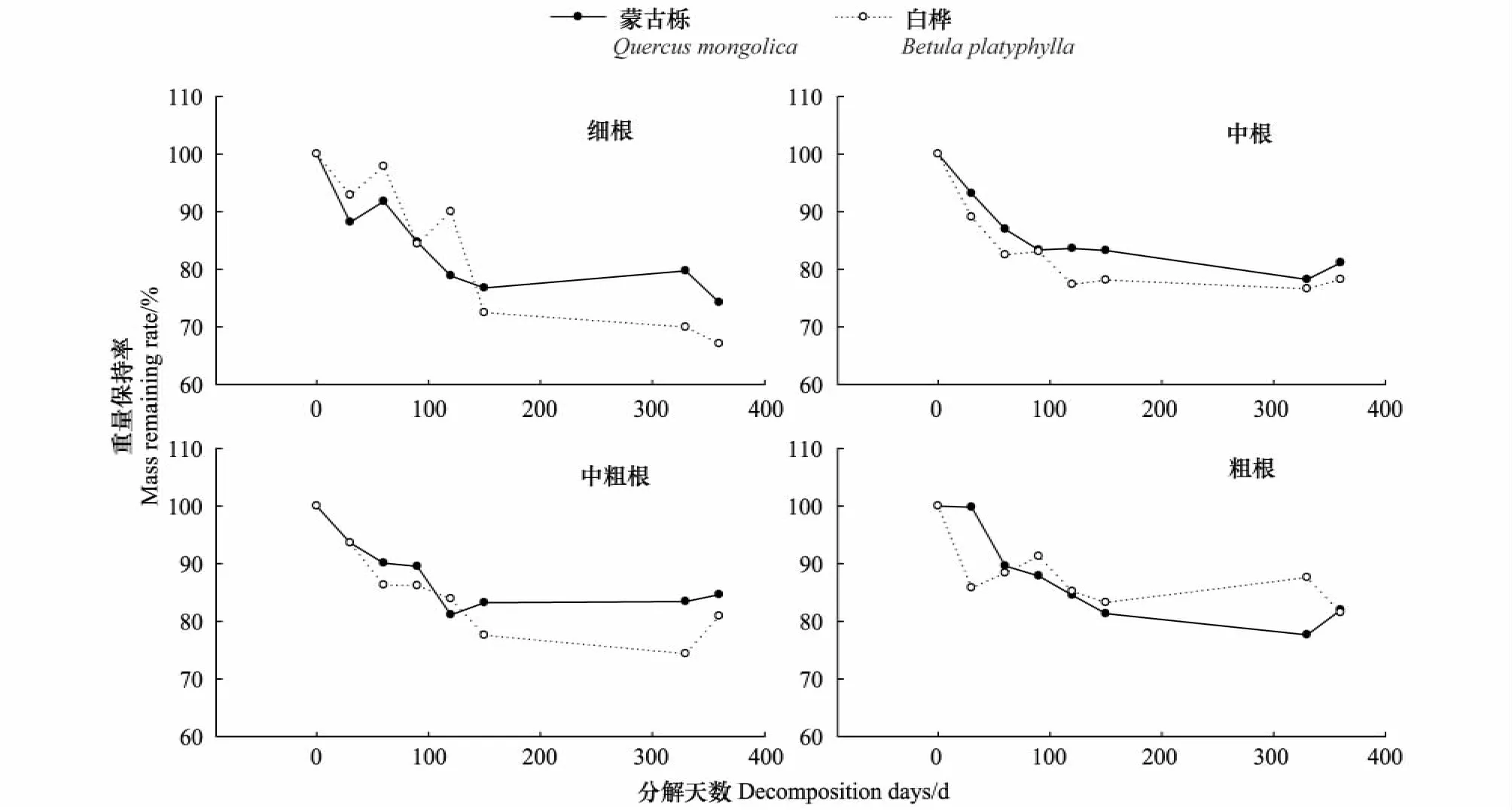
图1 蒙古栎和白桦根系重量保持率变化Fig.1 Change in root mass remaining rate of Quercus mongolica and Betula platyphylla with different diameters during root decomposition
2.2 蒙古栎、白桦根系分解过程中养分浓度的时间动态变化
2.2.1 蒙古栎、白桦根系的初始养分
根系中养分浓度常被用来预测根系分解速率以及养分释放情况[19]。根系初始化学成分分析结果表明,蒙古栎、白桦不同径级根系N和可溶性糖含量有差别(表2)。白桦根系的养分浓度明显高于蒙古栎,其中,种间N浓度差异在细根、中根和中粗根3个径级上表现极显著(P<0.01),两树种粗根N浓度差异不显著;而可溶性糖浓度在细根和中根两个径级上差异极为显著(P<0.01),两树种的中粗根和粗根可溶性糖浓度差异不显著(P>0.05)。蒙古栎4个径级N浓度中粗根最低,它与细根和中根均差异显著(P<0.05);其次是粗根,它与细根差异显著。白桦细根N浓度明显高于其它3个径级(P<0.01)。蒙古栎、白桦可溶性糖浓度均是粗根最低,细根较高。蒙古栎细根、中根和中粗根之间糖浓度无差异,但都与粗根差异显著。白桦细根和中根糖浓度与中粗根和粗根差异极显著(P<0.01)。

表2 蒙古栎、白桦不同径级根系养分元素初始浓度Table2 Nutrient concentration in different diameters roots of Quercus mongolica and Betula platyphylla(mean±SE,n=3)
2.2.2 蒙古栎、白桦根系分解过程中N浓度的变化
根系分解过程常常伴随着淋溶、物质迁移、土壤生物代谢对元素的吸收和释放,不停的与外界进行物质交换,因此根系分解过程中元素含量也在不断发生变化[9,20]。从图2可以看出,蒙古栎、白桦各径级根系N浓度随分解时间增加大体上呈上升趋势,白桦各径级根系的N浓度均比蒙古栎的高。蒙古栎、白桦细根N浓度在分解初期呈明显上升趋势,120d之后下降,第2年,蒙古栎细根N浓度继续上升,白桦则下降。两树种中根N浓度在分解的前30d降低,白桦降幅比蒙古栎大很多,30d之后,蒙古栎N浓度略微上升然后趋于稳定,而白桦N浓度在经历了大幅下降之后迅速上升,120d之后趋于稳定。蒙古栎中粗根在分解前60d迅速上升,之后又下降;白桦N浓度初期迅速上升,150d后稳定。两树种粗根N浓度都是在分解前30d降低,然后又上升,90d之后蒙古栎N浓度基本稳定,白桦继续上升。
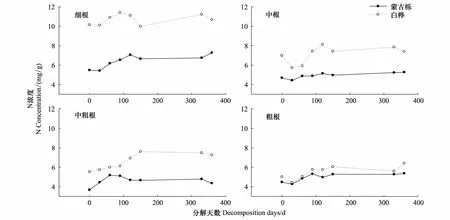
图2 蒙古栎和白桦根系N浓度变化Fig.2 Change in N concentration of Quercus mongolica and Betula platyphylla with different diameters during root decomposition
2.2.3 蒙古栎、白桦根系分解过程中可溶性糖浓度的变化
随着分解时间增加,蒙古栎、白桦根系可溶性糖浓度整体呈迅速下降趋势(图3)。蒙古栎、白桦各径级根系可溶性糖浓度在分解前30d大幅下降,之后细根和中根下降幅度减小,在90—120d后达到稳定。蒙古栎、白桦中粗根30d后继续下降,120d后趋于稳定。蒙古栎粗根可溶性糖浓度下降至150d后保持稳定,白桦粗根下降至90d后又上升,之后稳定。
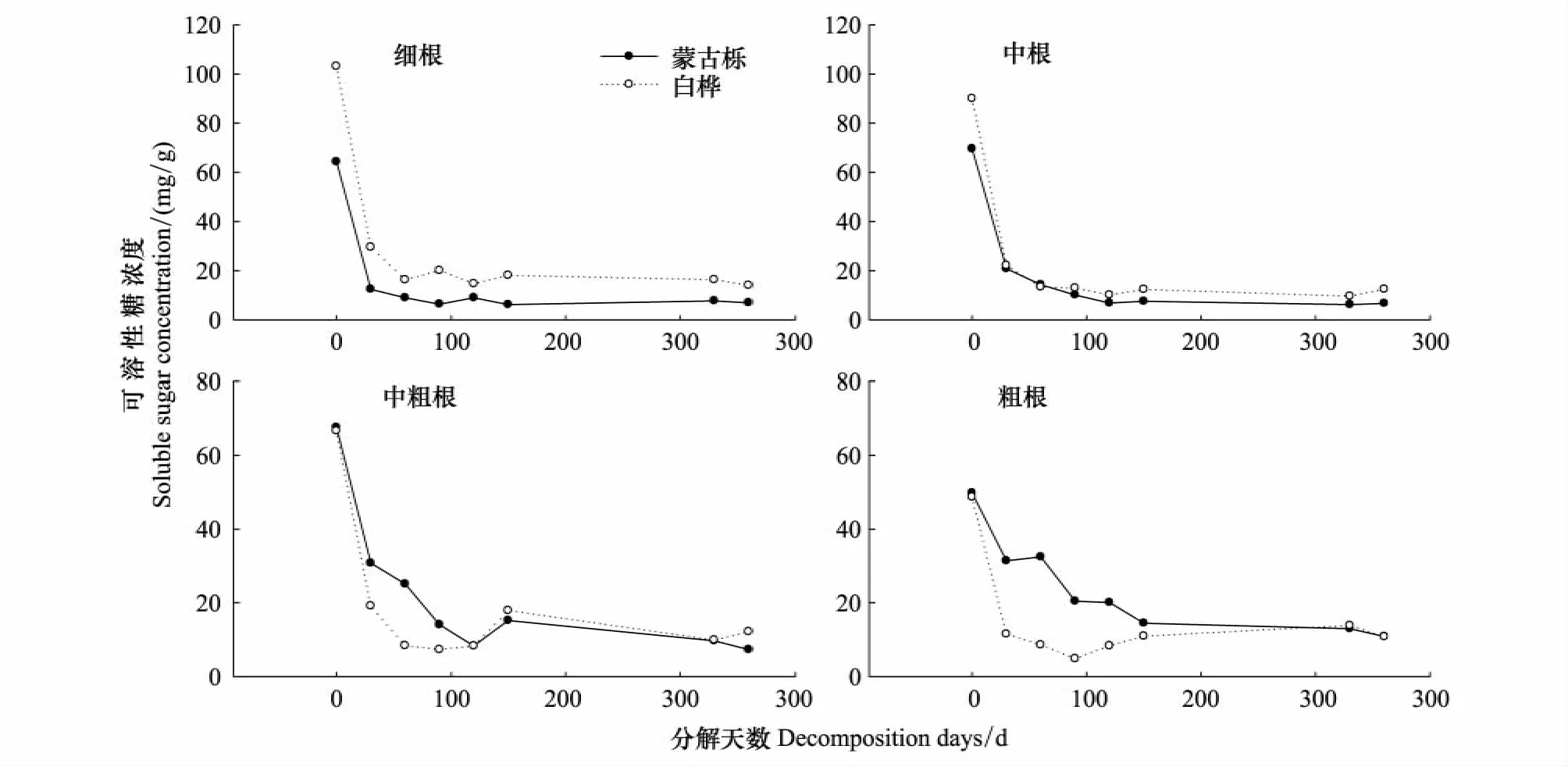
图3 蒙古栎和白桦根系可溶性糖浓度变化Fig.3 Change in soluble sugar concentration of Quercus mongolica and Betula platyphylla with different diameters during root decomposition
2.3 蒙古栎、白桦根系分解过程中养分保持率的动态变化
2.3.1 蒙古栎、白桦根系分解过程中N保持率的动态变化
根系分解的不同时期表现为释放或富集N元素(图4),分解的前30d,蒙古栎、白桦各径级根系均表现为释放N元素。蒙古栎细根和中根的释放率达13%,粗根和中粗根释放率较小,分别为5%和3%。白桦中根和粗根的释放率达25%,细根和中粗根释放率较小,为7%和1%。在分解的30—60d,蒙古栎的各径级根系均表现为富集N元素;但白桦的中根和中粗根仍然表现为释放N元素,细根和粗根表现为富集N元素。在分解的60—150d,蒙古栎各径级根系均表现为释放N元素,白桦只有细根表现为释放N元素,其余3个径级均富集N元素。整体上看,分解1a时间,蒙古栎各径级根系表现为释放N元素,其中,中根和中粗根释放率高,而细根和粗根的释放率低;但白桦表现为细根和中根释放N元素,中粗根和粗根富集N元素。
2.3.2 蒙古栎、白桦根系分解过程中可溶性糖保持率的动态变化
随着分解时间增加,根系可溶性糖保持率呈迅速下降趋势(图5)。分解的前30d,蒙古栎细根可溶性糖的释放率为83.3%,中根为72.2%,中粗根为69.0%,粗根为37.2%,呈现出随根系直径增加释放率下降的趋势。白桦细根可溶性糖释放率为70.3%,中根为77.9%,中粗根为73.1%,粗根为79.2%,基本呈现随根系直径增加释放率也增加的趋势。分解1a时间,蒙古栎、白桦细根和中根的释放率达90%以上,中粗根和粗根的释放率达80%以上。
3 结论与讨论
3.1 根系的分解速率
蒙古栎、白桦各径级根系的分解在初期是相对快的(图1),随着分解时间延长,分解速率逐渐下降。这主要是因为分解初期根系器官中碳水化合物的含量相对高,对于分解的真菌和微生物来说是非常适宜的条件[21]。根系的初始失重与根系底物初始的N浓度密切正相关[22-23],但随着可萃取物和酸溶性组分的耗尽,N浓度对分解的效应降低。Eriksson[24]等指出,分解后期N浓度升高可能抑制了木质素的分解,从而降低了根系分解速率。因此,蒙古栎和白桦根系分解具有明显的时间模式,分解过程先后出现分解速率较快和较慢两个阶段。

图4 蒙古栎和白桦根系分解过程中N的释放Fig.4 Change in N remaining rate of Quercus mongolica and Betula platyphylla roots with different diameters during root decomposition
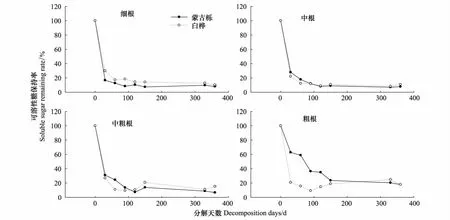
图5 蒙古栎和白桦根系分解过程中可溶性糖的释放Fig.5 Change in soluble sugar remaining rate of Quercus mongolica and Betula platyphylla roots with different diameters during root decomposition
通常认为,根系中N浓度高(即C/N低)的树种具有较快的分解速率[11]。蒙古栎细根、中根、中粗根的N浓度显著低于白桦相应径级的N浓度(表2),表明白桦根系的分解速率大于蒙古栎。模拟方程结果(表1)表明,对于相同径级根系而言,除了粗根,其余各径级根系的年分解系数均是白桦大于蒙古栎。研究发现,经过1a的分解后,白桦木质部变得松软,而蒙古栎仍然紧实,这一研究结果符合N浓度高分解速度快这一观点。
直径对根系分解率的影响较为复杂,不同直径根的分解速率不同,特别是>5 mm根分解速率明显较低。一些研究者认为,大直径根分解慢与其水溶性化合物的淋溶速率低[21]或根中难分解物质和结构性物质的比例高有关[25]。与细根相比,大直径根更不易被取食、干燥和遭受机械损伤,这与根的寿命随根直径增大而增长的观测结果一致[26]。许多研究者认为,随根系直径的增加,N含量降低、C/N增加,并且易分解细胞的比例降低[27],因此粗根分解较慢。本研究中,白桦根系N浓度随着直径的增加而减小,蒙古栎大体上也符合这一规律,但是中粗根的N浓度最低。一年的研究结果表明,在所研究的直径范围内,白桦直径越小的根系分解越快,蒙古栎细根分解最快,其次是中根和粗根,中粗根分解最慢。这一研究结果与直径越大分解速度越慢这一论点基本一致。
3.2 根系分解过程中N和可溶性糖释放
根系N释放过程比较复杂,根系分解的不同时期表现为N释放或富集。分解过程中养分的释放受凋落物质量和环境控制[11]。凋落物质量是指凋落物的相对可分解性,初始养分浓度常作为凋落物分解指标[19]。初始浓度高的元素能够满足微生物生命活动的需求,一般富集量较小或直接释放,变化相对比较平稳;凋落物中浓度低的养分易于发生富集或者是富集量较高,或分解过程中无明显规律,常常出现波动[28]。Osterag和Hobbie[29]发现,铁心木(Metrosideros polymorpha)分解 1a 后,N 增加至初始含量的 150%,Scheu[17]等对山毛榉(Fagus sylvatica)和欧洲白蜡(Fraxinus excelsior)3a的研究发现,中根(3—10 mm)和细根(<3 mm)释放和富集均不明显,山毛榉粗根(>10 mm)N富集150%,欧洲白蜡粗根为120%。在本研究中,根系分解初期N元素均表现为释放(图4),这可能是由于降雨增加和温度升高所致。随着分解时间增加,蒙古栎、白桦各径级根系表现为不同程度的富集或释放,但两树种没有明显的规律,这可能与局部的森林立地条件、林地养分有效性、水分季节变化和微生物活动有关。本研究分解1a时间,蒙古栎各径级根系均表现为释放N元素,但白桦表现为细根和中根释放N元素,中粗根和粗根富集N元素。
Chapin[11]等提出根系分解主要包括淋溶和破碎等物理过程和生物作用为主的化学过程。淋溶是根系中可溶性糖和矿物质离子在雨水的作用下淋失到土壤中的物理过程,是根系分解最快的阶段。实际上当根系还处于存活阶段时,淋溶就开始发生了[30]。温达志[20]等在鼎湖山南亚热带森林细根分解过程的研究中发现,可溶性糖仅170d就被淋洗掉95%。张秀娟[15]等在帽儿山对水曲柳、落叶松根系分解过程中养分释放进行研究发现,分解150d后,两树种粗根和中根可溶性糖释放均在90%以上。而两树种细根分解仅30d时可溶性糖释放接近90%。这些研究表明,根系分解过程中可溶性糖的释放率比较可观。本实验分解1a时间,蒙古栎、白桦细根和中根的释放率达90%以上,中粗根和粗根的释放率达80%以上。
[1] Wei X,Zhang G Z.Progress and prospect in the main research realms of tree fine roots.Chinese Agricultural Science Bulletin,2008,24(5):143-147.
[2] Copley J.Ecology goes underground.Nature,2000,406(6795):452-454.
[3] Morgan JA.Looking beneath the surface.Science,2002,298(5600):1903-1904.
[4] Norby R J,Jackson R B.Root dynamics and global change:seeking an ecosystem perspective.New Phytologist,2000,147(1):3-12.
[5] Gill R A,Jackson R B.Global patterns of root turnover for terrestrial ecosystems.New Phytologist,2000,147(1):13-31.
[6] Fahey T J,Hughes JW.Fine root dynamics in a northern hardwood forest ecosystem,Hubbard Brook Experimental Forest,NH.The Journal of Ecology,1994,82(3):533-548.
[7] Gordon W S,Jackson R B.Nutrient concentrations in fine roots.Ecology,2000,81(1):275-280.
[8] Zhang X Q,Wu K H,Murach D.A review of methods for fine-root production and turnover of trees.Acta Ecologica Sinica,2000,20(5):875-883.
[9] Aerts R.Climate,leaf letter chemistry and leaf litter decomposition in terrestrial ecosystems:a triangular relationship.Oikos,1997,79(3):439-449.
[10] Huang Z Q,Liao L P,Gao H,Wang S L,Yu X J.Decomposition process of Chinese fir stump roots and changes of nutrient concentration.Chinese Journal of Applied Ecology,2000,11(1):40-42.
[11] Chapin F SIII,Matson P A,Mooney H A.Principles of Terrestrial Ecosystem Ecology.New York,Berlin:Springer Verlag,2002:151-175.
[12] Chen H,Harmon M E,Griffiths R P.Decomposition and nitrogen release from decomposing woody roots in coniferous forests of the Pacific Northwest:a chronosequence approach.Canadian Journal of Forest Research,2001,31(2):246-260.
[13] Liao L P,Yang Y J,Wang S L,Gao H.Distribution,decomposition and nutrient return of the fine root in pure Cunninghamia lanceolata,Michelia macclurei and the mixed plantations.Acta Ecologica Sinica,1999,19(3):342-346.
[14] Lin C F,Yang Y S,Chen G S,Guo JF,Han Z G.Decomposition dynamics of fine roots of Cunninghamia lanceolata in Mid-subtropics.Journal of Subtropical Resources and Environment,2008,3(1):15-23.
[15] Zhang X J,Wu C,Mei L,Han Y Z,Wang Z Q.Root decomposition and nutrient release of Fraxinus manshurica and Larix gmelinii plantations.Chinese Journal of Applied Ecology,2006,17(8):1370-1376.
[16] Zhang L H,Ye G F,Lin Y M,Lu C Y,Hou J.Nutrient release and energy return of fine roots in Casuarina equisetifolia plantation.Journal of Xiamen University:Natural Science,2007,46(2):268-273.
[17] Scheu S,Schauermann J.Decomposition of roots and twigs:effects of wood type(beech and ash),diameter,site of exposure and macrofauna exclusion.Plant and Soil,1994,163(1):13-24.
[18] Silver W L,Miya R K.Global patterns in root decomposition:comparisons of climate and litter quality effects.Oecologia,2001,129(3):407-419.
[19] Peng SL,Liu Q.The dynamics of forest litter and its responses to global warming.Acta Ecologica Sinica,2002,22(9):1534-1544.
[20] Wen D Z,Wei P,Zhang Y C,Kong GH.Dry mass loss and chemical changes of the decomposed fine roots in three China south subtropical forests at Dinghushan.Chinese Journal of Ecology,1998,17(2):1-6.
[21] Fahey T J,Hughes JW,Pu M,Arthur M A.Root decomposition and nutrient flux following whole-tree harvest of northern hardwood forest.Forest Science,1988,34(3):744-768.
[22] Aber JD,Melillo J M,McClaugherty C A.Predicting long-term patterns of mass loss,nitrogen dynamics,and soil organic matter formation from initial fine litter chemistry in temperate forest ecosystems.Canadian Journal of Botany,1990,68(10):2201-2208.
[23] Lohmus K,Ivask M.Decomposition and nitrogen dynamics of fine roots of Norway spruce(Picea abies(L.)Karst)at different sites.Plant and Soil,1995,168-169(1):89-94.
[24] Eriksson K E L,Blanchette R A,Ander P.Microbial and Enzymatic Degradation of Wood and Wood Component.Berlin:Springer,1990.
[25] Fitter A H.Functional significance of root morphology and root system architecture//Fitter A H,Atinson D,Read D J,Usher M B,eds.Ecological Interaction in Soil.Oxford:Blackwell,1985,4:87-106.
[26] Boot R G A.The significance of size and morphology of root systems for nutrient acquisition and competition//Lambers H,Cambridge M L,Konings H,Pons T,eds.Causes and Consequences of Variation in Growth rate and Productivity of Higher Plants.The Hague:SPB Academic Publishing,1990.
[27] Pregitzer K S,Deforest J L,Burton A J,Allen M F,Ruess R W,Hendrick R L.Fine root architecture of nine North American trees.Ecological Monographs,2002,72(2):293-309.
[28] Wang J,Huang J H.Comparison of major nutrient release patterns in leaf litter decomposition in warm temperate zone of China.Acta Phytoecologica Sinica,2001,25(3):375-380.
[29] Ostertag R,Hobbie SE.Early stages of root and leaf decomposition in Hawaiian forests:effects of nutrient availability.Oecologia,1999,121(4):564-573.
[30] Zhang X J,Mei L,Wang Z Q,Han Y Z.Advances in studying fine root decomposition in forests.Chinese Bulletin of Botany,2005,22(2):246-254.
参考文献:
[1] 卫星,张国珍.树木细根主要研究领域及展望.中国农学通报,2008,24(5):143-147.
[8] 张小全,吴可红,Dieter Murach.树木细根生产与周转研究方法评述.生态学报,2000,20(5):875-883.
[10] 黄志群,廖利平,高洪,汪思龙,于小军.杉木根桩分解过程及几种主要营养元素的变化.应用生态学报,2000,11(1):40-42.
[13] 廖利平,杨跃军,汪思龙,高洪.杉木(Cunninghamia lanceolata)、火力楠(Michelia macclurei)纯林及其混交林细根分布、分解与养分归还.生态学报,1999,19(3):342-346.
[14] 林成芳,杨玉盛,陈光水,郭剑芬,韩志刚.杉木人工林细根分解和养分释放及化学组成变化.亚热带资源与环境学报,2008,3(1):15-23.
[15] 张秀娟,吴楚,梅莉,韩有志,王政权.水曲柳和落叶松人工林根系分解与养分释放.应用生态学报,2006,17(8):1370-1376.
[16] 张立华,叶功富,林益明,卢昌义,侯杰.木麻黄人工林细根分解过程中的养分释放及能量归还.厦门大学学报:自然科学版,2007,46(2):268-273.
[19] 彭少麟,刘强.森林凋落物动态及其对全球变暖的响应.生态学报,2002,22(9):1534-1544.
[20] 温达志,魏平,张佑昌,孔国辉.鼎湖山南亚热带森林细根分解干物质损失和元素动态.生态学杂志,1998,17(2):1-6.
[28] 王瑾,黄建辉.暖温带地区主要树种叶片凋落物分解过程中主要元素释放的比较.植物生态学报,2001,25(3):375-380.
[30] 张秀娟,梅莉,王政权,韩有志.细根分解研究及其存在的问题.植物学通报,2005,22(2):246-254.
