MG63细胞验证无镍不锈钢生物相容性的研究
2013-09-07马天驰李济强刘继辉王良宇
马天驰,李济强,刘继辉,王良宇
(1.沈阳市口腔医院正畸科,辽宁 沈阳 110002;2.大连医科大学口腔医学院)
临床中对由于外伤、肿瘤、畸形修复等所导致骨组织缺损的修复多采用骨移植或利用医用金属材料制作的赝复体来修复。相对于骨移植,医用金属材料在强度、弹性、可塑性、加工难易程度、制作成本、对于医疗设备的要求、患者的经济承受能力方面有着巨大的优势,故已经成为临床上广泛应用的材料之一[1-5]。常见的医用金属材料包括不锈钢 (尤其是AISI 316L和317L),CoCrMo合金以及钛合金等。传统医用不锈钢中具有较高的镍含量 (通常为10% ~14%),植入人体后由于电化学反应导致镍离子溶出而可能引发致畸、致敏等毒性反应。在此背景下,无镍不锈钢 (nickel-free stainless steel) 随之发展起来[6-9]。
良好的生物相容性是决定生物材料能否应用于临床的先决条件之一,本文采用体外细胞培养法来考察成骨细胞在材料上的生长状况及复合生长的细胞是否具有正常的生理功能,对三种不同医用金属材料 (无镍不锈钢、317L不锈钢和CoCrMo合金)的细胞相容性进行研究,来评价无镍不锈钢作为口腔骨科植入材料的应用前景。
1 材料与方法
1.1 金属材料制备 使用中国科学院金属研究所提供的无镍不锈钢 (0Cr18Mn15Mo2N0.64),医用317L不锈钢以及 CoCrMo合金。所有样品经过1 100℃固溶处理1 h,切取10 mm×10 mm×1 mm的薄片,用SiC砂纸水磨至1200#,成边缘光滑、无锐角的薄片,依次在丙酮、酒精和蒸馏水中超声清洗20 min后干燥,制得实验用样品。
1.2 MG63细胞培养 MG63细胞以DMEM培养液(Hyclone USA)加10%胎牛血清(Hyclone USA)(含100 U/ml青霉素、100 μg/ml链霉素)培养于37℃,湿度100%,5%CO2细胞培养箱中。细胞每2 d换液,每4 d传代,传代比例为1∶4。待细胞数量足够后备用。
1.3 细胞体外培养 将预先无菌处理好的无镍不锈钢、317L不锈钢和CoCrMo合金放入6孔板。取MG63细胞用成骨诱导条件培养基 (含0.1 μmol/L地塞米松、10 mmol/L的β-磷酸甘油、0.2 mmol/L的维生素C、100 U/ml的青霉素、100 U/ml的链霉素和10%胎牛血清)重悬,调整细胞浓度为1×106/ml,在每个材料表面滴加0.5 ml细胞悬液,并保证不让材料表面液滴流到板底 (由于所有材料的表面积是相同的,所以每片材料上滴加相同体积、相同细胞密度的细胞悬液,使其上种植的细胞数相等),放入培养箱连续孵育12 h,待细胞贴壁后,去除培养基,无菌PBS溶液冲洗3次,每个孔内再加入2.5 ml成骨诱导条件培养基。连续培养,期间不换代。
1.4 细胞黏附率检测 将MG63细胞种植于无镍不锈钢、317L不锈钢和CoCrMo合金表面12 h,使得细胞黏附在材料表面。随后弃去培养液,用无菌PBS溶液轻轻冲洗3次以去除没有附着的细胞。黏附在材料表面的细胞用含0.25%胰消化酶的PBS溶液消化下来并计数,计算每种金属表面的细胞黏附率。
1.5 细胞增殖率检测 将MG63细胞用胰蛋白酶从培养瓶中消化下来,以1 000 r/min离心,去上清液,矿化培养液重悬,调整细胞密度到1×104/cm2接种于每种金属表面,分别取1、3、5 d培养细胞进行MTT检测。
1.6 金相显微镜观察 在细胞接种的1、5 d,分别取出样品用PBS溶液轻轻冲洗3次,用4℃预冷的2.5%戊二醛固定过夜,然后用PBS溶液轻轻冲洗2遍,再逐级 (50%、75%、95%、100%)酒精脱水,每个浓度脱水2次,每次10 min,冷冻干燥。在金相显微镜下观察细胞密度和形态。
1.7 碱性磷酸酶活性检测 将细胞种植于材料表面1、3和5 d,取出用PBS溶液轻轻冲洗3次,在4℃环境下用0.01%TritonX-100裂解细胞12 h,然后用吸管反复吹打1 min,使细胞充分碎解。以14 000 r/min离心5 min,吸取一部分上清液并用对硝基苯磷酸盐 (即PNPP)法检测碱性磷酸酶,另一部分上清液用考马斯亮蓝法测定总蛋白含量。
1.8 统计学分析 采用SPSS 12.0统计软件包进行检验分析,结果用均值±标准差表示。在判断数据是正态分布 (在偏度和峰度上t分布的检验值<1.96)的前提下,采用One-Way ANOVA评价整体性差异,方差齐性用LSD t-test分析方法进行组间比较,方差不齐用Dunnett T3分析方法进行组间比较,P<0.05为差异有显著性。
2 结果
2.1 材料表面细胞黏附率 经过12 h培养,MG63细胞在无镍不锈钢表面细胞黏附率为95.22±2.01,高于 317L不锈钢 (80.42±1.72)和CoCrMo合金 (80.35±1.05)(P<0.05),显示了细胞在无镍不锈钢材料表面良好的黏附能力。
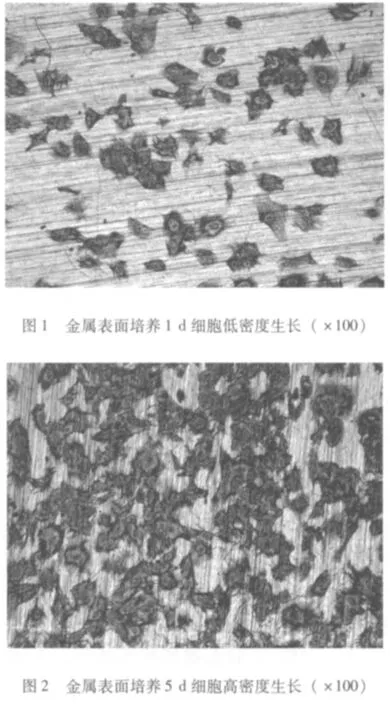
2.2 细胞形态观察 图1显示在金属表面培养1 d细胞的生长状态,细胞单个或成集落生长,细胞圆形或多角形。图2显示在培养5 d细胞生长状态,细胞成片生长,细胞形态不易区分。
2.3 细胞增殖率检测 3种金属表面MG63细胞生长1 d吸光度值差异无显著性。3 d和5 d时无镍不锈钢吸光度值与317L不锈钢和CoCrMo合金比较差异有显著性 (P<0.05和0.01)。见表1。
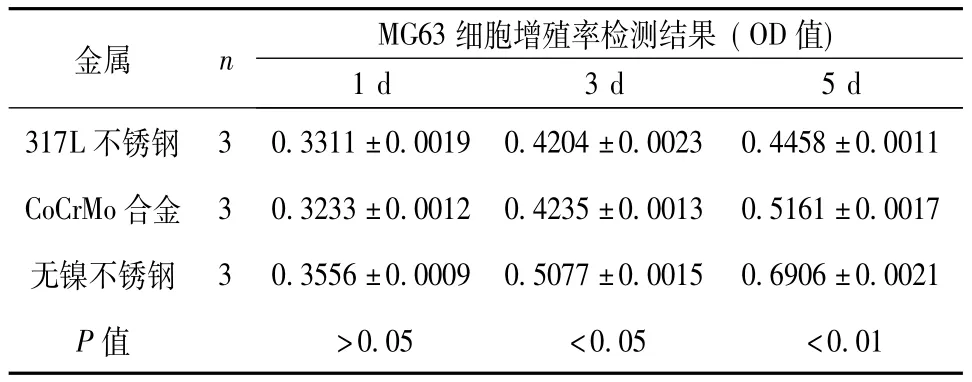
表1 3种金属表面MG63细胞增殖率检测结果 (OD值)
2.4 碱性磷酸酶的活性检测 1 d时3种金属表面碱性磷酸酶活性差异无显著性,3 d和5 d时无镍不锈钢的碱性磷酸酶活性高于另外2种金属,差异有显著性 (P<0.05)。见表2。

表2 3种金属表面碱性磷酸酶的活性检测结果(金氏单位U/gprot)
3 讨论
交通事故所导致的口腔颌面部的外伤,肿瘤切除后,原发性和继发性畸形修复可导致骨组织的缺损,使软组织失去了支持,导致组织塌陷,影响形态和功能。临床中对于此类骨组织的缺损的修复除采用骨移植外,利用医用金属材料制作的赝复体来修复也是临床实践中常用的一种方法。由于医用金属材料在强度、弹性、可塑性、加工难易程度、制作成本、对于医疗设备的要求。患者的经济承受能力方面有着巨大的优势,故已经在临床中植入以代替硬组织行使功能。
以AISI 316L和317L为代表的医用奥氏体不锈钢,由于其优良的力学性能和抗腐蚀性能被广泛应用于骨科和心血管支架等外科植入物,但是其中都含有14%左右的镍元素。由于在人体环境中不可避免的腐蚀行为,现有医用不锈钢会存在镍离子溶出而导致潜在的致敏和毒性危害,因此新型的无镍奥氏体不锈钢得到快速发展和应用。
目前世界各国的研究者都在进行医用无镍不锈钢的研究和开发。Yamamoto等[10]通过高温渗氮得到了Fe-Cr-Mo-N 的无镍高氮不锈钢,在研究了与316L和 Fe-24Cr-2Mo不锈钢的细胞毒性对比,结果表明渗氮后形成的医用无镍不锈钢具有更好的细胞相容性。Wan等[11]的研究表明,高氮无镍不锈钢的血液相容性要优于317L不锈钢,并且随着氮含量的上升,血液相容性得到明显改善。Montanaro等[12]研究了P558无镍奥氏体不锈钢植入绵羊胫骨后和骨组织的反应,组织相容性与Ti-6Al-4V合金相当,明显优于316L不锈钢。目前美国已将无镍奥氏体不锈钢作为外科植入材料列入到ASTM标准中 (ASTM F2229-02)。
本实验将无镍不锈钢和317L、CoCrMo合金并列将以比较,实验细胞选用MG63细胞。MG63细胞是一种成骨前体细胞,分离于青少年骨肉瘤。常常用来体外关于成骨诱导,生物材料生物相容性等方面的研究。通过测定细胞黏附率、金属表面的细胞增殖率、碱性磷酸酶活性,从而比较3种金属的生物相容性的差别。对于细胞黏附率,3种金属表面的细胞黏附率差异有显著性,其中,无镍不锈钢高于317L不锈钢和CoCrMo合金,即植入后的细胞黏附良好,在此方面的生物相容性无区别。MTT检测的细胞增殖率,量化细胞增殖率的不同。实验结果显示在无镍不锈钢表面的细胞增殖最好,即细胞的生长状态良好。碱性磷酸酶活性检测结果也显示在无镍不锈钢表面的细胞成骨分化能力最好。
从以上实验可以发现无镍不锈钢具有良好的体外生物相容性,优于传统的医用317L和CoCrMo合金,有良好的临床应用前景。
[1]俞耀庭,张兴栋.生物材料[M].天津:天津大学出版社,2000:27.
[2]Gustiio RB,Merkow RL,Templemun D.The management of open fracture[J].Bone Joint Surg Am,1990,72(2):299-304.
[3]Ratner BD.生物材料学:医用材料简介[M],San Diego CA:学术出版社,1996:98.
[4]Black J,Hastings G.Handbook of biomaterial properties[M].London:Chapman& Hall,1998:77.
[5]Mitsuo N.Recent metallic materials for biomedical applications[J].Metal Materi Trans,2002,33A:477.
[6]Stein G,Menzel J.Nitrogen alloyed steels-a new generation of materials with extraordinary properties[J].Intern J Materials and Product Technol(Switzerland),1995,10(3-6):290-302.
[7]Montanaro L,Cervellati M,Campoccia D,et al.No genotoxicity of a new nickel-free stainless steel[J].Int J Artif Organs,2005,28(1):58-65.
[8]Fini M,Aldini N,Torricelli P,et al.A new austenitic stainless steel with negligible nickel content:an in vitro and in vivo comparative investigation[J].Biomaterials,2003,24(27):4929 -4939.
[9]Fini M,Giavaresi G,Giardino R,et al.A new austenitic stainless steel with a negligible amount of nickel:an in vitro study in view of its clinical application in osteoporotic bone[J].J Biomed Mater Res,2004,71B:30-37.
[10]Yamamoto A,Kohyama Y,Kuroda D,et al.Cytocompatibility evaluation of Ni-free stainless steel manufactured by nitrogen adsorption treatment[J].Mate Sci Eng,2004,24(6 -8):737 -743.
[11]Wan P,Ren YB,Zhang BC,et al.Effect of nitrogen on blood compatibility of nickel-free high nitrogen stainless steel for biomaterial[J].Mater Sci Eng,2010,30:1183 -1189.
[12]Lucio Montanaro,Marina Cervellati,et al.Promising in vitro performances of a new nickel-free stainless steel [J].Materials in Medicine,2006,17:267-275.
