纱布纤维可否在小鼠气囊植骨模型中诱发炎性骨溶解的研究
2013-09-06周园东
万 睿,李 平,周园东,张 健
人工关节置换术过程中术者需使用大量医用纱布拭干组织及骨周围渗血,以保证手术视野的清晰,但纱布纤维存在不同程度地遗留。纱布纤维为医学非移植材料[1],遗留在体内会产生异物反应,形成慢性肉芽肿[2]。无菌松动是人工关节置换术后最常见的中远期并发症,那么松动界膜中的炎症反应与纱布纤维遗留引起的异物反应是否有相似的形成机制或共同的细胞因子参与,慢性肉芽肿中的巨噬细胞是否有分化为破骨细胞的潜能从而产生溶骨作用?本研究通过建立小鼠气囊植骨模型[3]以检验纱布纤维引起的囊壁组织及移植骨炎症反应的相关因子的水平[4],观察纱布纤维是否会诱发炎性骨溶解,为优化手术操作奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 胫骨标本 经医学伦理委员会批准后,选择2011年3—4月4例在我院行膝关节置换术患者丢弃的胫骨上端松质骨作为胫骨标本,将每例患者的胫骨标本分为2块,1块采用干纱布擦拭 (干纱布组),另1块采用0.9%氯化钠溶液浸湿的湿纱布擦拭 (湿纱布组),擦拭压力、方向及次数均相同,之后按照标准程序进行处理。
1.1.2 实验动物 近交系SPF级BALB/c小鼠30只,雌雄各半,周龄8~10周,雌雄分开喂养。采用简单随机分组法将小鼠分为对照组、聚乙烯组和纱布组,每组10只。实验动物由重庆医科大学实验动物中心提供,处置方法严格按照动物伦理委员会要求。
1.1.3 主要试剂 (1)聚乙烯颗粒:超高分子聚乙烯购自美国强生DePuy公司并由美国BioEngeering Solutiongs公司制备成直径为8 μm的颗粒,经环氧乙烷消毒灭菌后配置成1%质量浓度的0.9%氯化钠溶液混悬液备用。(2)纱布纤维:医用脱脂棉纱布块购自云南象山医用材料有限公司,剪碎后经超声细胞破碎机粉碎,人工分拣、称量、高温蒸气灭菌、干燥后备用。(3)抗酒石酸酸性磷酸酶 (TRAP)试剂盒购自南京建成科技有限公司;兔抗小鼠白介素 (IL) -1β单克隆抗体、兔抗小鼠IL-6单克隆抗体、兔抗小鼠肿瘤坏死因子α(TNF-α)单克隆抗体、SP-0023免疫组化试剂盒均购自北京博奥森生物技术有限公司;二氨基联苯胺 (DAB)试剂盒购自北京中杉金桥生物技术有限公司;小鼠TNF-α酶联免疫吸附试验(ELISA)试剂盒,购自美国R&D公司;Trizol试剂购自美国Life Technologies公司;逆转录试剂盒、定量聚合酶链反应(PCR)试剂盒均购自上海 (东洋纺)生物科技有限公司。
1.2 方法
1.2.1 建立模型 (1)第1天,取小鼠背部正中线上1.5 cm处为进针点,去毛、消毒,皮下注射空气2.5 ml,第3天再次注射空气1 ml,气囊形成。(2)第9天,每组选取2只小鼠使用颈椎脱臼法处死,取颅骨并分离周围组织 (不损伤骨表面),将颅骨分割成4 mm×3 mm大小骨片,置入0.9%氯化钠溶液中备用,作为该组其他小鼠植骨供体;每组其他小鼠采用3.5%水合氯醛进行腹腔麻醉,然后在气囊上切开一个5 mm长的切口,植入备好的颅骨骨片,使用0号丝线缝合切口,1∶100青链霉素溶液0.3 ml注射至气囊预防感染。由于纱布纤维无法通过注射器注射入气囊,因此,纱布组小鼠在颅骨骨片植入后即植入5 mg干重的纱布纤维。(3)第10天,聚乙烯组小鼠气囊内注入含聚乙烯颗粒5 mg的混悬液0.5 ml,对照组小鼠气囊内注入0.9氯化钠溶液0.5 ml;以上步骤均严格按照无菌原则操作。(4)第17天,处死全部小鼠,取囊壁组织,石蜡包埋,液氮保存,骨片经10%乙二胺四乙酸(EDTA)脱钙液脱钙。
1.3 观察指标
1.3.1 电镜观察 干纱布组和湿纱布组各选取4个视野,采用日立S-3000N扫描电镜进行拍照,Image-Pro Plus 6.0软件进行图像分析,计算纱布纤维覆盖率。
1.3.2 肉眼观察 小鼠处死前活动情况、死亡情况及处死后切口炎症反应情况。
1.3.3 苏木素-伊红 (HE)染色 采用HE染色法观察囊壁组织单核细胞计数和淋巴细胞计数,计数5个高倍视野,取平均值。参考文献 [5]中的方法确定炎症反应程度,即阴性(-)、阳性 (+)、强阳性 (++)。
1.3.4 TRAP染色 骨片行石蜡切片,切片厚度为4 μm,按照试剂盒说明书进行染色;以破骨细胞胞质出现紫红色颗粒为阳性,通过图像分析软件计算紫红色胞质所占视野面积百分比,每个标本采集2个中倍镜视野取平均值。
1.3.5 免疫组织化学染色 囊壁组织经固定后行石蜡切片,切片厚度为4 μm,常规脱蜡水化,抗原修复采用微波炉法;以IL-1β、IL-6、TNF-α单克隆抗体分别进行免疫组织化学染色,每个标本采集2个中倍镜视野取平均值。通过图像分析软件计算各因子蛋白表达水平,以平均光密度值表示。
1.3.6 ELISA 将液氮保存的囊壁组织于匀浆器中匀浆,取上清液检测TNF-α水平。
1.3.7 实时定量PCR 由于经费限制,每组采用简单随机法选取3只小鼠进行检测。取100 mg囊壁组织加入Trizol试剂,于匀浆器中匀浆,常规提取总RNA,逆转录合成cDNA,按照试剂盒说明书检测TNF-α mRNA表达水平。TNF-α上游引物为5'-CGGGCAGGTCTACTTTGGAG-3',下游引物为5'-CAGGTCACTGTCCCAGCATC-3',扩增片段长度为230 bp;以β-actin为内参照,上游引物为5'-CTGAGAGGGAAATCGTGCGT-3',下游引物为5'-CCACAGGATTCCATACCCAAGA-3',扩增片段长度为208 bp,引物合成由美国Life Technologies公司完成。扩增条件:预变性:95℃,1 min;循环 (40次):95℃,15 s,58℃,20 s,72℃,20 s;末段延伸:72℃,5 min;溶解曲线:72~95℃,每20 s升温1℃。结果处理采用ΔΔCT法,TNF-α mRNA 表达倍数 =2-K,K=(CT样本目的基因-CT样本内参基因) - (CT对照目的基因- CT对照内参基因)。
1.4 统计学方法 应用SPSS 19.0统计软件进行分析,计量资料以 (±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD检验;多组间等级资料比较采用秩和检验,两两比较采用Mann-Whitney U检验。以P<0.05为差异有统计学意义。
2 结果
2.1 电镜观察 干纱布组纤维覆盖率为 (18.11±6.94)%,湿纱布组为 (4.86±3.64)%,两组比较差异有统计学意义 (t=3.38,P <0.05,见图1)。
2.2 肉眼观察 各组小鼠处死前活动情况良好,无死亡小鼠;处死后发现,聚乙烯组和纱布组小鼠切口存在不同程度的炎症反应,表现为红斑及水肿,对照组小鼠无明显炎症反应。
2.3 HE染色 各组小鼠囊壁组织炎症反应程度比较,差异有统计学意义 (P<0.05,见表1)。其中,纱布组和聚乙烯组小鼠单核细胞反映的炎症反应程度(U纱布组vs.对照组=6.00,U聚乙烯组vs.对照组=4.00)、 淋巴细胞反映的炎症反 应 程 度(U纱布组vs.对照组=3.50,U聚乙烯组vs.对照组=7.00) 与对照组小鼠比较,差异均有统计学意义 (P<0.05);纱布组小鼠与聚乙烯组小鼠单核细胞反映的炎症反应程度 (U=28.00)、淋巴细胞反映的炎症反应程度 (U=28.00)比较,差异均无统计学意义 (P>0.05)。

图1 干纱布组和湿纱布组电镜观察结果 (×30)Figure 1 Result of SEM between dry sponge group and wet sponge group
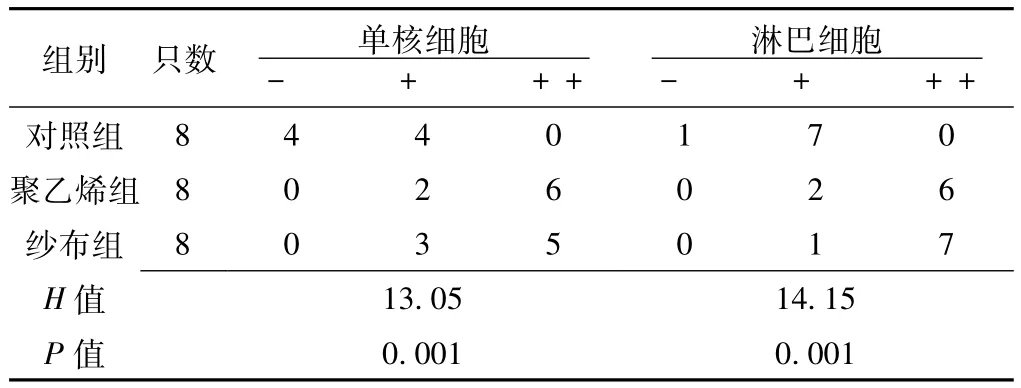
表1 各组小鼠囊壁组织炎症反应程度比较 (只)Table 1 Comparison of inflammation reaction of air pouch wall tissue in each group
2.4 TRAP染色 各组小鼠TRAP染色阳性面积比较,差异有统计学意义 (P<0.05,见图2、表2)。其中,纱布组和聚乙烯组小鼠与对照组小鼠比较,差异均有统计学意义(t纱布组vs.对照组=4.93,t聚乙烯组vs.对照组=5.41,P < 0.05); 纱布组小鼠与聚乙烯组小鼠比较,差异无统计学意义 (t=0.48,P>0.05)。
2.5 免疫组织化学染色 各组小鼠囊壁组织IL-1β、IL-6、TNF-α蛋白表达水平比较,差异均有统计学意义 (P<0.01,见图3、表2)。其中,纱布组和聚乙烯组小鼠IL-1β蛋白表达水平 (t纱布组vs.对照组=6.42,t聚乙烯组vs.对照组=5.77)、IL -6 蛋白表达水平 (t纱布组vs.对照组=7.01,t聚乙烯组vs.对照组=5.90)、TNF - α蛋白表达水平 (t纱布组vs.对照组=15.26,t聚乙烯组vs.对照组=10.56) 与对照组小鼠比较,差异均有统计学意义 (P<0.05);纱布组小鼠与聚乙烯组小鼠TNF-α蛋白表达水平比较,差异亦有统计学意义 (t=4.70,P<0.05),而IL-1β、IL-6蛋白表达水平比较,差异均无统计学意义 (t值分别为1.17和1.12,P>0.05)。
2.6 ELISA 各组小鼠囊壁组织TNF-α水平比较,差异有统计学意义 (P<0.01,见表2);各组两两比较 (t纱布组vs.对照组=35.10,t聚乙烯组vs.对照组=25.09,t聚乙烯组vs.纱布组=10.01),差异均有统计学意义 (P<0.05)。
2.7 实时定量PCR 对照组小鼠TNF-α mRNA表达倍数为(1.06±0.50)、聚乙烯组为 (3.29±0.16)、纱布组为 (4.15±0.18),各组小鼠TNF-α mRNA表达倍数比较,差异有统计学意义 (F=375.31,P<0.001);各组两两比较(t纱布组vs.对照组=26.54,t聚乙烯组vs.对照组=19.16,t聚乙烯组vs.纱布组=7.38),差异均有统计学意义 (P<0.05)。
表2 各组小鼠颅骨骨片TRAP染色阳性面积、囊壁组织各细胞因子平均光密度值及囊壁组织TNF-α水平比较 (±s)Table 2 Comparison of positive area of calvarial TRAP staining,AOD of each cytokine and TNF-α levels in air pouch wall tissue in each group

表2 各组小鼠颅骨骨片TRAP染色阳性面积、囊壁组织各细胞因子平均光密度值及囊壁组织TNF-α水平比较 (±s)Table 2 Comparison of positive area of calvarial TRAP staining,AOD of each cytokine and TNF-α levels in air pouch wall tissue in each group
注:TRAP=抗酒石酸酸性磷酸酶,IL-1β=白介素1β,IL-6=白介素6,TNF-α=肿瘤坏死因子α
组别 只数 TRAP染色阳性面积(%)平均光密度值IL-1β IL-6 TNF-α TNF-α水平(pg/ml).005 88.52±1.59聚乙烯组 8 5.27±1.53 0.145±0.013 0.105±0.020 0.169±0.015 144.32±4.94纱布组 8 4.90±2.09 0.152±0.014 0.114±0.015 0.199±0.018 166.58±5.69 F对照组 8 1.16±0.45 0.115±0.006 0.057±0.013 0.099±0值<0.001 <0.001 <0.001 <0.001 <0.001 17.93 23.39 28.40 122.22 653.97 P值
图2 各组小鼠颅骨骨片TRAP染色结果 (×200)Figure 2 Result of mice calvarial TRAP staining in each group
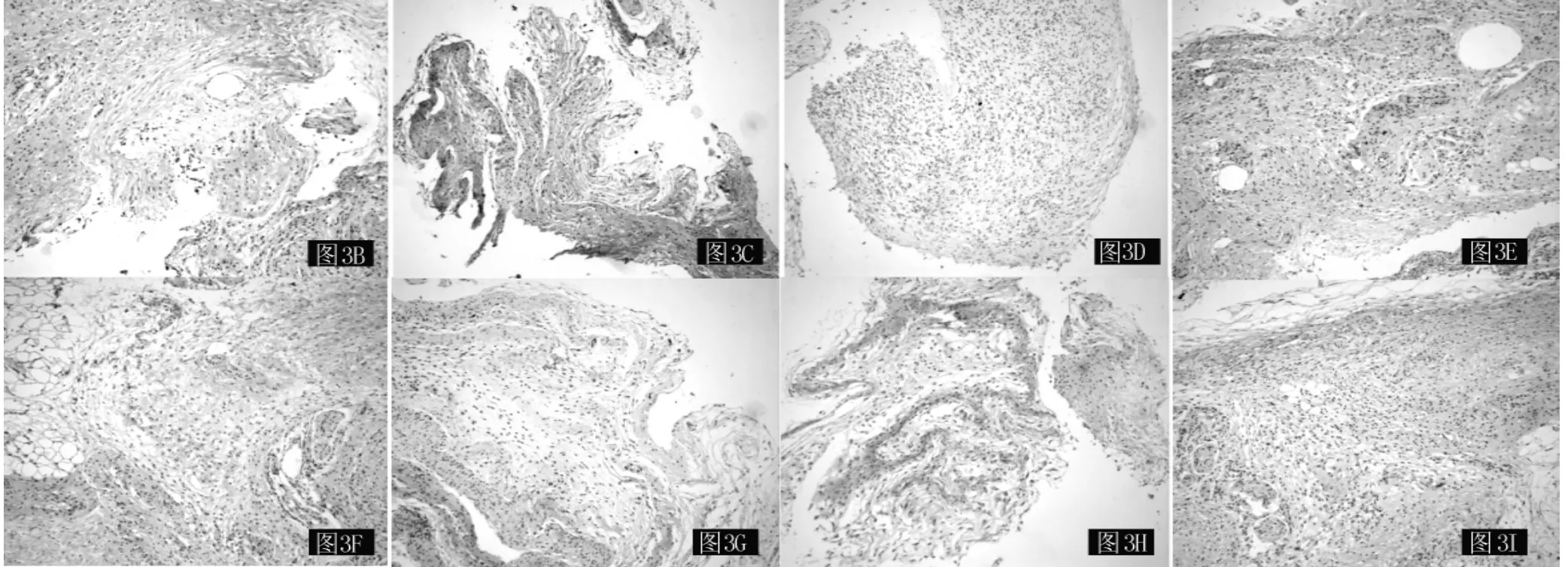
图3 各组小鼠囊壁组织免疫组织化学染色结果 (×100)Figure 3 Result of Immunohistochemical staining of air pouch wall tissue in each group

3 讨论
在假体磨碎碎屑中,数量最多的当属聚乙烯颗粒[6],是公认的生物活性最强的碎屑颗粒,因此,本研究以聚乙烯颗粒为参考,作为确定能引起炎性骨溶解的“金标准”,以确定纱布纤维是否能引起相同的炎性骨溶解。
在人工关节无菌性松动中,磨损碎屑引起的巨噬细胞、成纤维细胞分泌的大量的炎性递质是假体周围骨溶解的“导火索”。研究表明,炎性递质IL-1β、IL-6、TNF-α主要是促进破骨细胞前体细胞向破骨细胞分化成熟进而产生溶骨作用,该过程主要通过破骨细胞“OPG/OPGL(RANKL)/RANK”信号转导通路完成。OPGL通过与破骨细胞前体细胞膜上的RANK结合,导致破骨细胞前体细胞向破骨细胞分化成熟,而OPG作为OPGL的伪受体与之结合而抑制破骨细胞的分化成熟[7]。IL-1β和TNF-α能直接促进OPGL的生成增多,从而使更多的破骨细胞成熟,产生骨溶解效应[8]。IL-6促进破骨细胞的成熟的同时还能作用于巨噬细胞本身,使其产生更多的IL-6而引起骨溶解效应[9]。因此,本研究选择 IL-1β、IL-6、TNF-α作为骨溶解效应的标志。
本研究采用的动物模型是人工关节无菌性松动研究中经典的病理模型,能较好地模拟人工关节松动的病理过程,且成本低、周期短、可重复性高[10],较为理想。
无菌性松动通常发生在骨与假体间的界膜或假体表面,异物颗粒可见于组织细胞或巨细胞胞质内或细胞外,常伴有不同程度的淋巴细胞浸润[11-13]。界膜组织中,单核巨噬细胞约占70%,当其吞噬周围磨损碎屑后,会释放大量的炎性递质如IL-1β、IL-6、TNF-α等,界膜组织中的多核巨细胞和成纤维细胞也会促进炎性递质释放[14-15]。有研究表明,界膜组织实质就是以巨噬细胞为主,多种细胞共同参与的异物肉芽肿性炎[16]。松动假体周围的结缔组织膜具有异物肉芽肿的特征,异物所致慢性肉芽肿主要是以渗出的单核细胞与巨噬细胞为主,包含异物巨细胞[17]。Udagawa等[18]研究发现,界膜中的破骨细胞在抗原和功能上均与成熟巨噬细胞相似,并可在合适的刺激因子作用下由巨噬细胞前体衍化生成。因此,笔者联想到纱布纤维引起的异物反应与常见的无菌性松动的界膜炎症反应有着很多相似之处,异物反应中的巨噬细胞有可能在某些微环境作用下成为破骨细胞进而产生骨溶解效应。
本研究首先模拟纱布擦拭骨表面的真实过程,确定了术中纱布纤维残留的可能性,且干纱布造成的残留量高于湿纱布,而小鼠实验结果提示纱布纤维可引起气囊内炎性因子的释放增加,减少纱布纤维的残留对减少炎性因子导致的炎性骨溶解有直接作用。而将与聚乙烯颗粒等重量的纱布纤维植入小鼠气囊后,聚乙烯组和纱布组小鼠囊壁组炎症反应程度、炎性细胞渗出量、蛋白表达水平、炎性递质mRNA及颅骨骨片破骨细胞特异性染色程度均强于对照组小鼠,且纱布组TNF-α蛋白表达水平高于聚乙烯组,说明纱布纤维与聚乙烯颗粒一样,可引起假体周围组织炎性因子的释放增加,产生炎性骨溶解。但纱布组和聚乙烯组小鼠HE染色、TRAP染色及免疫组化染色结果并无显著性差异,且本研究中采用的动物数量较少,断然做出纱布纤维较聚乙烯颗粒的生物活性更强的结论有些欠妥,其具体的更深入的作用机制有待于进一步研究。
综上所述,术中使用纱布要慎重,尤其应避免使用干纱布,以免留下大量的纱布纤维。建议使用湿纱布以减少纤维的残留,或采用新型表面干燥措施。
1 秦贞俊.纺织材料在医学及保健领域的应用[J].上海纺织科技,2005,33(7):23-25.
2 方超,汪冠三,胡孙林,等.医用纱布留置腹腔时间推断的初步研究[J].中国法医学杂志,2009,24(6):372-375.
3 Ren W,Zhang R,Wu B,et al.Effects of SU5416 and a vascular endothelial growth factor neutralizing antibody on wear debris-induced inflammatory osteolysis in a mouse model[J].J Inflamm Res,2011(4):29-38.
4 陈明,雷宇,董启榕,等.以air pouch模型大鼠进行磨损微粒造成无菌性松动机制分析的可行性[J].中国组织工程研究与临床康复,2009,13(26):5023-5026.
5 Mirra JM,Amstutz HC,Matos M,et al.The pathology of the joint tissues and its clinical relevance in prosthesis failure[J].Clin Orthop Relat Res,1976(117):221-240.
6 王晓庆.聚乙烯颗粒诱导假体周围骨溶解的分子生物学研究[D].上海:上海第二医科大学,2003.
7 陈小勇,赵建宁,包倪荣,等.人工关节无菌性松动标志物和药物防治进展[J].中国矫形外科杂志,2011,19(9):737-739.
8 Georg Schett.Effects of inflammatory and anti-inflammatory cytokines on the bone [J].Eur J Clin Invest,2011,41(12):1361 -1366.
9 Hao HN,Zheng B,Nasser S,et al.The roles of monocytic heat shock protein 60 and Toll-like receptors in the regional inflammation response to wear debris particles[J].J Biomed Mater Res A,2010,94(4):1373-1381.
10 陶崑,沈灏,张先龙,等.植骨气囊在人工关节松动动物模型实验研究中的应用[J].中华关节外科杂志:电子版,2008,2(3):36-40.
11 Shena H,Brinson LC.A numerical investigation of porous titanium as orthopedic implant material[J].Mechanics of Materials,2011,43(8):420-430.
12 文良元,黄公怡,路奎元,等.异物肉芽肿性滑膜炎的实验研究[J].中华骨科杂志,1995,15(8):526-528.
13 金群华,马忠泰.假体磨屑所致关节滑膜反应的实验研究[J].宁夏医学杂志,1998,20(2):73-75.
14 Ingham E,Green TR,Stone MH,et al.Production of TNF-alpha and bone resorbing activity by macrophages in response to different types of bone cementparticles [J].Biomaterials,2000,21(10):1005-1013.
15 Smith RA,Maghsoodpour A,Hallab NJ.In vivo response to crosslinked polyethylene and polycarbonate-urethane particles[J].J Biomed Mater Res A,2010,93(1):227-234.
16 Pierre CA,Chan M,Iwakura Y,et al.Periprosthetic osteolysis:characterizing the innate immune response to titanium wear-particles[J].Journal of Orthopaedic Research,2010,28(11):1418 -1424.
17 李玉林.病理学[M].6版.北京:人民卫生出版社,2005:88-89.
18 Udagawa N,Takahashi N,Akatsu T,et al.Origin of osteoclasts:mature monocytes and macrophages are capable of differentiating into osteoclasts under a suitable microenvironment prepared by bone marrowderived stromal cells[J].Proc Natl Acad Sci USA,1990,87(18):7260-7264.
