两种荧光定量聚合酶链反应法检测乳腺癌组织中微小RNA-21的应用分析
2013-09-06张晟春张兴毅王才友
张晟春,王 燕,张兴毅,王才友
目前微小RNA(microRNA,miR)在疾病中起的重要作用越来越来受到人们的重视,有报道显示乳腺癌和miR-21相关[1],miR-21在乳腺癌中可能具有疾病诊断与预后判定的潜在价值,还可能是有效的治疗靶点,miR-21在乳腺癌中表达增高并与肿瘤的浸润与转移相关。荧光定量聚合酶链反应(FQ-PCR)技术作为检测基因表达的最简便和易行的手段,在科研和临床上都已得到普遍的应用。通常使用的标记物有SYBR GreenⅠ染料和TaqMan探针,本研究建立两种检测模式,检测miR-21在乳腺癌组织与癌旁组织中的表达,并进行比较,选择临床更适用的检测方法。
1 资料与方法
1.1 临床资料 选取2010年度遵义医学院附属医院普外科住院的手术治疗的乳腺癌患者14例,均为女性;平均年龄47.3岁。均经病理证实为乳腺癌,其中浸润性导管癌11例,乳腺小管癌1例,原位癌1例,黏液癌1例。手术切除的乳腺组织标本,包括乳腺癌组织和癌旁组织 (距肿瘤边缘>5 cm)14对。实验室编号为1~28号,其中单号为癌旁组织,双号为与单号配对的乳腺癌组织。术中标本移出体外后立即切取1 cm×1 cm迅速置于液氮中冷冻,-80℃保存备用,其余送病理科做病理检查。
1.2 主要试剂 TRIzol试剂,cDNA合成试剂盒,无RNA酶的糖原购于invitrogen公司;U6寡核苷酸探针,TaqMan探针法PCR试剂,Taq酶及配套试剂购于上海生物工程有限公司;SYBR GreenⅠ染料法定量PCR试剂购于ABI公司;其他未列出的各种化学试剂均为Sigma公司产品或国产分析纯。
1.3 方法
1.3.1 乳腺癌组织和癌旁组织RNA提取 从-80℃低温冰箱取出标本后迅速移至冰上,切取50~100 mg组织,置1.5 ml离心管中,加入1 ml Trizol然后使用电动匀浆机以3 500 r/min(离心半径3 cm)的速度对组织进行快速匀浆,40 s,室温静置5 min。加入0.2 ml氯仿,剧烈振荡15 s,静置3 min。4℃离心,12 000 r/min×10 min(离心半径8 cm),取上清。加入0.5 ml异丙醇,-20℃沉淀20 min。4℃离心,12 000 r/min×10 min(离心半径8 cm),弃上清。加入1 ml 75%乙醇轻轻洗涤RNA沉淀斑块后加入适量的Rnase-free H2O溶解。
1.3.2 提取总RNA纯度鉴定 采用1%琼脂糖凝胶电泳鉴定,观察总RNA的5 S rRNA、18 S rRNA和28 S rRNA条带情况,RNA条带完整,5 S rRNA的条带较弱,28 S rRNA的亮度约为18 S rRNA的 2倍,OD260/OD280比值1.8~2.0,说明RNA纯度较高,可为后续实验所用。
1.3.3 cDNA第一链合成 在0.2 ml PCR管中加入以下试剂:Total RNA,5.0 μl; 特异性引物+U6R引物,1.0 μl;Rnasefree ddH2O,5.0 μl;70℃温浴5 min。冰浴10 s,离心加入下列试剂:5 ×Reaction Buffer,4.0 μl;dNTP Mix(10 mmol/L),2.0 μl;Rnase inhibitor(20 U/μl),1.0 μl;AMV Reverse Transcriptase(10 U/μl),2.0 μl。Total volume,20.0 μl。37℃温浴5 min。42℃温浴60 min。70℃温浴10 min,终止反应。将上述溶液-20℃保存,备用。
1.3.4 引物、探针序列的设计与合成 根据miR-21和U6基因相应的全基因序列,应用PrimerPremie:5.0软件进行引物、探针设计。内参基因 U6,F Primer:5'-CTGCTTCGGCAGCACA-3';R Primer:5'-AACGCTTCACGAATTTGCGT-3';Probe:CCATGCTAATCTTCTCTGTATCGTTCCA目的基因miR-21,特异性反转录引物miR-21 RT:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAACATCAG-3';F Primer:5'-ACACTCCAGCTGGGTAGCTTATCAGACTG-3';R Primer:5'-TGGTGTCGTGGAGTCG-3';Probe:CAATTCAGTTGAGTCAACATCAGTC。
1.4 Real-Time PCR反应
1.4.1 SYBR GreenⅠ染料法 总反应体积为 20 μl,2×SYBR Green PCR Master Mix,10 μl;F Primer(10 μmol/L),1 μl;R Primer(10 μmol/L),1 μl;ddH2O,7 μl;Template(cDNA),1 μl。冰浴中充分混匀扩增反应条件:95℃ 10 min变性,95℃ 15 s,60℃ 1 min,40个循环。扩增完后,进行熔解曲线分析60℃2 min,以0.1℃/s的速率升温,直到95℃;整个过程进行连续采集荧光,获得其扩增曲线和熔解曲线并分析后的CT值。
1.4.2 TaqMan探针法 总反应体积为 25 μl,2×HS PCR Master Mix,12.5 μl;F Primer(10 μmol/L),0.5 μl;R Primer(10 μmol/L),0.5 μl;Probe(10 μmol/L),0.5 μl;ddH2O,9 μl;Template(cDNA),2 μl。冰浴中充分混匀。扩增反应条件:95℃ 2 min变性,95℃ 10 s,60℃ 60 s,40个循环。
1.5 Northern Blot试验
1.5.1 变性PAGE电泳 1×TBE,25 W预跑 (1 h)。15 μl样品立即冰浴5 min,加入加样孔。在5 W电压下,电泳30 min,再用10 W电压电泳约80 min。
1.5.2 转膜、交联 0.5×TBE中,充分湿润尼龙膜及厚滤纸2张。平铺在半干转膜仪上,盖上转印槽,加入稳定电流0.8 mA/cm2,60 min;转膜后用2×SSC冲洗膜2次。将膜放在紫外线交联仪中 (85 000 μJ/cm2),并用两层干净滤纸把膜包在中间,然后再用干胶仪抽真空干烤 (80℃)2 h。
1.5.3 预杂交、标记及杂交 尼龙膜用2×SSC的润湿,后把膜放入杂交瓶,预热预杂交/杂交液37℃,10 min以上,准备鲑精DNA,95~100℃,5 min,然后冰上15 min。每ml预杂交/杂交液加入10 μl(100 μg) 鲑精DNA。在杂交管中加入事先预热的预杂交/杂交液及鲑精,放于杂交炉中,37℃以最慢转速转2 h~ON(over night)。
1.5.4 探针制备 探针制备参见引物序列的设计与合成部分,反应体系为20 μl混合物,反应条件:37℃孵育1 h,70℃灭活15 min;把探针加入到变性的鲑精DNA中,混合均匀后放入杂交炉,37℃,24 h~ON。
1.5.5 洗膜、放射自显影及探针的去除/洗脱 加入2×SSC,洗去残留同位素。用镊子取出膜,用保鲜膜包膜磷屏中曝光。用严谨洗脱液 (0.1%SDS,0.1×SSC)洗1~3次。方法:杂交炉内85~90℃,旋转40 min。
1.6 统计学方法 使用MX-3000P软件收集整个PCR过程中的荧光,采用相对定量法,分析乳腺癌细胞内miR-21基因相对于U6内参基因的表达变化,所有样本的检测均平行重复3次,PCR扩增后,采集对应的CT值,得到乳腺癌组织和癌旁组织的Mean CT值和△CT值。应用SPSS 15.0统计软件进行统计学分析,计量资料以 (±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 RNA抽提质量鉴定结果 提取的Total RNA经1%琼脂糖凝胶电泳检测RNA完整性。凝胶电泳图从左到右依次为1~28号样本 (见图1)。
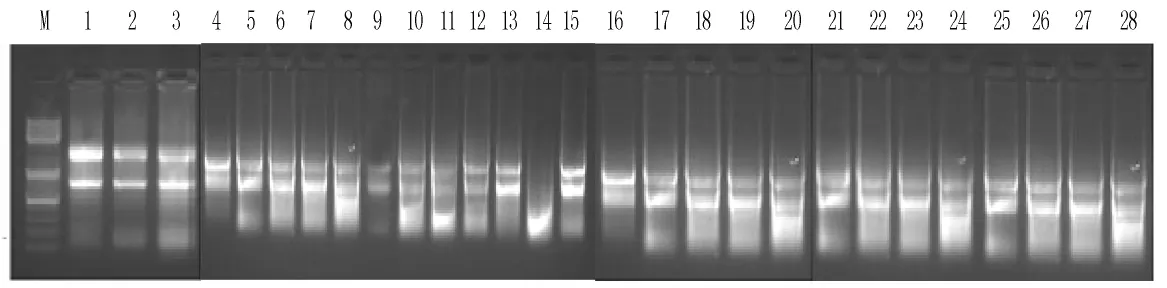
图1 Total RNA 1%琼脂糖凝胶电泳检测RNA完整性Figure 1 AGE of total RNA
2.2 PCR扩增结果
2.2.1 扩增曲线结果 扩增曲线显示SYBR GreenⅠ染料法和TaqMan探针法扩增的U6及miR-21的扩增曲线符合PCR扩增规律,表明其结果可靠 (见图2~5)。
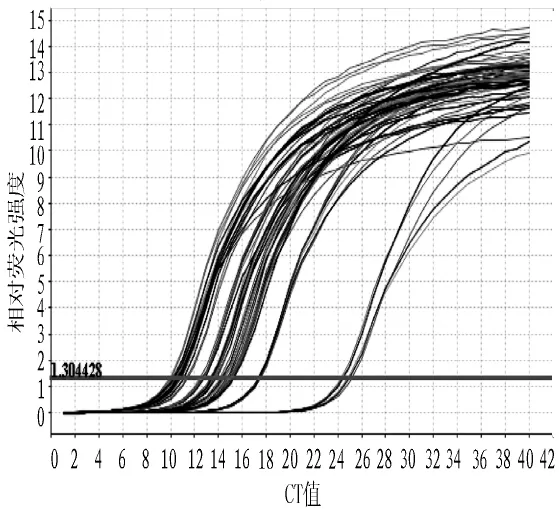
图2 SYBR GreenⅠ染料法的U6扩增曲线Figure 2 U6 amplification curve of SYBR GreenⅠdye method
2.2.2 熔解曲线结果 U6熔解温度为82.1℃ (见图6),MiR-21熔解温度为80.6℃ (见图7)。
2.3 乳腺癌组织与癌旁组织miR-21表达结果 SYBR GreenⅠ染料法检测乳腺癌组织与癌旁组织中miR-21的表达,差异有统计学意义 (t=6.704,P=0.000,见表1);TaqMan探针法检测乳腺癌组织与癌旁组织中miR-21的表达,差异有统计学意义 (t=7.238,P=0.000,见表2)。SYBR GreenⅠ染料法与TaqMan探针法检测乳腺癌组织中miR-21表达,差异无统计学意义 (t=2.33,P=0.053);SYBR GreenⅠ染料法与TaqMan探针法检测乳腺癌旁组中miR-21表达,差异无统计学意义 (t=0.07,P=0.95)。

图3 TaqMan探针法的U6扩增曲线Figure 3 U6 amplification curve of TaqMan probe method
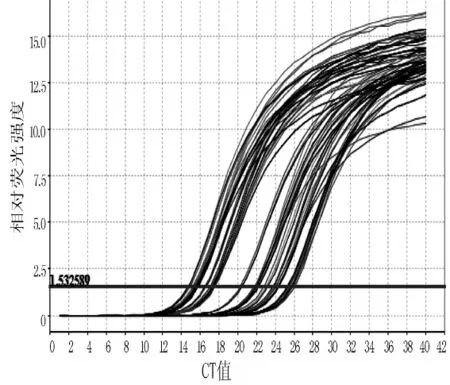
图4 SYBR GreenⅠ染料法的miR-21扩增曲线Figure 4 miR-21 amplification curve of SYBR GreenⅠdye method
表1 SYBR GreenⅠ染料法检测U6及miR-21表达的比较 (±s)Table 1 Comparison of expression of U6 and miR-21 detected by SYBR GreenⅠdye method
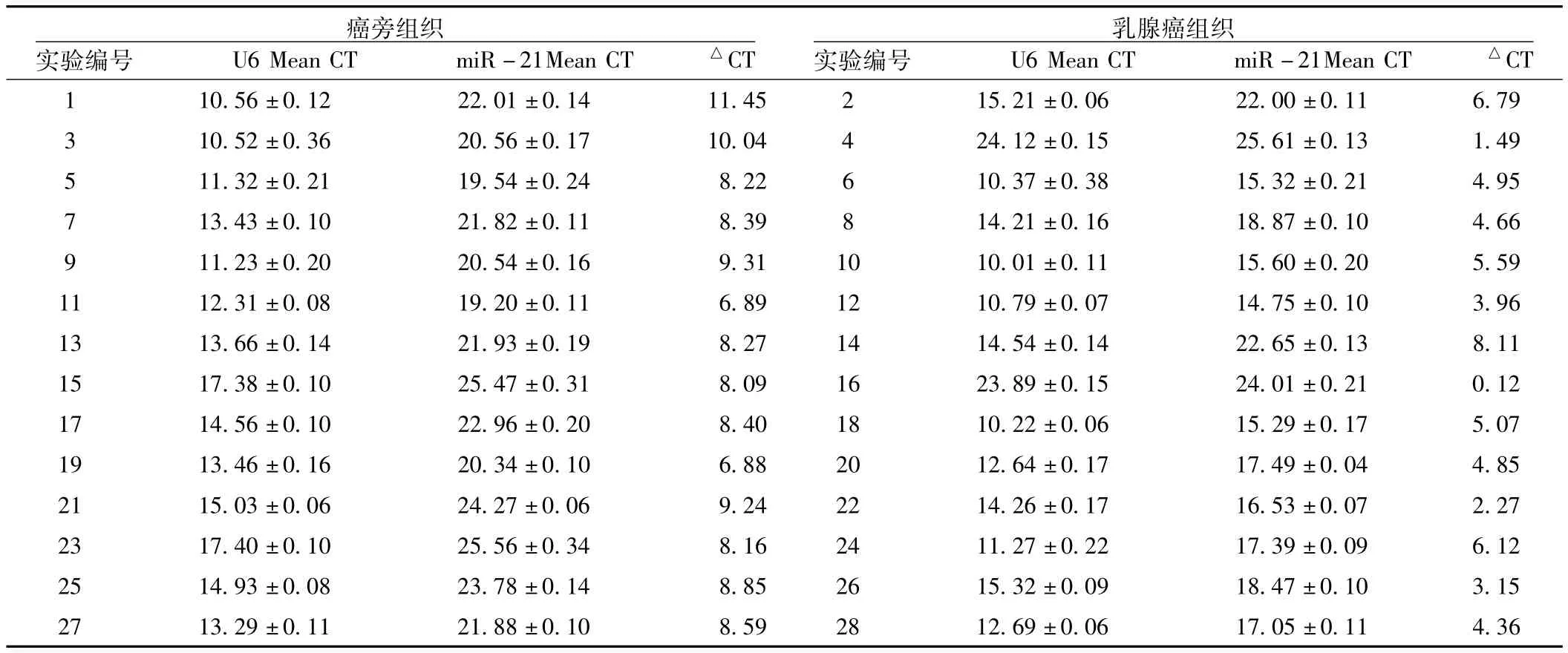
表1 SYBR GreenⅠ染料法检测U6及miR-21表达的比较 (±s)Table 1 Comparison of expression of U6 and miR-21 detected by SYBR GreenⅠdye method
注:△CT值为miR-21 Mean CT减去U6 Mean CT
癌旁组织实验编号 U6 Mean CT miR-21Mean CT △CT 1 10.56±0.12 22.01±0.14 11.45 2 15.21±0.06 22 CT乳腺癌组织实验编号 U6 Mean CT miR-21Mean CT △7.05±0.11 4.36.00±0.11 6.79 3 10.52±0.36 20.56±0.17 10.04 4 24.12±0.15 25.61±0.13 1.49 5 11.32±0.21 19.54±0.24 8.22 6 10.37±0.38 15.32±0.21 4.95 7 13.43±0.10 21.82±0.11 8.39 8 14.21±0.16 18.87±0.10 4.66 9 11.23±0.20 20.54±0.16 9.31 10 10.01±0.11 15.60±0.20 5.59 11 12.31±0.08 19.20±0.11 6.89 12 10.79±0.07 14.75±0.10 3.96 13 13.66±0.14 21.93±0.19 8.27 14 14.54±0.14 22.65±0.13 8.11 15 17.38±0.10 25.47±0.31 8.09 16 23.89±0.15 24.01±0.21 0.12 17 14.56±0.10 22.96±0.20 8.40 18 10.22±0.06 15.29±0.17 5.07 19 13.46±0.16 20.34±0.10 6.88 20 12.64±0.17 17.49±0.04 4.85 21 15.03±0.06 24.27±0.06 9.24 22 14.26±0.17 16.53±0.07 2.27 23 17.40±0.10 25.56±0.34 8.16 24 11.27±0.22 17.39±0.09 6.12 25 14.93±0.08 23.78±0.14 8.85 26 15.32±0.09 18.47±0.10 3.15 27 13.29±0.11 21.88±0.10 8.59 28 12.69±0.06 1
表2 TaqMan探针法检测U6及miR-21表达的比较 (±s)Table 2 Comparison of expression of U6 and miR-21 detected by TaqMan probe method
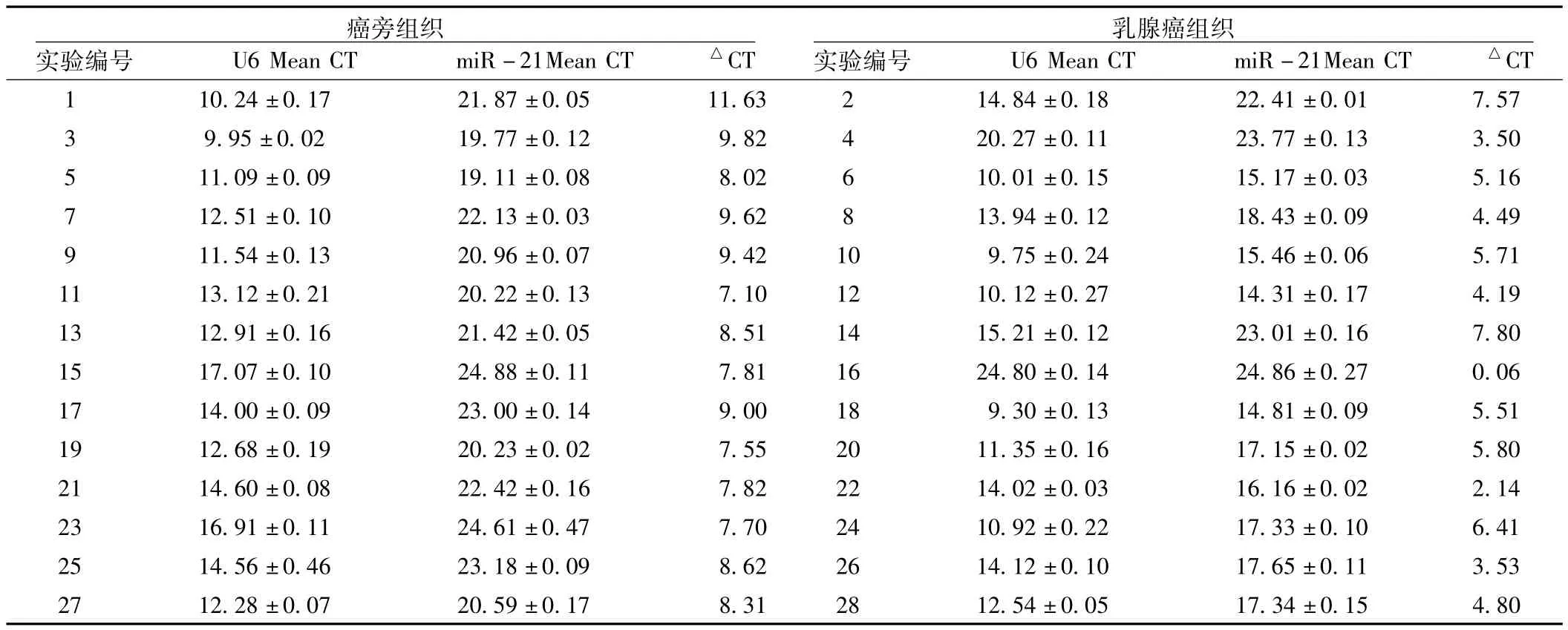
表2 TaqMan探针法检测U6及miR-21表达的比较 (±s)Table 2 Comparison of expression of U6 and miR-21 detected by TaqMan probe method
注:△CT值为miR-21 Mean CT值减去U6 Mean CT
癌旁组织实验编号 U6 Mean CT miR-21Mean CT △CT 1 10.24±0.17 21.87±0.05 11.63 2 14.84±0.18 22 CT乳腺癌组织实验编号 U6 Mean CT miR-21Mean CT △7.34±0.15 4.80.41±0.01 7.57 3 9.95±0.02 19.77±0.12 9.82 4 20.27±0.11 23.77±0.13 3.50 5 11.09±0.09 19.11±0.08 8.02 6 10.01±0.15 15.17±0.03 5.16 7 12.51±0.10 22.13±0.03 9.62 8 13.94±0.12 18.43±0.09 4.49 9 11.54±0.13 20.96±0.07 9.42 10 9.75±0.24 15.46±0.06 5.71 11 13.12±0.21 20.22±0.13 7.10 12 10.12±0.27 14.31±0.17 4.19 13 12.91±0.16 21.42±0.05 8.51 14 15.21±0.12 23.01±0.16 7.80 15 17.07±0.10 24.88±0.11 7.81 16 24.80±0.14 24.86±0.27 0.06 17 14.00±0.09 23.00±0.14 9.00 18 9.30±0.13 14.81±0.09 5.51 19 12.68±0.19 20.23±0.02 7.55 20 11.35±0.16 17.15±0.02 5.80 21 14.60±0.08 22.42±0.16 7.82 22 14.02±0.03 16.16±0.02 2.14 23 16.91±0.11 24.61±0.47 7.70 24 10.92±0.22 17.33±0.10 6.41 25 14.56±0.46 23.18±0.09 8.62 26 14.12±0.10 17.65±0.11 3.53 27 12.28±0.07 20.59±0.17 8.31 28 12.54±0.05 1
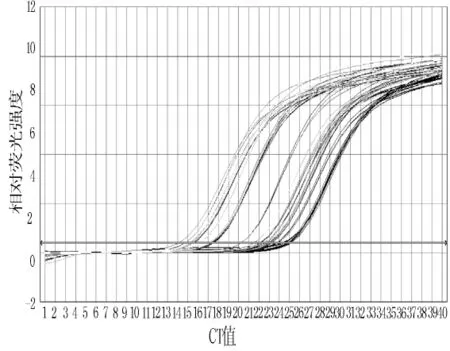
图5 TaqMan探针法的miR-21扩增曲线Figure 5 miR-21 amplification curve of TaqMan probe method
2.4 Northern Blot检测miR-21在乳腺癌组织及癌旁组织中的表达情况 Northern Blot检测乳腺癌组织和癌旁组织中miR-21的表达,探针分别为miR-21和U6的反义链,由32P标记。用Image Quant软件测定灰度值评定信号表达强弱,结果表明,乳腺癌组织中miR-21高表达,而癌旁组织中miR-21低表达 (见图8、9)。
3 讨论
因miR在不同物种和组织中表达水平上有很大的差异,能准确、灵敏地检测出miR在相应组织器官中的含量就变得非常重要,并且miR是一类很小的同源分子,部分小RNA的表达水平可能很低,因此需要极为灵敏而定量的检测方法。基于miR在各方面的重要作用,迫切需要一种简单、快捷,低成本的检测方法用于临床检验。
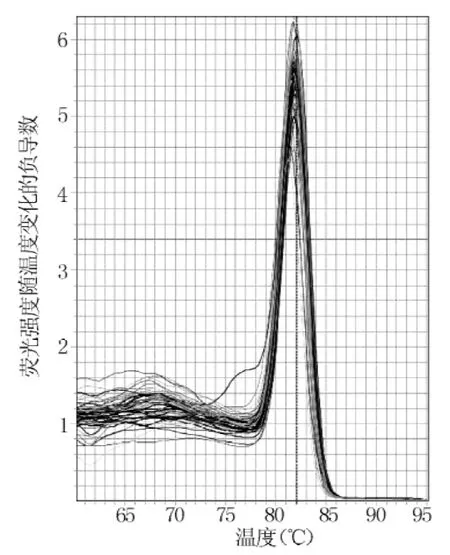
图6 U6的熔解曲线Figure 6 U6 melting curve
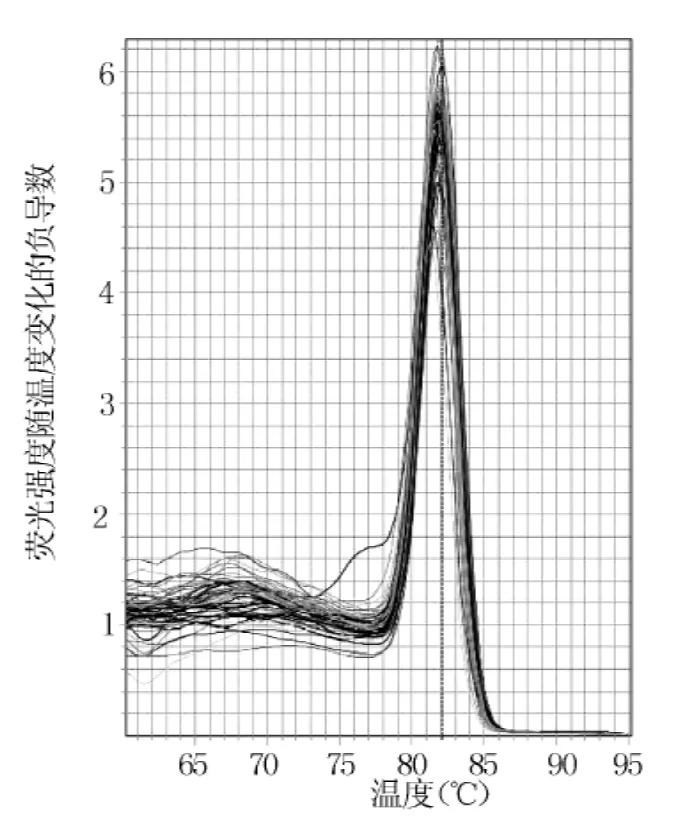
图7 miR-21熔解曲线Figure 7 miR-21 melting curve

图8 Northern Blot显示miR-21在乳腺癌及癌旁组织中的表达情况Figure 8 Expression of miR-21 in breast cancer and surrounding tissues showed by Northern Blot
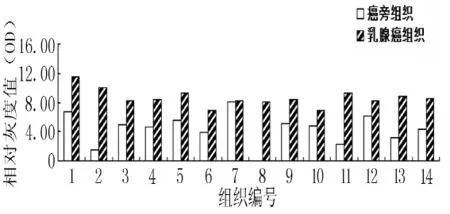
图9 Northern Blot显示miR-21在乳腺癌及癌旁组织中的表达情况的相对灰度值Figure 9 Relative gray value of miR-21 in breast cancer and surrounding tissues showed by Northern Blot
目前已经发展了多种有效的miR-21检测方法:(1)克隆测序:用于发现新的miR-21的首选方法。(2)芯片技术:可以实现快速、高通量的检测。但是基因芯片检测方法的信息质量的稳定性和可重复性比较差,对获得的结果通常需要采用Northern Blot和实时FQ-PCR方法进行验证。 (3)Northern Blot:是验证和确认miR的重要方法,但该方法繁琐灵敏度较低并且时间较长,不适合用于高通量检测。 (4)实时FQ-PCR可以精确地定量分析miR的表达,常用的有茎一环的RT-PCR方法 (stem-loop RT-PCR)和poly A加尾的RT-PCR方法[2]。实时FQ-PCR方法具有检测范围宽、灵敏性高、精确度高、产出率高、可以进行多重检测的优点。从原理上讲有2大类荧光模式:第1种为荧光杂交探针,如Taq-Man等。第2种为 DNA结合染料,如 SYBR GreenⅠ等。SYBR GreenⅠ实时FQ-PCR法,引物设计较简单且只需合成序列特异引物,成本相对较低,使用方便等优点而被广泛应用[3-5],但是相对而言特异性较差,易受引物二聚体的影响。通过优化反应体系和荧光捕获点,运用熔解曲线和凝胶电泳可证实其特异性,SYBR GreenⅠ实时FQ-PCR检测方法可成为一种高敏感性和特异性的方法[6]。
Northern Blot及其衍生方法对miR的定量而言,有一定的优势,并且也是国际上公认的检测miR的“金标准”[7],现已被广泛应用于miR的表达分析。但用这类方法检测需要的RNA样本量非常大,技术复杂,费时、费力,并且对RNase污染非常敏感,任何一步操作不当都会影响其准确性。因此对检测人员专业程度要求非常高,所以就不可避免地限制了其应用,使其很难引入临床检验。
本研究在检测miR-21上应用了通用型荧光染料SYBR GreenⅠ染料法和TaqMan探针法,同时检测14对乳腺癌组织和癌旁组织。用t检验比较SYBR GreenⅠ染料法检测乳腺癌组织和癌旁组织中miR-21的表达结果间有显著性差异,比较TaqMan探针法检测乳腺癌组织及癌旁组织中miR-21的表达结果间有显著性差异,比较SYBR GreenⅠ染料法和TaqMan探针法检测乳腺癌组织和癌旁组织中miR-21的表达结果间无显著性差异,并同时应用Northern Blot法进行验证,检测乳腺癌组织及癌旁组织中miR-21的表达,结果与染料法和探针法相符,证明染料法与探针法检测结果可靠。SYBR GreenⅠ染料法熔解曲线单一特异性好,无非特异性产物和引物二聚体。在优化好实验反应条件提高荧光染料检测的特异性,避免非特异性荧光检测的前提下,SYBR GreenⅠ染料法替代Taq-Man探针法进行多个基因定量表达的检测是完全可行的。SYBR GreenⅠ染料法精确度高,成本相对较低,是更加适用于临床应用的检验方法。
此研究后续还可进行血、乳腺癌组织中的miR-21与乳腺癌的分型、分期、进展和预后的相关性研究,以此为乳腺癌的诊治提供更多、更可靠的依据。
1 Hossain A,Kuo MT,Saunders GF.Mir-17-5p regulates breast cancer cell proliferation by inhibiting translation of AIB1 mRNA [J].Mol Cell Biol,2006,26(21):8191 -8201.
2 Laterza OF,Lim L,Garrea-Engele PW,et al.Plasma MicroRNAs as sensitive and specific biomarkers of tissue injury[J].Clin Chem,2009,55(11):1977-1983.
3 冯志新,姜平.猪细胞因子SYBR Green实时PCR检测方法的建立[J].现代生物医学进展,2007,7(1):108-111.
4 岳华.新城疫病毒的荧光定量RT-PCR检测及RNA干扰[D].重庆:西南农业大学,2006.
5 童桂香,谢芝勋,黄琦,等.禽呼肠孤病毒实时荧光定量RTPCR检测方法的建立 [J].中国兽医科学,2007,37(9):767-771.
6 罗婵,王志强,公方强,等.SYBR Green实时荧光定量PCR检测水牛体细胞组蛋白乙酰化相关基因mRNA表达[J].中国兽医学报,2009,29(2):233-237.
7 Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci USA,2004,101(11):2999 -3004.
