三羟异黄酮对永久性脑梗死大鼠的神经保护作用及对神经干细胞增生的影响
2013-09-04姜正林施建生马东明李建成李永财许世辉
朱 琳,姜正林,何 鹏,施建生,马东明,李建成,李永财,许世辉
(1 南通大学航海医学研究所,江苏南通 226001;2 南通大学附属医院;3 宁夏回族自治区人民医院)
三羟异黄酮(GST)属异黄酮类植物雌激素。研究显示,异黄酮类物质可减小脑梗死体积,提高存活的神经细胞数;通过减弱C-fos表达来阻止大脑中动脉闭塞(MCAO)诱导的计划性细胞死亡;激活脑内的MAPK信号通路,从而发挥神经保护作用[1]。2012年3~9月,我们通过制备大鼠永久性大脑中动脉栓塞(pMCAO)模型,观察GST对大鼠神经功能、脑梗死体积、神经干细胞数目、神经再生相关因子的影响,探讨GST的神经保护作用及其对神经干细胞增生的影响机制。
1 材料与方法
1.1 动物与试剂 清洁级成年雄性SD大鼠170只,体质量260~280 g,由南通大学动物试验中心提供。GST(Sigma公司),神经生长因子(NGF)、神经细胞黏附分子(NCAM)、肌腱蛋白C(TN-C)、髓鞘相关生长抑制因子(Nogo-A)、胶质细胞来源的神经营养因子(GDNF)ELISA检测试剂盒(上海继锦化学科技有限公司),兔抗 Nestin抗体(N5413,Sigma公司),FITC标记的猴抗鼠IgG(Jackson)和FITC标记的山羊抗兔IgG(Sigma公司)。
1.2 方法
1.2.1 模型制备 将大鼠分为假手术组、缺血对照组、GST治疗组。采用线栓法制作pMCAO模型。将大鼠用10%水合氯醛麻醉,仰卧固定,沿颈部正中线切开,分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),结扎CCA近心端及ECA起始部,止血夹夹闭ICA,在CCA上作一小切口,将直径0.18 mm的栓线从CCA插入ICA,直至有阻力为止,说明栓线穿过MCA起始段并达到大脑前动脉(ACA)近端。栓线插入深度距ECA分叉处(18.5±0.5)mm。结扎固定栓线,缝合皮肤。假手术组栓线只插入1 cm,其余步骤同模型组。动物苏醒后对侧肢体痛觉刺激缺失及运动障碍即为模型成功。
术后3 h开始腹腔注射用药,神经行为学评分、尼氏染色观察时GST治疗剂量分为50、100 μg/kg;脑梗死体积测定、BrdU-Nestin免疫荧光双标、ELISA 检测时 GST 剂量为50 μg/kg,每24 h 1次,直到实验终点。排除实验过程中死亡的大鼠后,神经行为学评分四组各9只,尼氏染色四组各7只,脑梗死体积测定三组各9只,BrdU-Nestin免疫荧光双标三组各8只,神经再生相关因子测定三组各6只。
1.2.2 神经行为学评分 于术前及术后1、2、3、4、5 d,参照改进的神经功能缺损症状评分(18分制)进行神经行为学评分。1~6分提示轻度损害,7~12分提示中度损害,13~18分提示严重损害。
1.2.3 脑梗死体积测量 术后72 h,大鼠深度麻醉后,迅速断头取脑,去除嗅球放入脑槽,-20℃冷冻10 min。从额极到枕极作2 mm厚连续额状切片,将脑片放入1%TTC溶液中,37℃避光孵育30 min,4%多聚甲醛缓冲液中固定,过夜。拍照并输入计算机,用Image Pro Plus图像处理软件计算梗死面积。
1.2.4 神经细胞计数 将大鼠麻醉,350 mL生理盐水快速心脏灌注后,继续用4℃的4%多聚甲醛灌注,取脑,多聚甲醛固定,20%、30%的蔗糖梯度脱水,切片做尼氏染色,高倍镜下分别计数前囟后1.70~2.30 mm缺血侧海马CA1区、CA3区、Cortex区完整的锥体细胞数目,每张切片计数3个区域,连续观察7张脑片,取平均数。
1.2.5 免疫荧光检测与细胞计数 大鼠术后第3、4、5天分别腹腔注射5-溴脱氧尿嘧啶核苷(BrdU)溶液50 mg/kg,2次/d。于术后第6天灌注、取材、固定、脱水、切片,进行BrdU-Nestin免疫荧光双标检测,BrdU和Nestin共标的细胞为增生的神经干细胞。在缺血侧海马区的前、中、后部取3张脑片,免疫荧光显色后,用荧光显微镜采集图片,将双标的图片拼合,高倍镜下计数皮质缺血损伤区周边、海马CA3和海马CA1区重合的细胞数,取3张脑片的平均值作为该大鼠缺血侧该区域的细胞数。
1.2.6 神经再生相关因子检测 大鼠术后第5天断头取脑,组织匀浆,提取蛋白,用BCA蛋白浓度测定试剂盒进行蛋白定量。采用大鼠ELISA试剂盒测定 NGF、NCAM、TN-C、GDNF、Nogo-A 浓度。取出板条复温后,依次加入标本、标准品、HRP标记的检测抗体,经过温浴并彻底洗涤,底物TMB显色,用酶标仪在450 nm波长下测定吸光度OD值,计算样品浓度,然后再用样品浓度除以总的蛋白浓度,得出单位总蛋白中所含样品的量。
1.2.7 统计学方法 采用SPSS19.0统计软件,结果以表示,神经行为学评分采用秩和检验;其余数据采用单因素方差分析,两两比较用Scheffe法。P≤0.05为差异有统计学意义。
2 结果
2.1 GST对pMCAO大鼠神经功能缺损症状评分的影响 见表1。
2.2 GST对pMCAO大鼠脑梗死体积的影响 术后72 h TTC染色显示,梗死区与右侧MCA供血区一致。缺血对照组梗死体积为(29.80±1.64)%,GST 50 μg/kg治疗组为(19.73 ±1.72)%,两组比较有统计学差异(P<0.01)。
表1 各组不同时间点神经功能缺损症状评分比较(分,)
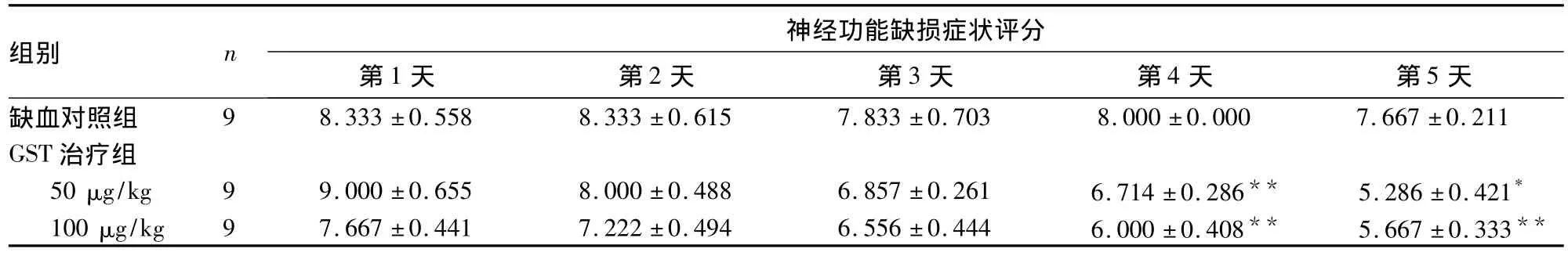
表1 各组不同时间点神经功能缺损症状评分比较(分,)
注:与缺血对照组比较,*P <0.05,**P <0.01
组别 n神经功能缺损症状评分第1天 第2天 第3天 第4天 第5天缺血对照组 9 8.333 ±0.558 8.333 ±0.615 7.833 ±0.703 8.000±0.000 7.667 ±0.211 GST治疗组50 μg/kg 9 9.000 ±0.655 8.000 ±0.488 6.857 ±0.261 6.714 ±0.286** 5.286 ±0.421*100 μg/kg 9 7.667 ±0.441 7.222 ±0.494 6.556 ±0.444 6.000 ±0.408** 5.667 ±0.333**
2.3 GST对pMCAO大鼠脑细胞形态和数目的影响 术后5 d脑组织尼氏染色显示,假手术组海马CA1、CA3区细胞层次清楚,细胞结构完整,胞质均匀,胞核圆大;皮质部神经元形态无明显异常,细胞排列较紧密,胞核饱满,核仁清晰。缺血对照组缺血侧海马CA1、CA3区细胞排列紊乱、形态不规则,细胞缺失,胞核固缩;缺血侧皮质部着色明显变淡,神经元缩小变形,核固缩。GST 50 μg/kg治疗组和100 μg/kg治疗组缺血侧相应区域细胞排列较规整,形态基本正常,细胞略有丢失。各组海马区锥体细胞计数比较见表2。
表2 各组海马区椎体细胞计数比较(个/H,)
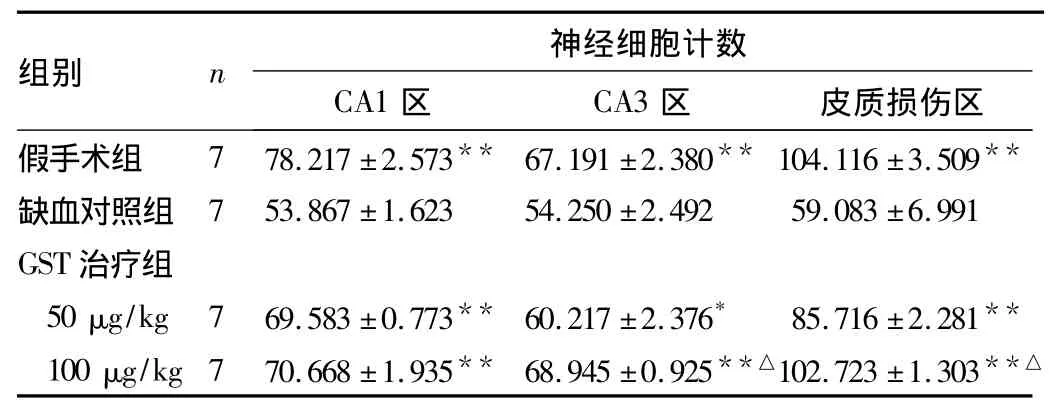
表2 各组海马区椎体细胞计数比较(个/H,)
注:与对照组比较,*P <0.05,**P <0.01;与低剂量组比较,△P<0.01
**假手术组 7 78.217 ±2.573** 67.191 ±2.380** 104.116 ±3.509缺血对照组 7 53.867 ±1.623 54.250 ±2.492 59.083 ±6.991 GST治疗组50 μg/kg 7 69.583 ±0.773** 60.217 ±2.376* 85.716 ±2.281**100 μg/kg 7 70.668 ±1.935** 68.945 ±0.925**△102.723 ±1.303**△
2.4 GST对pMCAO大鼠神经再生相关因子表达的影响 见表3。
表3 各组神经再生相关因子在脑组织中表达量的变化(ng/mL,)
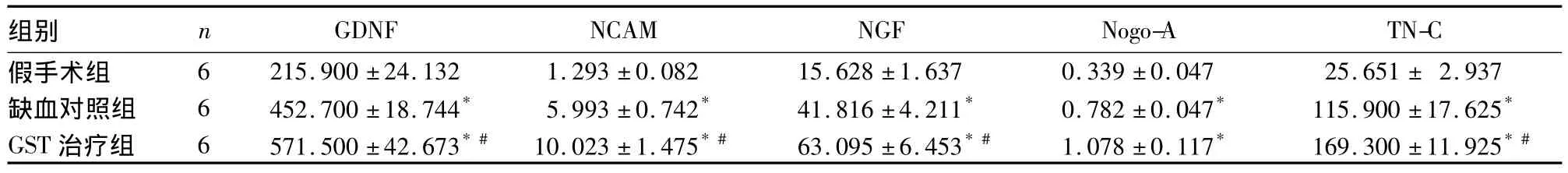
表3 各组神经再生相关因子在脑组织中表达量的变化(ng/mL,)
注:与假手术组比较,*P <0.01;与缺血对照组比较,#P <0.01
组别 n GDNF NCAM NGF Nogo-A TN-C假手术组 6 215.900 ±24.132 1.293 ±0.082 15.628 ±1.637 0.339 ±0.047 25.651 ± 2.937缺血对照组 6 452.700 ±18.744* 5.993 ±0.742* 41.816 ±4.211* 0.782 ±0.047* 115.900 ±17.625*GST 治疗组 6 571.500 ±42.673*# 10.023 ±1.475*# 63.095 ±6.453*# 1.078 ±0.117* 169.300 ±11.925*#
2.5 GST对神经干细胞增生的影响 大鼠pMCAO 5 d后,缺血对照组和GST治疗组皮质损伤区周边均有增生的神经干细胞,BrdU-Nestin阳性细胞计数分别为(15.210 ±1.270)、(22.500 ±0.430)个/HP。与缺血对照组的(1.000±0.200)个/HP 相比,GST 治疗组增生的神经干细胞数目明显增多(P<0.01)。
3 讨论
GST是从天然植物中提取的异黄酮类雌激素,具有与雌激素类似的作用,而无雌激素的严重不良反应。异黄酮类物质具有神经保护作用。慈春增等[2]发现,GST对脑缺血后卵巢去势雌性大鼠有神经保护作用,可提高其学习记忆的能力。脑缺血后主要的损伤机制包括氧自由基、兴奋性氨基酸的产生、细胞内钙超载、炎症反应和细胞凋亡。本研究发现,GST可减少大鼠pMCAO局灶性永久性脑梗死体积,改善神经行为学症状,减少缺血损伤后神经元的丢失,促进神经干细胞的增生,增加神经再生相关因子在脑组织中的表达,表明GST对大鼠永久性脑缺血损伤具有明显的神经保护及促进神经干细胞增生的作用。其作用机制可能与扩张血管,增加脑血流量,改善脑缺血缺氧,清除氧自由基,减轻脑水肿,抑制炎症反应,减少神经细胞凋亡有关[1,2]。本研究还发现,脑损伤后缺血灶周围脑组织中的神经再生相关因子 NGF、NCAM、TN-C、Nogo-A、GDNF 表达增加,GST治疗可进一步升高上述神经再生相关因子的表达量。
新生鼠缺氧缺血性脑损伤时,NGF和BDNF能减少神经细胞凋亡[3],发挥神经保护作用。雄性新西兰家兔MCAO 2、3、5 h后,NGF治疗可显著改善神经功能障碍,减少脑梗死体积、神经细胞凋亡及Caspase-3表达,上调Bcl-2表达[4]。由小干扰RNA(siRNA)引起的NCAM下调在小鼠MCAO模型中可导致脑梗死体积增大,显著加剧神经元损害[5]。GDNF对缺血性脑损伤基于直接保护作用,局部应用可显著减小MCAO大鼠的脑梗死体积、减轻脑水肿[6]。Nogo-A蛋白导入体外培养的大脑皮质神经元能拮抗由外源性H2O2引起的氧化应激[7]。提示GST对脑缺血大鼠的神经保护作用可能与上调上述因子的表达、营养与保护神经细胞、减轻神经细胞损伤有关。
NGF可与酪氨酸激酶受体TrkA、TrkB、TrkC和常见的神经营养因子受体p75NTR结合,调节神经元的存活、轴突生长、突触重塑和神经传导,还可调节生长锥和轴突中F-肌动蛋白的聚合和积累刺激轴突生长[8]。NCAM介导多种细胞—细胞间的相互作用,对神经系统发育的不同方面,包括细胞迁移、轴突生长和突触的形成都有重要作用[9]。有研究显示,Nogo-A参与继发性轴索变性,下调Nogo-A的表达可减少轴索损伤、增强轴突再生,抑制Nogo-A可减少MCAO大鼠的丘脑神经元损伤[10]。GDNF通过糖基磷脂酰肌醇锚定的细胞表面受体、GDNF家族受体α1调节细胞活性,通过跨膜RET酪氨酸受体信号通路或神经细胞黏附分子促进细胞的存活、轴突生长和突触形成[11]。脊髓损伤后,GDNF通过MEK-ERK信号通路作用增强轴突生长、突触连接以及 GABA能神经递质传递,改善功能障碍[12]。在体研究表明,TN-C可由参与髓鞘形成的施万细胞合成,其沿生长锥伸展的路径分布,有轴突诱导功能。胎鼠脊髓神经元缺气损伤模型研究表明,TN-C可明显促进神经元的活性及突起生长[13]。因此,GST通过增强上述神经再生相关因子的表达,促进神经元突起的生长、突触重塑,改善神经功能缺损症状。
中枢神经系统中,不同的细胞因子在神经干细胞增生、迁移、分化,最终形成神经系统的各类细胞过程中具有重要作用。NCAM广泛存在于中枢神经系统,在细胞增生、迁移、轴突生长和突触重塑中有重要作用。NCAM和成纤维细胞生长因子受体相互作用,激活MAPK/ERK信号通路,从而诱导骨髓间充质干细胞的迁移和分化[14]。作为发育中神经组织细胞外基质的主要成分,TN-C与细胞增殖、迁移和形态相关。TN-C能促进少突胶质前体细胞的发育程序调节蛋白增殖及向髓鞘形成区域迁移[15]。GDNF对不同的外周神经元的存活、增殖和分化是必不可少的,在缺血缺氧新生大鼠模型中植入多能星形胶质干细胞,NGF、GDNF能促进干细胞的迁移和分化[16]。Nogo-A可调节体内的脑皮层神经元的迁移,敲小鼠敲除Nogo-A基因后,其前脑神经前体细胞的迁移会受到干扰。本研究发现,GST治疗组BrdU-Nestin共标的神经干细胞数目明显增多,表明GST可能通过刺激以上因子表达,诱导神经干细胞增生,继而分化为具有功能的神经元,并迁移到相关功能区,促进损伤脑组织的修复与神经功能的恢复。
综上所述,GST对缺血损伤脑组织具有保护作用,可促进缺血损伤后神经再生相关因子的表达和神经干细胞的增生,促进神经功能恢复,这为临床应用GST治疗缺血性卒中提供了实验依据。
[1]么晓轶,李颖.植物雌激素对去势雌性大鼠缺血性脑损伤的神经保护作用[J].中国神经免疫学和神经病学杂志,2005,12(3):160-163.
[2]慈春增,王鲁娟,王凤斌.植物性雌激素三羟异黄酮对脑缺血大鼠学习记忆的影响[J].中国康复医学杂志,2005,20(8):579-581.
[3]Wang Y,Cao M,Liu A,et al.Changes of inflammatory cytokines and neurotrophins emphasized their roles in hypoxic-ischemic brain damage[J].Int J Neurosci,2013,123(3):191-195.
[4]Yang JP,Liu HJ,Yang H,et al.Therapeutic time window for the neuroprotective effects of NGF when administered after focal cerebral ischemia[J].Neurol Sci,2011,32(3):433-441.
[5]Shichi K,Fujita-Hamabe W,Harada S,et al.Involvement of matrix metalloproteinase-mediated proteolysis of neural cell adhesion molecule in the development of cerebral ischemic neuronal damage[J].J Pharmacol Exp Ther,2011,338(2):701-710.
[6]Abe K.Gene-stem cell therapy for ischemic stroke[J].Brain Nerve,2009,61(9):1043-1049.
[7]Mi YJ,Hou B,Liao QM,et al.Amino-Nogo-A antagonizes reactive oxygen species generation and protects immature primary cortical neurons from oxidative toxicity[J].Cell Death Differ,2012,19(7):1175-1186.
[8]Lykissas MG,Batistatou AK,Charalabopoulos KA,et al.The role of neurotrophins in axonal growth,guidance,and regeneration[J].Curr Neurovasc Res,2007,4(2):143-151.
[9]Hata K,Polo-Parada L,Landmesser LT.Selective targeting of different neural cell adhesion molecule isoforms during motoneuron myotube synapse formation in culture and the switch from an immature to mature form of synaptic vesicle cycling[J].J Neurosci,2007,27(52):14481-14493.
[10]Wang F,Liang Z,Hou Q,et al.Nogo-A is involved in secondary axonal degeneration of thalamus in hypertensive rats with focal cortical infarction[J].Neuroscience Letters,2007,417(3):255-260.
[11]Duarte EP,Curcio M,Canzoniero LM,et al.Neuroprotection by GDNF in the ischemic brain[J].Growth Factors,2012,30(4):242-257.
[12]Koelsch A,Feng Y,Fink DJ,et al.Transgene-mediated GDNF expression enhances synaptic connectivity and GABA transmission to improve functional outcome after spinal cord contusion[J].J Neurochem,2010,113(1):143-152.
[13]杨大莉,黄文晋,梁喆.Tenascin-C分子中FN6-8片段蛋白对培养的脊髓缺气损伤神经元的影响[J].解剖学报,2000,31(1):5-7.
[14]Shi Y,Xia YY,Wang L,et al.Neural cell adhesion molecule modulates mesenchymal stromal cell migration via activation of MAPK/ERK signaling[J].Exp Cell Res,2012,318(17):2257-2267.
[15]Garwood J,Garcion E,Dobbertin A,et al.The extracellular matrix glycoprotein Tenascin-C is expressed by oligodendrocyte precursor cells and required for the regulation of maturation rate,survival and responsiveness to platelet-derived growth factor[J].Eur J Neurosci,2004,20(10):2524-2540.
[16]Douglas-Escobar M,Rossignol C,Steindler D,et al.Neurotrophin-induced migration and neuronal differentiation of multipotent astrocytic stem cells in vitro[J].PLoS One,2012,7(12):e51706.
