响应曲面法优化大肠菌群初发酵培养基
2013-09-04吕肖楠姜瞻梅郑冬梅韩佳彤
吕肖楠,田 然,姜瞻梅,郑冬梅,韩佳彤,田 波
(东北农业大学乳品科学教育部重点实验室,食品学院,黑龙江哈尔滨150030)
大肠菌群是指一群在37℃、24h能够发酵乳糖、产酸产气、需氧或兼性厌氧的革兰氏阴性无芽孢杆菌[1],广泛存在于人类和动物的肠道中,并且随粪便广泛分布。作为评价食品卫生质量指标的重要标准之一,大肠菌群具有重要的卫生学意义[2]。目前,针对大肠菌群的检测,国家标准方法[3]和国外检测方法[4]中常使用的初发酵培养基为 LST培养基。但是,使用初发酵培养基进行发酵常具有迟缓性、准确性低等缺点。因此,发展一种快速、准确的大肠菌群发酵培养基是十分必要的。本文在标准LST培养基基础上,对培养基中碳源和氮源不同配比对大肠菌群生长速率的影响作用进行研究,利用Box-Behnken响应曲面法优化培养基[5-7],旨在提高大肠菌群的发酵速率,为近一步研究快速检测大肠菌群的方法奠定基础。
1 材料与方法
1.1 材料与仪器
大肠杆菌(Escherichia coli)由东北农业大学食品学院微生物实验室选育、保藏;营养肉汤:蛋白胨10g/L,牛肉粉3g/L,氯化钠5g/L,pH7.2;营养琼脂:蛋白胨10g/L,牛肉粉3g/L,氯化钠5g/L,琼脂15g/L,pH7.2~7.4;LST 培养基:胰蛋白胨 20g/L,氯化钠5g/L,乳糖5g/L,磷酸氢二钾2.75g/L,磷酸氢二钾2.75g/L,月桂基硫酸钠 0.1g/L,pH6.8~7.0;胰蛋白胨、牛肉粉、酵母粉 生物纯,北京奥博星生物技术有限责任公司;琼脂粉 生物纯,日本Solaribio公司;乳糖分析纯,天津市东方卫生材料厂;氯化钠、氢氧化钠 分析纯,天津市凯通化学试剂有限公司。
AL204/01型电子天平 梅特勒-托利多(上海)有限公司;HVE-50高温高压灭菌锅、BHC-1100ⅡA2生物安全柜 北京东联哈尔仪器制造有限公司;HPS-160生化培养箱 哈尔滨东联电子技术开发有限公司;PB-10 pH测定仪 广州浩赛电子仪器有限公司。
1.2 实验方法
1.2.1 菌种活化 将大肠杆菌母种在无菌条件下接种到营养琼脂斜面培养基上,37℃培养24h后,放入4℃冰箱待用。
1.2.2 菌悬液制备 挑取斜面保藏的菌种2~3环接种于9mL营养肉汤培养基中,培养18~24h后,放入4℃冰箱中待用。
1.2.3 培养基优化方法
1.2.3.1 乳糖浓度的确定 以LST培养基为基础,保持其它组分不变,向其中添加不同浓度的乳糖,37℃培养24h,以大肠菌群菌落总数为指标,计数方法参照 GB 4789.2-2010[8],确定乳糖最适添加量。
1.2.3.2 胰蛋白胨浓度的确定 以LST培养基为基础,保持其它组分不变,分别向培养基中添加不同浓度的胰蛋白胨,37℃培养24h,以大肠菌群菌落总数为指标,计数方法参照 GB 4789.2-2010[8],确定胰蛋白胨最适添加量。
1.2.3.3 酵母粉浓度的确定 以LST培养基为基础,保持其它组分不变,分别向培养基中添加不同浓度的胰蛋白胨,37℃培养24h,以大肠菌群菌落总数为指标,计数方法参照 GB 4789.2-2010[8],确定酵母粉最适添加量。
1.2.3.4 响应面分析实验 依据单因素实验的结果,以乳糖、胰蛋白胨和酵母粉浓度为自变量A、B、C,以其最佳浓度为自变量中心点值,设计三因素三水平的响应面分析实验,见表1。
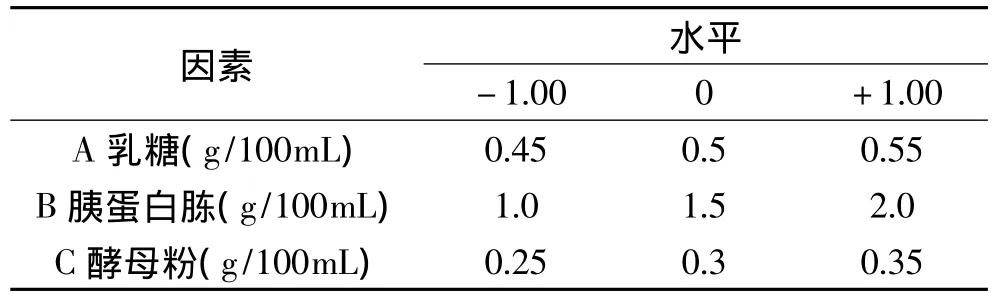
表1 Box-Behnken实验因素与水平Table 1 Factors and levels of Box-Behnken design
2 结果与讨论
2.1 乳糖浓度优化
选取乳糖作为培养基的碳源,考察了不同浓度的乳糖对大肠菌群发酵速率的影响。以37℃,培养24h后的菌落总数作为评价指标,结果见图1。
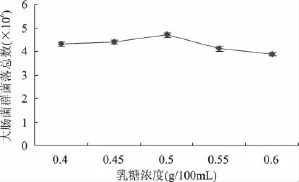
图1 不同乳糖浓度对大肠菌群菌落总数的影响Fig.1 Influence of different concentration of lactose on the TVCs of coliform group
由图1可知,乳糖浓度较小时菌落数较少,浓度较高时会抑制菌体的生长。当乳糖浓度为0.5g/100mL时,菌落总数达到最优值4.7×106cfu/mL。在发酵的过程中,乳糖具有双效的作用,既作为碳源为菌体的生长提供营养物质,同时又作为诱导剂诱导大肠菌群产生β-半乳糖苷酶分解乳糖。乳糖浓度较低时,无法满足菌体生长的需要,使其生长发育受到影响,同时,无法诱导大肠菌群产生β-半乳糖苷酶。随着乳糖浓度的增加,培养基的渗透压不断增加反而会抑制菌体的生长和β-半乳糖苷酶的表达。因此,选取乳糖浓度为0.5g/100mL较为合适。在此浓度时,既能保证菌体的正常生长,又能起到高效的诱导作用。
2.2 胰蛋白胨浓度优化
保持LST培养基中的其它成分不变,向其中添加不同浓度的胰蛋白胨,37℃培养24h后进行菌落计数,得到较优的胰蛋白胨浓度,结果如图2所示。

图2 不同胰蛋白胨浓度对大肠菌群菌落总数的影响Fig.2 Influence of different concentration of tryptone on the TVCs of coliform group
由图2可以看出,胰蛋白胨的浓度对大肠菌群菌体生长有重要作用。随着胰蛋白胨添加量的增加,大肠菌群菌落总数有明显的提高,但添加量达到1.5g/100mL后继续增加其浓度,菌落数呈现出下降趋势。在大肠菌群生长的过程中,胰蛋白胨作为氮源的同时也可提供碳源,为大肠菌群提供必需的生长元素和生长因子,但添加浓度过高会抑制大肠菌群的生长,因此选取较优的胰蛋白胨浓度为1.5g/100mL。
2.3 酵母粉浓度优化
保持LST培养基中的其它成分不变,向其中添加不同浓度的酵母粉,37℃培养24h后进行菌落计数,得到较优的酵母粉浓度,结果如图3所示。
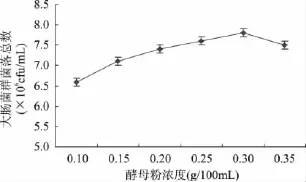
图3 不同酵母粉浓度对大肠菌群菌落总数的影响Fig.3 Influence of different concentration of yeast powder on the TVCs of coliform group
由图3可知,随着酵母粉浓度的提高,菌落总数呈现出逐渐上升趋势,而当酵母粉浓度超过0.3g/100mL时,菌落总数随着酵母粉浓度的增加而呈现出下降趋势。酵母粉富含蛋白质、氨基酸、B族维生素和生长因子等物质,能够为微生物的生长补充氮源和各种维生素及生长因子[9]。较低浓度的酵母粉对大肠菌群的生长并没有明显的促进作用,随着浓度的增加,酵母粉对大肠菌群的生长促进作用逐渐加强。继续增加酵母粉的添加量,由于培养基中渗透压增加以及溶氧能力减弱,大肠菌群的生长受到抑制。因此,选取酵母粉的最佳浓度为0.3g/100mL。
2.4 响应曲面实验设计优化结果
2.4.1 模型的建立与分析 依据方法1.2.3.2进行Box-Behnken实验,实验设计与结果见表2。
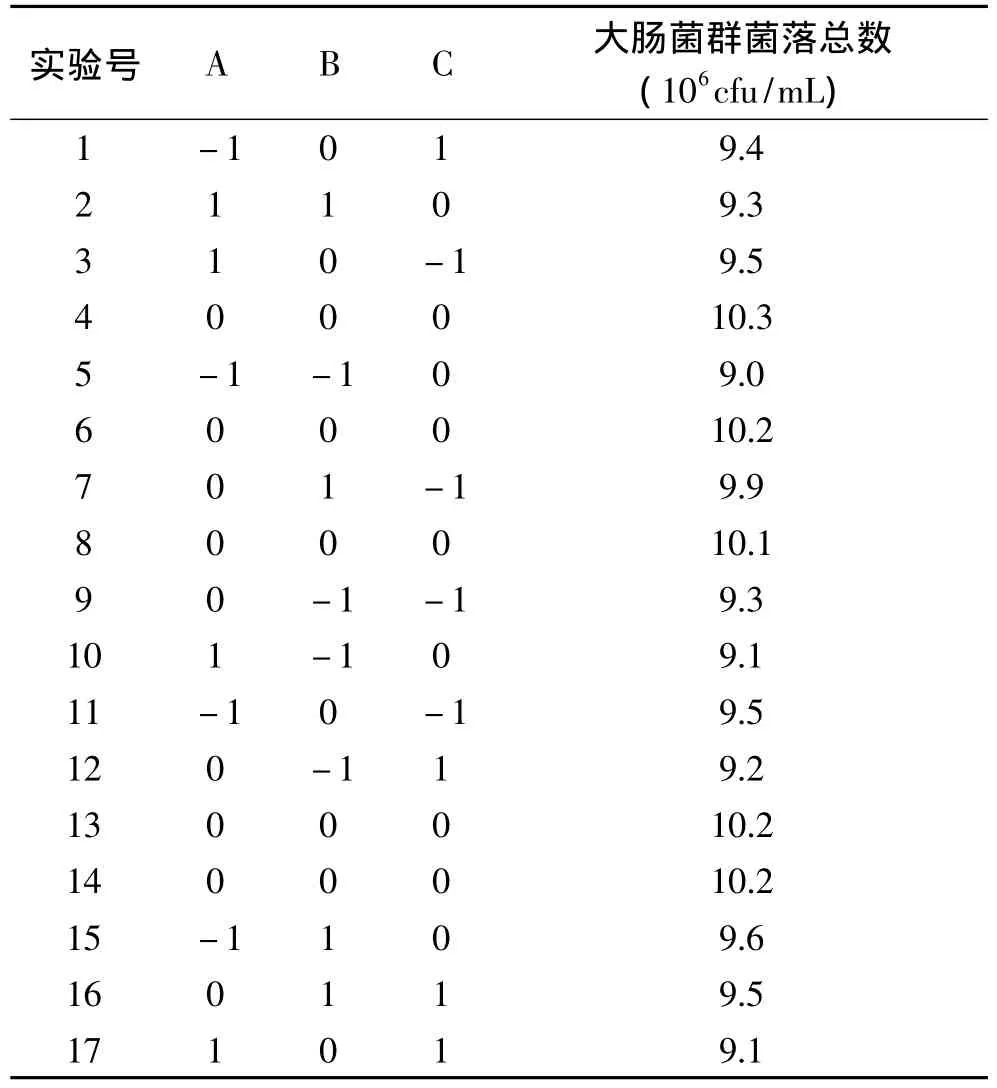
表2 Box-Behnken实验设计与结果Table 2 Results of response surface experiments

表3 回归方程方差分析Table 3 Analysis results of regression and variance
利用Design Export软件[10]对表1中的大肠菌群菌落总数进行回归分析与回归拟合,得到响应值Y与变量A、B、C之间的回归方程为Y=10.2-0.062A+0.21B-0.13C-0.1AB-0.075AC-0.075BC-0.53A2-0.43B2-0.3C2。回归方程方差分析结果见表3。
据表3可知,模型方程中的常量p<0.0001,表明此模型显著[11]。模型的失拟项p=0.9136,说明失拟不显著,回归模型适合[12]。模型的相关系数 R2=0.9929,表明模型与实际情况的拟合度较好。A、B、C三个因素的一次项、二次项以及AB、AC、BC的交互作用对菌落总数都有显著影响,其中因素B、C以及AB、AC、BC的交互作用对菌落总数有极显著影响。
2.4.2 响应面的优化与分析 根据回归方程所作的响应曲面图如图4~图6所示。
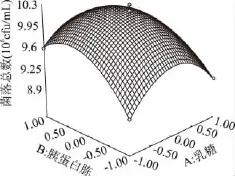
图4 乳糖浓度和胰蛋白胨浓度对大肠菌群细菌总数的响应曲面图Fig.4 Response surface of concentration of lactose and tryptone on the TVCs of coliform group
由图4可知,乳糖、胰蛋白胨和酵母粉的浓度对大肠菌落菌落数都有较大的影响。乳糖、胰蛋白胨和酵母粉任意两者之间的交互作用都显著。在培养基中其它成分不变的条件下,随着三者浓度的不断升高,大肠菌群菌落总数皆呈现出先增大后逐渐减小的趋势。由此说明大肠菌群生长需要适宜的碳氮比,过高或过低浓度的碳源或氮源都会影响大肠菌群的生长。在适宜的浓度条件下,大肠菌群能够达到最佳的生长状态。使用Design-expert 7.0软件分析对回归方程求解得到A=0.5,B=1.64,C=0.29,此时Y值预测为1.025×107cfu/mL。由此,可以初步确定较适宜的培养基组成为乳糖0.5g/100mL,胰蛋白胨1.64g/100mL,酵母粉0.29g/100mL。在此条件下,大肠菌群菌落总数达到最佳值为1.025×107cfu/mL。
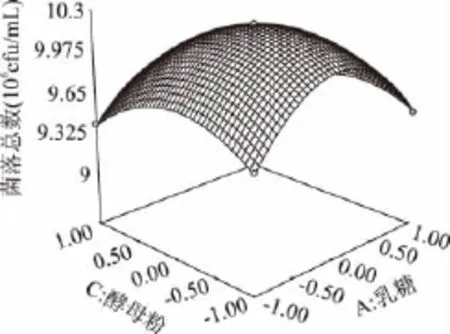
图5 乳糖浓度和酵母粉浓度对大肠菌群细菌总数的响应曲面图Fig.5 Response surface of concentration of lactose and yeast powder on the TVCs of coliform group
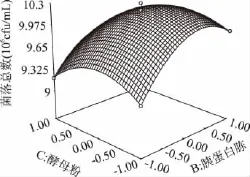
图6 胰蛋白胨浓度和酵母粉浓度对大肠菌群细菌总数的响应曲面图Fig.6 Response surface of concentration of tryptone and yeast powder on the TVCs of coliform group
2.4.3 模型验证实验 在此优化条件下进行3次验证性实验,得到的大肠菌群实际菌落总数结果见表4,可知平均值为1.033×107cfu/mL,该值与理论预测值相差0.84%,说明通过响应曲面法优化得到的参数准确可靠,具有可行性。
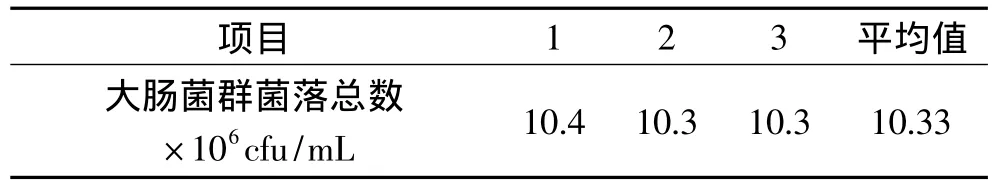
表4 模型验证实验结果Table 4 Results of model validation test
3 结论
本实验在单因素实验的基础上,对大肠菌群初发酵培养基成分进行了优化,通过Box-Behnken响应曲面法对实验数据进行优化,得到影响大肠菌群菌落总数的二次多项式回归模型。最终得到的优化培养基组成为:乳糖0.5g/100mL,胰蛋白胨1.64g/100mL,酵母粉0.29g/100mL,在此条件下可以得到大肠菌群菌落总数的最佳值1.025×107cfu/mL,对实验结果进行验证,得到的实际值为1.033×107cfu/mL,与理论预测值基本一致。本实验为进一步研究大肠菌群快速检测方法奠定了基础。
[1]刘慧.现代食品微生物学[M].北京:中国轻工业出版社,2006.
[2]杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2008.
[3]中华人民共和国卫生部.GB 4789.3-2010,食品微生物学检验 大肠菌群计数[S].北京:中国标准出版社,2010.
[4]MA Yanez,C Valor,V Catalan.A simple and cost- effective method for the quantification of total coliforms and Escherichia coli in potable water[J].Journal of Microbiological Mehods,2006,65:608-611.
[5]刘晓永,王强,刘红芝.基于二次正交旋转回归实验的酵母β-葡聚糖发酵培养基优化[J].酿酒科技,2007(4):32-36.
[6]葛珍珍,王杰,周灿灿.响应面法优化小球藻培养基[J].食品工业科技,2012,33(16):196-198.
[7]潘自皓,顾薇响.响应面法优化大肠杆菌X-12发酵培养基的研究[J].安徽农业科技,2009,37(36):17982-17985.
[8]中华人民共和国卫生部.GB 4789.2-2010,食品微生物学检验 菌落总数测定[s].北京:中国标准出版社,2010.
[9]陈灿映.大肠菌群快速检测培养基的研制及评价[D].郑州:郑州大学,2012.
[10]衣丹,刘发义,臧家业.响应面法优化碱蓬叶蛋白提取工艺研究[J].食品工业,2011(10):52-54.
[11]BVV Ratnam, M Narasimha Rao, M Dmodar Rao.Optimization of fermentation conditions for the production of ethanol from sago starch using response surface methodology[J].World Journal of Microbiology & Biotechnology,2003,19:523-526.
[12]Joglekar AM,May AT.Product excellence through design of experiment[J].Cereal Foods World,1987(32):857-868.
