不同硒源及硒水平对断奶仔猪生长性能、免疫功能和甲状腺激素水平的影响
2013-09-03林长光郑金贵
福 建 农 林 大 学 林长光 郑金贵*
福建光华农牧科技开发有限公司 林金玉 詹桂兰 林枣友 陈文焕
广 州 博 仕 奥 集 团 刘东霞
硒是动物机体的必需微量元素,具有提高机体抗氧化能力、免疫力,促进生长,改善肉质等功能。硒的生物学功能主要通过各种硒蛋白(硒酶)表现出来。仔猪缺硒会引起白肌病、肝坏死、食欲下降和生长迟缓。生产实践中通常在日粮中添加一定量的外源硒来满足仔猪健康的需要。但日粮硒在最佳浓度和致毒浓度之间的安全剂量较为狭窄,因此开发低毒、高效的硒源一直是硒营养研究的重点(徐辉碧和黄开勋,1993)。目前主要有无机硒、有机硒及纳米硒三种形式,但无机硒在使用中具有较强的毒性和较低的生物利用率,对动物和环境可造成不良影响,因此一些国家已限制使用。与无机硒相比,有机硒(主要有蛋氨酸硒、酵母硒等)的吸收利用率较高,能更好地存留在动物体内(Manhan等,1999)。而纳米硒是以大分子物质(蛋白质、糖类等)为分散剂的纳米级别的单质硒,具有较高的生物活性、安全性、抗氧化性和高吸收率等特点,在动物生产中具有广泛的应用前景。本试验在日粮中分别添加不同水平的纳米硒、酵母硒和亚硒酸钠,研究不同硒源及硒水平对断奶仔猪生长性能、机体免疫能力和甲状腺激素水平的影响,为合理利用各种硒源提供技术参考。
1 材料与方法
1.1 试验材料 试验动物为杜长大三元杂交断奶仔猪。纳米硒由广州博仕奥生物技术有限公司生产,为纳米级的单质硒,淡红色粉末,单质硒含量为0.5%。酵母硒由北京奥特奇生物制品有限公司生产,有机硒含量为0.20%。亚硒酸钠(Na2SeO3)由衡阳市石鼓区华地饲料添加剂厂生产,饲料级,硒含量1%。
1.2 试验动物与饲养管理 饲养试验于2013年3月在福建光华农牧科技开发有限公司大湖猪场进行。
选择(28±3.5)日龄、平均初始体重为(8.50±0.52)kg健康的杜长大三元杂交断奶仔猪600头,随机分为10组,每组3个重复,每个重复20头仔猪,公母各半。
将试验猪个体称重,挂耳牌,分组,预饲期为7 d,预饲期结束时个体空腹称重,进入试验期,试验期46 d。预饲期间,进行必要的免疫、驱虫、保健。猪舍为双列式,南北敞开,水泥漏缝地面,每栏面积15 m2。日投喂料2次,每次投料以略有余料为准,自由采食粉料,自动饮水。每日清扫圈舍地面两次,保持干净。
1.3 试验设计与试验日粮 试验设10个组,1组为对照组,饲喂不添加硒源的日粮,2~10组为试验组,分别以亚硒酸钠、酵母硒和纳米硒为硒源,添加水平分别为 0.3、0.5、0.7 mg/kg(以硒计)。 基础日粮组成及营养水平见表1。
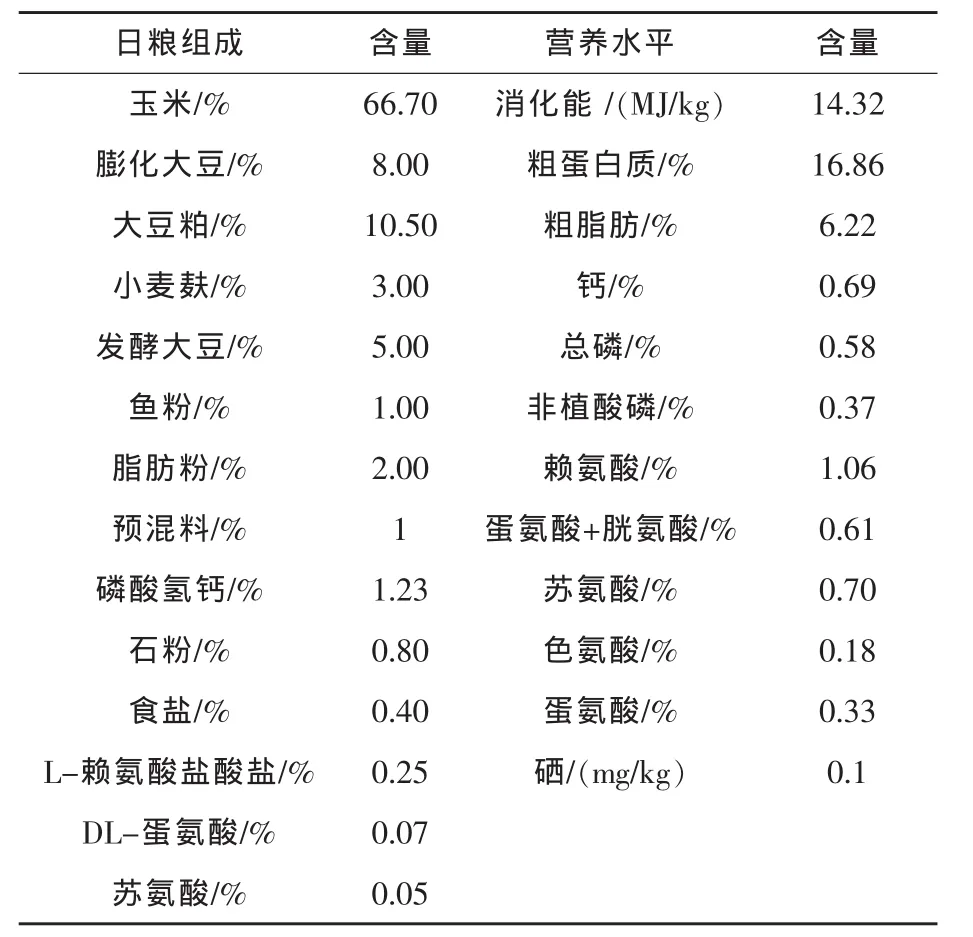
表1 基础日粮组成及营养水平
1.4 测定指标及方法
1.4.1 生长性能指标 预饲及试验结束时猪只空腹16 h(只给饮水)后,于第二天上午逐只称重。试验结束时统计各重复(栏)的耗料量和猪只的生长情况。计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.2 血清样品采集 试验开始和结束称重后,于每个重复中选择体重相近的1头公猪和1头母猪,前腔静脉采血10 mL,置于空白离心管,经3500 r/min离心15 min,分离获得血清,-20℃条件下贮存,待测。
1.4.3 血清免疫球蛋白测定 血清中IgG、IgA、IgM含量采用双抗体夹心酶联免疫吸附法(ELISA)测定。血清中IgG、IgA、IgM与抗体结合,形成抗体-抗原-酶标抗体复合物,洗涤,在酶的催化下显色。通过标准曲线计算样品中IgG、IgA、IgM的浓度(试剂盒购自南京森贝伽生物科技有限公司)。
1.4.4 血清甲状腺激素的测定 血清中3,5,3’-三碘甲腺原氨酸(T3)、3,5,3’,5’-四碘甲腺原氨酸(T4)含量的测定,采用双抗体夹心酶联免疫吸附法(ELISA),血清中T3/T4与抗体结合,形成抗体-抗原-酶标抗体复合物,洗涤,在酶的催化下显色,通过标准曲线计算样品中T3/T4的浓度(试剂盒购自南京森贝伽生物科技有限公司)。
1.5 数据处理 试验数据用Excel整理,并采用SPSS 16.0软件包中的ANOVA程序进行方差分析,采用Duncan’s法对各组平均数进行多重比较,结果以“平均数±标准差”表示。
2 结果与分析
2.1 不同硒源和硒水平对仔猪生长性能的影响从表2可以看出,不同硒源及硒水平的各组间仔猪平均日采食量差异不显著(P>0.05),但纳米硒组中0.3、0.5 mg/kg硒水平和酵母硒组0.5 mg/kg硒水平的试验组日增重分别比对照组提高10.24%、13.08%和 10.45%,差异显著(P <0.05),另外0.5 mg/kg纳米硒组与0.7 mg/kg亚硒酸钠组相比,日增重高了10.60%,差异显著(P<0.05)。0.3、0.5 mg/kg酵母硒添加组和纳米硒各水平组的平均料重比均显著低于对照组和0.7 mg/kg亚硒酸钠组(P < 0.05)。
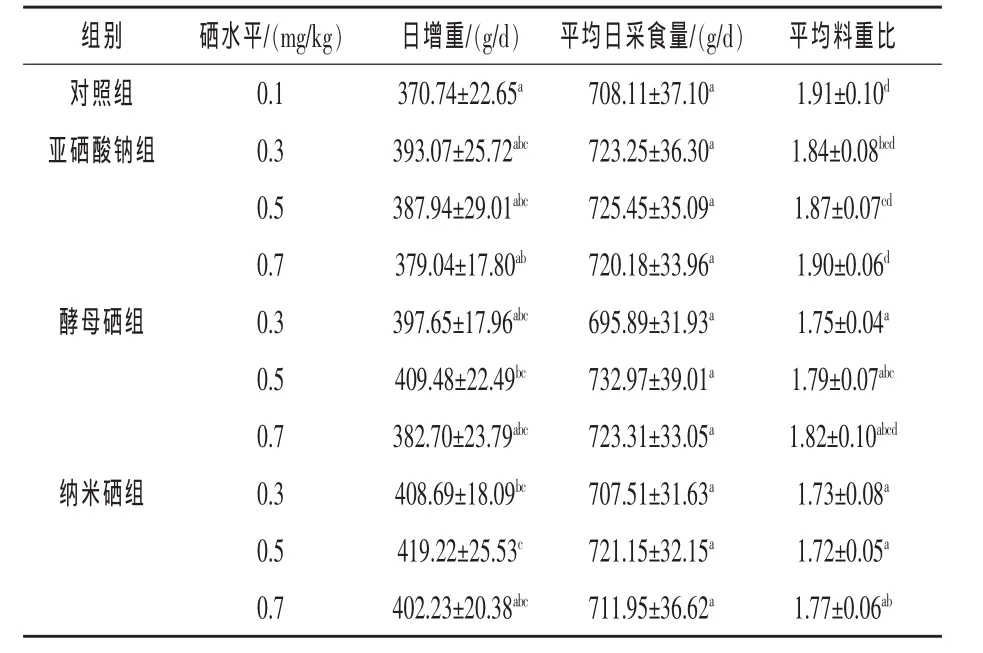
表2 不同硒源和硒水平对仔猪生长性能的影响
2.2 不同硒源和硒水平对仔猪血清免疫球蛋白含量的影响 由表3可见,试验开始时各组仔猪血清中IgA含量与对照组相比差异均不显著(P>0.05)。试验结束时,硒源对仔猪血清IgA含量影响极显著(P<0.01),硒水平、硒源和水平间的交互作用对IgA无显著影响 (P>0.05)。试验结束时,各组仔猪血清IgA含量较试验开始时有所升高,尤其是纳米硒组和酵母硒组升高较明显。纳米硒组和酵母硒组仔猪血清IgA含量分别高于对照组23.15%和17.28%,高于亚硒酸钠组21.36%和15.57%,均差异极显著(P<0.01),纳米硒组和酵母硒组间差异不显著(P>0.05)。从不同硒源和水平分析,纳米硒组各水平组和0.5、0.7 mg/kg酵母硒组仔猪血清IgA含量显著高于对照组和亚硒酸钠各水平组(P<0.01)。纳米硒组和酵母硒组中,0.5 mg/kg硒水平组和0.7 mg/kg硒水平组间差异不显著(P > 0.05)。
试验开始时各组间仔猪血清中IgG含量及其与对照组间均无显著差异(P >0.05)。试验结束时,硒源对仔猪血清IgG含量影响极显著 (P <0.01),硒水平、硒源和水平间的交互作用对IgG无显著影响(P >0.05)。试验结束时,纳米硒组和酵母硒组仔猪血清IgG含量比对照组分别提高10.79%(P < 0.01)和 7.79%(P < 0.05),比亚硒酸钠组分别提高14.14%和11.06%,差异极显著(P <0.01)。试验结束时,对照组和亚硒酸钠各水平组仔猪血清IgG含量较试验开始时均有所下降,而纳米硒组和酵母硒组在保持血清IgG含量的基础上均有所升高,尤其是0.5 mg/kg硒水平的纳米硒组仔猪血清IgG含量极显著升高,较对照组提高 14.11%(P<0.01)。
试验开始时各组间仔猪血清中IgM含量及其与对照组间均无显著差异(P>0.05)。试验结束时,硒源、硒水平、硒源和水平间的交互作用对仔猪血清IgM含量均无显著影响(P>0.05)。试验结束时,纳米硒组和酵母硒组仔猪血清IgM含量分别较对照组高12.32%(P<0.01)和10.13%(P<0.05)。试验结束时,除纳米硒各水平组和0.3、0.5 mg/kg硒水平的酵母硒组仔猪血清IgM含量较试验开始时略有升高外,其余各组均略有下降,其中0.3、0.5 mg/kg硒水平的纳米硒组和0.5 mg/kg硒水平的酵母硒组与对照组相比,分别提高了16.69%、14.11%和 15.48%,差异显著(P <0.05)。
2.3 不同硒源和硒水平对仔猪血清甲状腺激素水平的影响 由表4可见,试验开始时各组间仔猪血清中T3含量及其与对照组间均无显著差异(P>0.05)。试验结束时,硒源、硒水平对仔猪血清T3含量影响极显著(P<0.01),硒源和水平间的交互作用对血清T3含量无显著影响 (P>0.05)。试验结束时,除对照组外,各组仔猪血清T3含量均较试验开始时略有提高。纳米硒组仔猪T3含量与对照组、亚硒酸钠组和酵母硒组相比,分别高了18.92%、17.07%和 5.74%,差异极显著(P<0.01)。从硒水平分析,随着硒水平的提高,仔猪血清T3含量也随着升高,与0.3 mg/kg硒水平组相比,0.5 mg/kg硒水平组提高了 8.46%(P<0.05),0.7 mg/kg硒水平组提高了9.89%(P<0.01)。从不同硒源和水平分析,纳米硒组中,0.5、0.7 mg/kg硒水平组仔猪血清T3含量与对照组相比,分别提高了23.08%和24.08%,差异极显著(P<0.01);与亚硒酸钠各水平组相比差异极显著(P<0.01)。
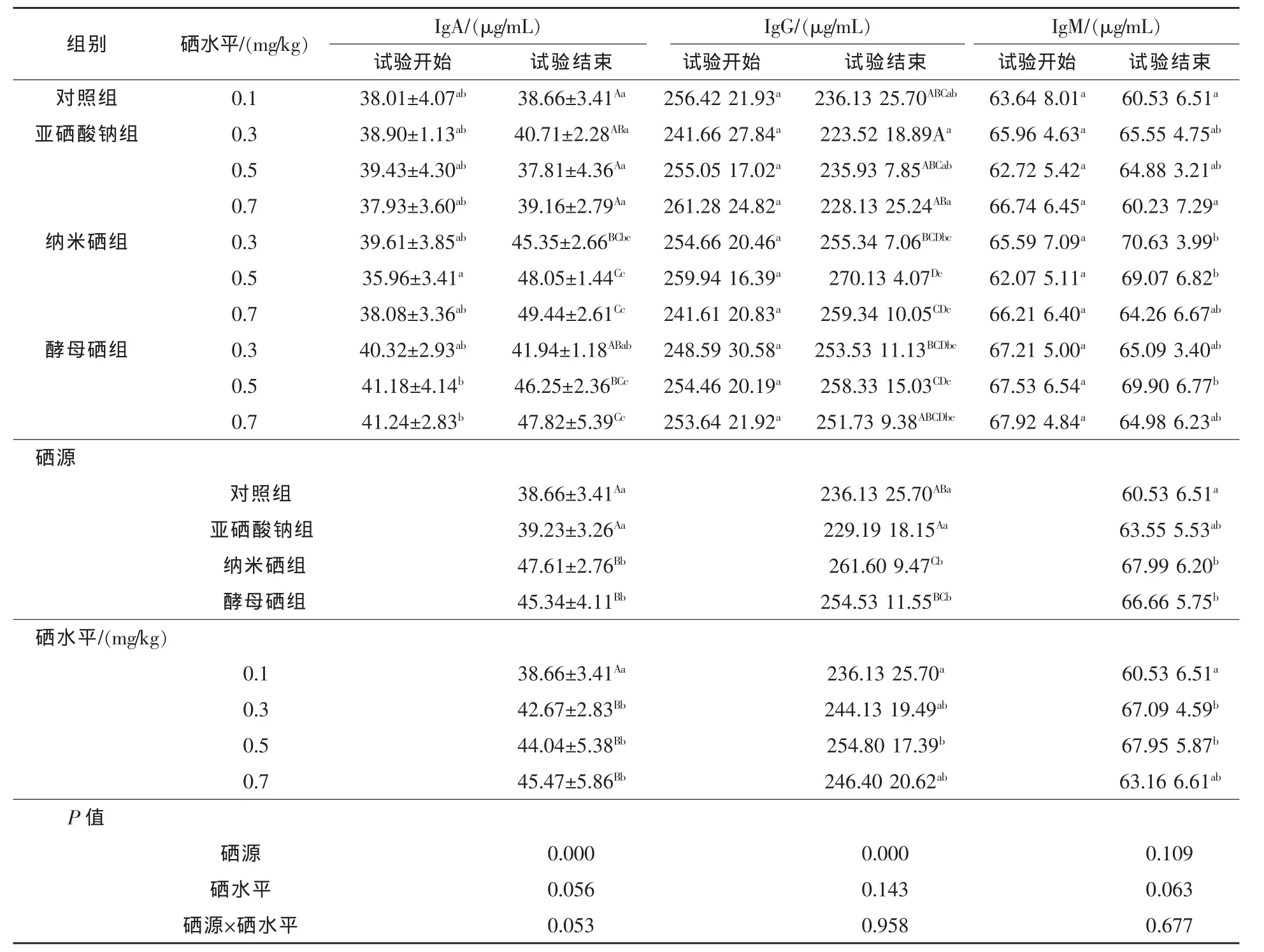
表3 不同硒源和硒水平对仔猪血清免疫球蛋白含量的影响
试验开始时各组间仔猪血清中T4含量及其与对照组间均无显著差异 (P>0.05)。试验结束时,硒源、硒水平、硒源和水平间的交互作用对仔猪血清T4含量无显著影响(P>0.05)。试验结束时,纳米硒组中0.5、0.7 mg/kg硒水平组仔猪血清T4含量较试验开始时有明显的下降,但与对照组相比差异不显著 (P>0.05)。酵母硒各水平组仔猪血清T4含量较试验开始时无明显变化。
3 讨论
3.1 不同硒源和硒水平对仔猪生长性能的影响硒可调节甲状腺素、类胰岛素生长因子的活性,能增强动物机体对糖原、蛋白质、脂肪的分解,有利于机体能量的供给,促进生长(倪银星,2002)。另外,硒还能提高动物机体抗应激、抗氧化及免疫功能,间接地达到促进生长作用(Raymond和Burk,2002)。 张乙山等(2008)报道,将纳米硒、酵母硒和亚硒酸钠三种硒源分别以 0.3、0.5、0.8 mg/kg三个水平饲喂生长育肥猪,其生长性能差异不显著(P>0.05),但酵母硒和纳米硒的添加提高了日增重并降低料重比,有提高生长性能的趋势。王秀娜等(2010)将纳米硒、酵母硒和亚硒酸钠三种硒源分别以0.1、0.3、0.5 mg/kg三个水平添加到断奶仔猪日粮中,结果发现,0.3 mg/kg和0.5 mg/kg的纳米硒组和0.3 mg/kg酵母硒组的平均日增重和日采食量均显著高于无机硒组,0.5 mg/kg纳米硒组和0.3 mg/kg酵母硒组的料重比显著低于无机硒组;纳米硒组中0.3、0.5 mg/kg硒水平和酵母硒组0.5 mg/kg硒水平的试验组日增重分别高于对照组10.24%、13.08%和 10.45%,差异显著(P < 0.05);酵母硒源0.3、0.5 mg/kg硒水平组和纳米硒源各硒水平组的平均料重比均显著低于对照组和0.7 mg/kg亚硒酸钠组(P<0.05)。本试验结果与报道相符,可见日粮中添加酵母硒或纳米硒能够提高仔猪的日增重,降低料肉比,促进仔猪生长。

表4 不同硒源和硒水平对仔猪血清甲状腺激素水平的影响
3.2 不同硒源和硒水平对仔猪免疫球蛋白含量的影响 由浆细胞产生具有免疫功能的球蛋白(抗体)是体液免疫的关键,研究发现硒能增强体液免疫功能,刺激免疫球蛋白形成。大量试验研究表明,硒能提高畜禽体内的吞噬细胞数量、促进淋巴细胞的增殖及畜禽抗体和免疫球蛋白的合成,提高畜禽机体的免疫机能。Julian等(1973)研究证明,鼠日粮里添加亚硒酸钠提高了IgG、IgM抗体滴度。高学云等(2000)研究表明,纳米硒高剂量组小鼠的细胞免疫功能、体液免疫功能和巨噬细胞吞噬功能明显升高,而亚硒酸钠各剂量组的上述免疫指标无明显变化,表明纳米硒对小鼠免疫功能有明显的调节作用。胥保华(2003)报道,纳米硒添加水平为 0.2、0.3、0.4、0.5 mg/kg 的各组血清IgG、IgM含量显著高于硒代蛋氨酸组和亚硒酸钠组(P<0.05)。王秀娜等(2010)在断奶仔猪日粮中分别添加纳米硒、酵母硒和亚硒酸钠三种硒源,添加水平并分别为 0.1、0.3、0.5 mg/kg,结果表明,血清中IgA、IgG、IgM和C3的水平均以0.5 mg/kg的纳米硒组最高,且显著高于纳米硒、酵母硒、亚硒酸钠的0.1 mg/kg水平添加组,也显著高于0.5 mg/kg的亚硒酸钠组及对照组。袁施彬等(2008)研究报道,在日粮中添加0.6 mg/kg的硒,能使猪日增重提高,料肉比降低;IgG、IgA和IgM水平提高,猪瘟抗体滴度随着试验期的延长,几乎呈直线上升,在免疫后28 d,阳性保护率达到100%。本试验研究表明,纳米硒和酵母硒能有效提高血清中IgA、IgG、IgM抗体滴度,高于或显著高于对照组和亚硒酸钠组,与相关试验报道一致,说明日粮中添加硒可提高动物机体的免疫性能,且纳米硒和酵母硒的效果要优于亚硒酸钠。
3.3 不同硒源和硒水平对仔猪血清甲状腺激素水平的影响 硒是甲状腺原氨酸脱碘酶I(ID-I)的主要组成成分,控制着机体甲状腺激素、T3的活性。ID-I主要存在于肝、肾组织中,能催化T4脱碘转变为活性强的T3。缺硒导致脱碘酶Ⅰ活性下降,降低了T4向T3的转化速度,使血液中T3下降而T4上升,引起动物生长受阻。熊莉等(2004)报道,硒添加浓度为0.3~1.0 mg/kg时,纳米硒组脱碘酶Ⅰ活性和血清T3水平显著高于亚硒酸钠组(P<0.05),血清T4水平显著低于亚硒酸钠组(P<0.05)。本试验研究表明,随着硒水平的升高,T3浓度也随着升高,纳米硒组中,0.5、0.7 mg/kg硒水平组仔猪血清T3含量分别高于对照组23.08%和24.08%,差异极显著(P<0.01),和亚硒酸钠各组相比,差异极显著(P<0.01);T4浓度随着硒水平的升高而降低,但纳米硒组与对照组相比无显著差异(P > 0.05)。
4 结论
本试验结果表明,日粮添加硒可以提高仔猪的免疫功能,且纳米硒和酵母硒的效果优于亚硒酸钠。随着日粮中硒水平的提高,血清中T3浓度也随着升高,而T4浓度随之下降,促进了仔猪的生长。综合各项指标分析纳米硒和酵母硒的添加水平为0.5 mg/kg和0.7 mg/kg效果较好。
[1]高学云,张劲松,张立德,等.纳米红色元素硒对小鼠的免疫功能的调节作用[J].中国公共卫生,2000,16(5):421 ~ 422.
[2]倪银星.硒蛋白、硒与内分泌激素的关系研究进展[J].国外医学卫生学分册,2002,29(1):38 ~ 41.
[3]王秀娜,耿忠诚,武志敏,等.不同硒源对仔猪生长性能及体液免疫指标的影响[J].黑龙江八一农垦大学学报,2010,2(1):61 ~ 64.
[4]熊莉,胡彩虹,夏枚生,等,许梓荣.不同硒添加剂对仔猪生长肝脱碘酶Ⅰ活性和血清甲状腺激素水平的影响[J].中国兽医科技,2004,34(10):29~33.
[5]胥保华.纳米硒对Avian肉鸡的生物学效应及其分子机理研究:[博士学位论文][D].杭州:浙江大学,2003.
[6]徐辉碧,黄开勋.硒的化学、生物化学及其在生命科学中的应用[M].武汉:华中理工大学出版社.1993.53.
[7]袁施彬,余冰,陈代文.硒添加水平对氧化应激仔猪生产性能和免疫功能影响的研究[J].畜牧兽医学报,2008,5:677 ~ 681.
[8]张乙山,边连全,游思亲.三种硒源对生长肥育猪组织硒沉积及抗氧化能力的影响[J].饲料工业,2008,29(1):18 ~ 20.
[9]Julian E S,John L M,Marlene L G,et al.Enhanced Immunoglobulin M and Immunoglobulin G Antibody Titers in Mice Fed Selenium[J].Infection and Immunity,1973,11:841 ~ 842.
[10]Manhan D C,Cline T R,Richert B.Effects of dietary levels of selenium enriched yeast and sodium selenite as selenium sources fed to growing~finishing pigs on performance,tissue selenium,serum glutathione peroxidase activity,carcass characteristics,and loin quality[J].J Anim Sci,1999,77:2172 ~2179.
[11]Raymond F,Burk M D.Selenium,an antioxidant nutrient[J].Nutr Clin Care,2002,5(2):75 ~ 79.
