邻苯二甲酸酯降解菌的分离鉴定及降解特性
2013-09-02温志丹高大文吴唯民
温志丹,高大文,李 喆,吴唯民
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.美国斯坦福大学土木与环境工程系,CA94305斯坦福)
邻苯二甲酸酯(phthalic acid ester,PAEs),又名酞酸酯,是一类广泛应用于塑料、涂料、农药、橡胶、个人护理用品等领域的人工合成化学添加剂[1],在生产、使用和废弃过程中,能够逐渐从其基体材料中迁移至外界环境中[2-3],已成为全球环境最普遍的重要有机污染物之一,在大气、土壤和水体中都检测到PAEs的存在[4-6].PAEs具有致畸性、致突变性、致癌性及生殖毒性[7-8],美国EPA已将其列入129种[9]重点控制污染物名单中,在我国也是环境优先控制污染物[10].由于具有较强的疏水性,大量PAEs吸附于水体底部的沉积物或土壤中[11].但在自然环境条件下,其光解和水解速度极其缓慢,生物降解是相对重要的转化过程[12].大量研究也表明好氧或厌氧条件下的微生物代谢分解是影响PAEs类增塑剂在环境中行为和归趋的主要途径,是该类物质在自然环境中完全矿化的主要过程之一.
从长期处理生活污水的东北某人工湿地土壤和污水处理厂活性污泥中,分离筛选出7株邻苯二甲酸酯降解能力较高的菌株,运用常规生理生化试验和分子生物学手段对这7株菌进行鉴定,并观察其降解特性.以期为今后从自然界中分离选育降解邻苯二甲酸酯的优势菌种,构建具有高效降解性能的微生物体系,及邻苯二甲酸酯污染土壤的生物修复研究奠定基础.
1 实验
1.1 实验材料
1.1.1 供试土壤样品的采集和处理
土壤样品采集于2012年6月.采样湿地为辽宁省昌图县某处理生活污水的人工湿地,该湿地的地理位置为124°4'44″N~124°4'59″N,42°45'43″E~42°45'58″E.采样前对所用器皿进行高温灭菌,并用丙酮及超纯水清洗,取样前用所在采样点的水样润洗.采样点为该人工湿地的进水口、中间段和出水口,先用灭菌后的不锈钢采样铲去除表面10 cm的土壤后采样,采用多点采集混合取样的方式,同时采集水样和基质样品.样品采集后装入1 L棕色磨口瓶中密封,置于装满冰袋的保温箱中,并于12 h内运回实验室,4℃冰箱中保存.
1.1.2 药品及化学试剂
选取结构上具有代表性的邻苯二甲酸酯作为研究对象,所用试剂有:邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二异辛酯(DEHP)(美国Sigma-Aldrich股份有限公司产品).实验过程中使用的正己烷有机溶剂为分析纯(美国TEDIA公司产品).
1.1.3 培养基配置
细菌保存培养基:营养琼脂培养基(NA)[13].
筛选基础培养基(MSM):每升含(NH4)2SO4,1 g;K2HPO4,0.8 g;KH2PO4,0.2 g;NaCl,0.5 g;微量元素液1 mL[14].
120 mg/L PAEs混合物做为唯一的碳源和能源(包括20 mg/L DMP、DEP、DBP、BBP、DEHP和DOP),pH 7.0~7.2.
1.2 实验方法
1.2.1 PAEs降解菌的分离和富集
取5 g土壤样品加入100 mL含PAEs的MSM培养基中,置于震荡培养箱中120 r/min、30℃培养7 d;然后取1 mL上述培养液加入新鲜的含PAEs的MSM培养基中,同条件下培养7 d后转接,共转接3次.培养液中PAEs质量浓度逐渐增加(120~360 mg/L).
取最终液体培养物0.1 mL涂布于含PAEs 120 mg/L的MSM固体培养基上,30℃下培养7 d.菌落出现后,分别挑取表型不同的单菌落于NA培养基上,进行三区划线分离,反复分离直至在NA固体培养基上得到菌落特征一致的纯菌落.所得纯菌再次回接至MSM固体平板上,只能在含PAEs的MSM固体平板上生长的菌株,被认为具有降解利用邻苯二甲酸酯的能力.将该菌转接于试管斜面中(NA培养基),4℃保存备用.
1.2.2 细菌的形态学和常规生理生化特征
观察菌落特征及菌体形态,并根据伯杰氏细菌鉴定手册[15]对分离到的邻苯二甲酸酯降解菌进行生理生化实验.
1.2.3 16 s rRNA序列分析
采用试剂盒(柱式细菌DNAout,北京天恩泽基因科技有限公司)提取细菌基因组DNA,PCR扩增细菌16s rRNA基因,委托生工生物工程有限公司测序,将测序结果与GenBank中的己知序列进行相似性分析和同源性比较.
1.2.4 PAEs降解实验
取上述纯培养物培养于NA培养基中,菌液OD600为1.2~1.4时,离心分离(8 000g,20 min)收集菌体,再用磷酸盐缓冲液(pH=7.0)清洗菌体,离心弃去上清液,重复3次.将洗后的菌体接种于50 mL的MSM液体培养基中(ρ(PAEs)=20 mg/L),在30℃下摇床培养3 d后离心取上清液,同时以未接菌的培养液作为空白对照.以上实验重复3次.采用微波萃取法(萃取液为正己烷)提取上清液中残余PAEs,合并萃取液,过无水硫酸钠干燥柱,旋转蒸发至少于10 mL后定容,待GCMS分析.
1.2.5 PA利用实验
选取PAEs常见的中间降解产物——邻苯二甲酸(PA)进行底物利用实验.配制MSM培养液,150 mg/L PA作为唯一的碳源和能源,将与1.2.4相同处理的菌株接种至该培养液中培养.以未接菌的培养液作为空白对照,用分光光度法连续测定培养液在波长600 nm下的光密度值(OD600),衡量细菌的生长情况.同一批号样品重复检测3次,取平均值作为最后结果.
1.3 分析方法
样品分析使用Agilent 6890-5973N气相色谱-质谱联用(GC-MS)仪.色谱柱为DB-5 ms(30 m×250 μm×1 μm),气相色谱进样口温度300℃;载气为高纯氦气(99.99%),流速2.0 mL/min;进样量2.0 μL;溶剂延迟10 min;柱温90℃(3 min),以15℃/min升至320℃(7 min),共运行25.33 min.
2 结果与讨论
2.1 邻苯二甲酸酯降解菌的分离筛选
按照富集、初筛、纯化和复筛的方法,在处理生活污水的人工湿地土壤样品中分离到7株可对邻苯二甲酸酯进行有效降解的菌株,分别为D1~D7.形态学及菌落特征见表1.其中D1,D2,D4和D5分离自人工湿地进水口位置(距进水口5 m)的土壤中,D3分离自湿地中间段的土壤中,而D6和D7分离自湿地出水口位置(距出水口5 m)的土壤中.
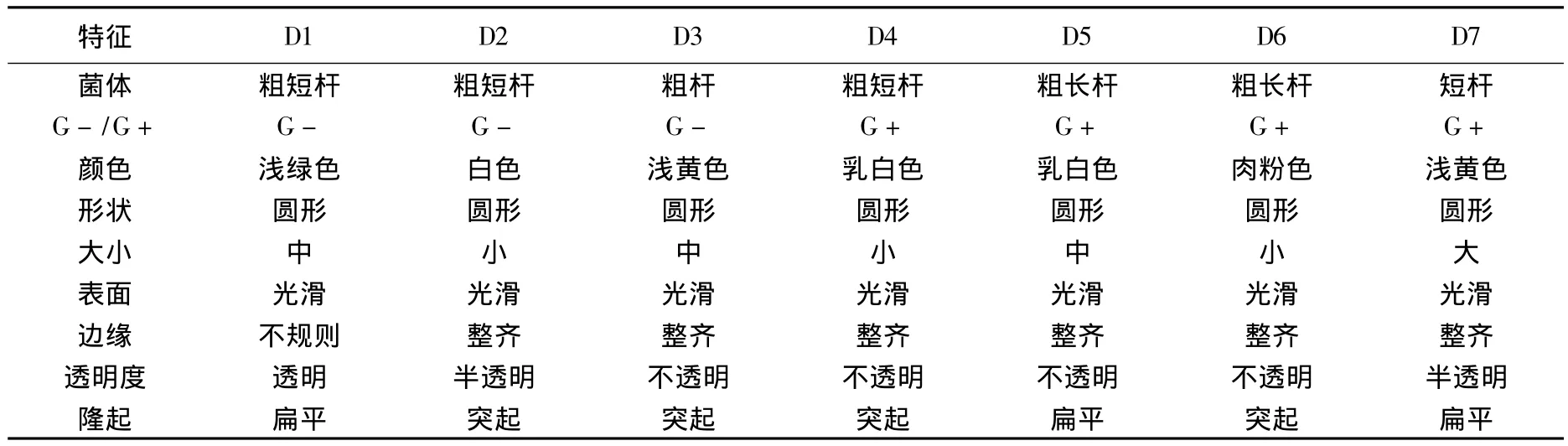
表1 降解菌个体及平板菌落特征
2.2 邻苯二甲酸酯降解菌的生理生化特征
对以上7株细菌进行的甲基红试验、V-P测定、柠檬酸盐利用试验、淀粉水明胶液化试验、葡萄糖发酵试验、纤维素分解试验、吲哚试验等生理生化结果见表2.
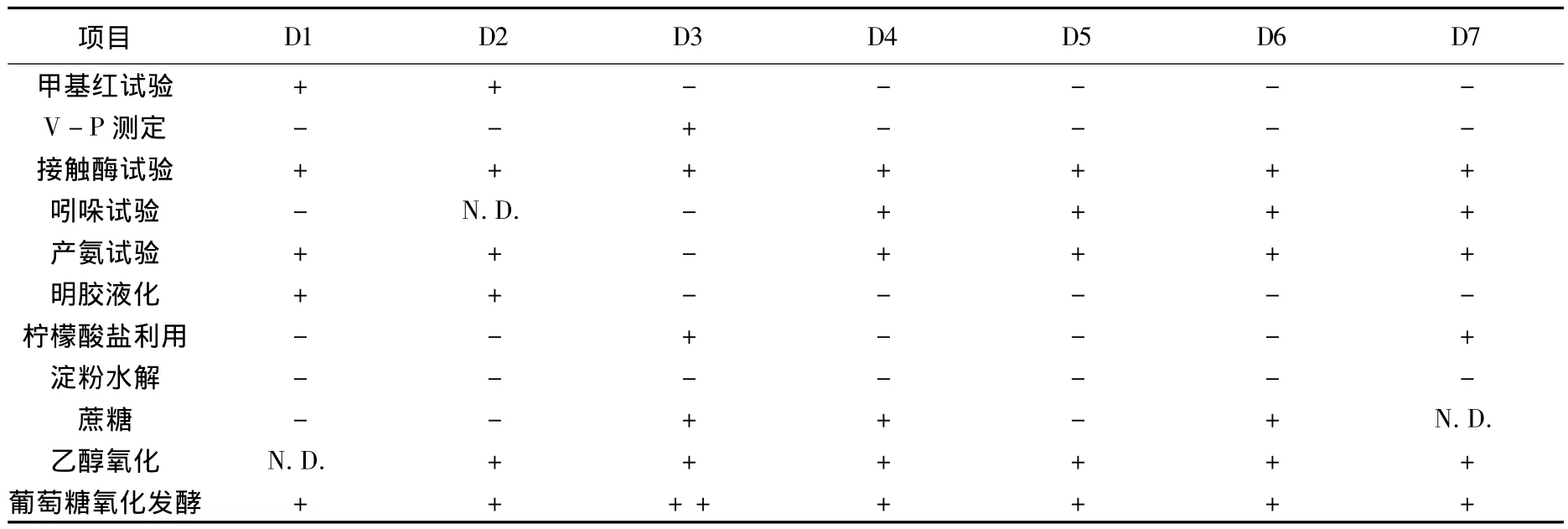
表2 细菌生理生化试验结果
2.316S rRNA序列同源性分析
提取细菌总DNA并选用细菌通用引物8f和1492r扩增其16S rRNA基因,扩增产物序列长度均在1 424~1 452 bp,根据测序结果,利用BLAST软件与Genbank中已登录的16S rRNA基因序列进行同源性比较,并利用Cluastx和MEGA 4.1等相关软件建立系统发育树,见图1.所有获得的序列提交至Genebank,检索号依次为KF113578~KF113584.经16S rRNA基因测序及同源性比较,D1、D2与Pseudomonas sp.的同源性分别为100%和98%,D3与Enterobacter sp.的同源性在99%以上,其余5株降解菌与Rhodococcus sp.的同源性都在98%以上.
2.4 菌株对邻苯二甲酸酯的降解
对以上筛选出的7株菌进行PAEs降解率测定,结果如图2所示.可以看出,在以PAEs为唯一碳源的培养基中,7株菌均能有效降解并利用邻苯二甲酸酯,但降解率各不相同.菌株D1和D7对PAEs的降解效果明显优于其他细菌,两者对DMP、DBP和DEHP的降解率均在70%以上,而菌株D2的降解率都低于70%,其余菌株对不同种类PAEs的降解率在30%~99%.
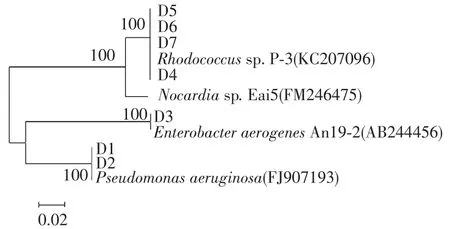
图1 16S 人RNA测序及同源性分析
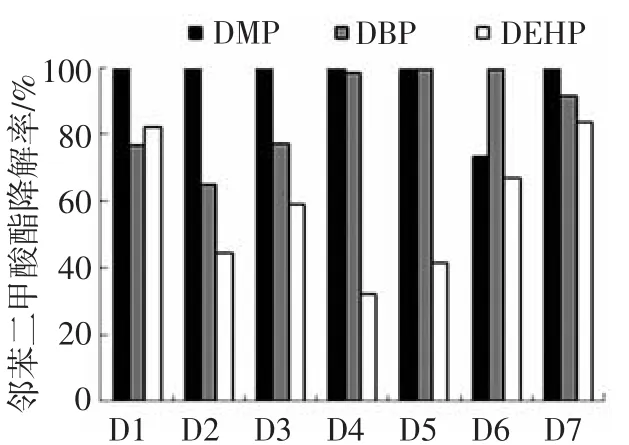
图2 不同菌株培养3 d后对DMP、DBP和DEHP的降解率
由图2还可以看出,菌株对PAEs的降解能力随侧链烷基链的增长而下降,相对分子质量较小的DMP的降解率明显高于长链DEHP.培养3 d后,所有菌株对DMP降解率均达70%以上,其中D3、D4、D5和D7达95%以上,基本能完成终极降解;但对DEHP的降解率均在50%左右,仅有两株菌达到80%.这与相对分子质量高的PAEs空间位阻大、不容易被微生物降解利用的报道一致[16].此外,从表3可以看出,人工湿地中微生物对PAEs的降解能力与其侧链烷基链的长度也有关.人工湿地进水中均检测到DMP、DBP和DEHP,但是在距进水口5 m左右土壤中已检测不到DMP,DBP和DEHP在人工湿地沿程土壤中的含量逐渐减少,在距出水口5 m左右的土壤中已经检测不到DBP,但DEHP仍然大量残留.这说明湿地微生物对DMP的去除效果最好,其次是DBP,对长链DEHP的降解能力较差.
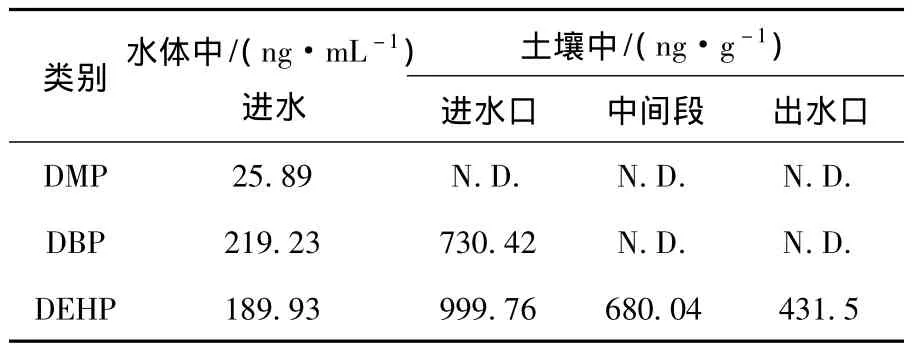
表3 人工湿地进水及土壤样品中邻苯二甲酸酯的含量
在PAEs的微生物好氧降解过程中,首先由微生物分泌的水解酶将双酯转化为单酯与相应的醇,再进一步将单酯转化为PA与相应的醇,而接下来PA的降解是整个降解过程的关键[17].并非所有的PAEs降解菌都能降解利用PA,Wu等[18]的研究表明,从活性污泥中分离得到的Gordonia sp.strain JDC-2能够将DOP降解为PA,但是不具备利用PA的能力,造成PA在培养体系中大量累积.因此,菌株能否利用PA对于是否能够实现对PAEs的终极降解至关重要.
2.5 菌株对邻苯二甲酸的利用
菌株在以PA为唯一碳源培养时的OD600连续监测结果见图3.分离到的7株菌均能利用PA,其中D4、D5和D7在以PA为唯一碳源培养时的生长较迅速,培养约2 d后进入对数生长期;D1和D2在PA培养液中的生长迟滞期较长,培养3 d后才进入对数生长期,且稳定期较短,在监测周期为24 h时,并未成功监测到稳定期就已经进入衰亡期;D3和D6生长缓慢,菌体浓度一直较低.
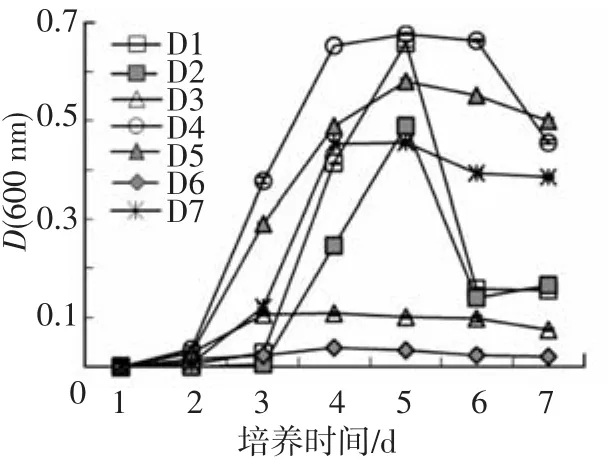
图3 菌株以PA为唯一碳源时的生长曲线
培养7 d后,取培养液离心后对上清液中残余的PA进行分析(图4).菌株D4对PA的利用率最高(达39%),其余菌株的利用率在13%~34%.其中菌株D3和D6对PA的利用率相对较低,分别为23%和13%,这应该是造成其生长缓慢的原因.本研究中分离得到的7株PAEs降解菌均能降解利用PA,这说明它们可能通过PA途径来实现PAEs的完全降解,有待进一步证实.
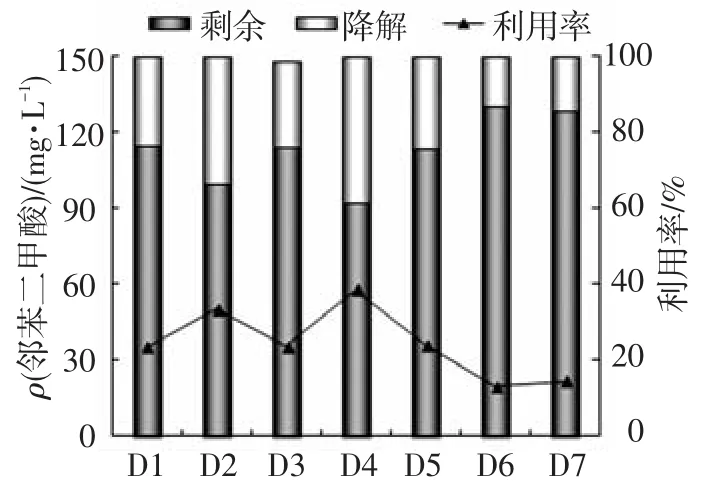
图4 不同菌株培养7 d后对PA的利用率
3 结论
1)从某人工湿地土壤样品中分离筛选出7株以PAEs为唯一碳源的高效PAEs降解细菌D1~D7.经生理生化、形态学观察和16S rDNA序列分析,鉴定D1、D2与铜绿假单胞菌(Pseudomonas aeruginosa)高度同源,相似度分别为100%和99%;D3与产气肠杆菌(Enterobacter aerogenes)的同源性在99%以上;其余4株降解菌与红球菌属(Rhodococcussp.)的同源性均在98%以上.
2)间歇培养3 d的实验表明,菌株D1和D7对PAEs的降解效率高于其他菌株,两者对DMP、DBP和DEHP的降解率均在70%以上;菌株对PAEs的降解能力随PAEs侧链烷基链的增长而下降,对相对分子质量较小的DMP的降解率明显高于长链DEHP.
3)这7株PAEs降解菌均能降解利用PA,说明可能具有完全矿化降解PAEs的潜力,有待进一步证实.
[1]ROSLEV P,VORKAMP K,AARUP J,et al.Degradation of phthalate esters in an activated sludge wastewater treatment plant[J].Water Research,2007,41(5):969-976.
[2]LIANG Dawei,ZHANG Tong,FANG H HP.Phthalates biodegradation in the environment[J].Appl Microbiol Biot,2008,80(2):183-198.
[3]FROMMEH,KUCHLERT,OTTOT,etal.Occurrence of phthalates and bisphenol A and F in the environment[J].Water Research,2002,36(6):1429-1438.
[4]ADENIYI A A,OKEDEYI O O,YUSUF K A.Flame ionization gas chromatographic determination of phthalate esters in water,surface sediments and fish species in the Ogun river catchments,Ketu,Lagos,Nigeria[J].Environmental Monitoring and Assessment,2011,172(1/2/3/4):561-569.
[5]CAI Quanying,MO Cehui,WU Qitang,et al.Occurrence of organic contaminants in sewage sludges from eleven wastewater treatment plants,China[J].Chemosphere,2007,68(9):1751-1762.
[6]TEIL M J,BLANCHARD M,CHEVREUIL M.Atmospheric fate of phthalate esters in an urban area(Paris-France)[J].Science of the Total Environment,2006,354(2/3):212-223.
[7]PLANELLO R,HERRERO O,MARTINEZ-GUITARTE J L,et al.Comparative effects of butyl benzyl phthalate(BBP)and di(2-ethylhexyl)phthalate(DEHP)on the aquatic larvae of Chironomus riparius based on gene expression assays related to the endocrine system,the stress response and ribosomes[J].Aquatic Toxicology,2011,105(1/2):62-70.
[8]ABDUL-GHANI S,YANAI J,ABDUL-GHANI R,et al.The teratogenicity and behavioral teratogenicity of di(2-ethylhexyl)phthalate(DEHP)anddi-butyl Phthalate(DBP)in a chick model[J].Neurotoxicology and Teratology,2012,34(1):56-62.
[9]LIAOCS,CHENLC,CHENBS,et al.Bioremediation of endocrine disruptor di-n-butyl phthalate ester by Deinococcus radiodurans and Pseudomonas stutzeri[J].Chemosphere,2010,78(3):342-346.
[10]陈济安,邱志群,舒为群.我国水环境中邻苯二甲酸酯污染现状及其生物降解研究进展[J].癌变.畸变.突变,2007(3):212-214.
[11]ALATRISTE-MONDRAGON F,IRANPOURR,AHRING B K.Toxicity of di-(2-ethylhexyl)phthalate on the anaerobic digestion of wastewater sludge[J].Water Research,2003,37(6):1260-1269.
[12]STAPLES C A,PETERSON D R,PARKERTON T F,et al.The environmental fate of phthalate esters:a literature review[J].Chemosphere,1997,35(4):667-749.
[13]王继华,李晶,马放.低温高效苯胺降解菌的分离与特性[J].哈尔滨工业大学学报,2008,40(10):1600-1605.
[14]DWORKIN M,FALKOW S,ROSENBERG E,et al.The prokaryotes[M].3rd ed.Germany:Springer,2006:62-64.
[15]R.E.布坎南,N.E.吉本斯.伯杰氏细菌鉴定手册[M].8版.北京:科学出版社,1984.
[16]夏凤毅,郑平.邻苯二甲酸酯化合物生物降解性与其化学结构的相关性[J].浙江大学学报:农业与生命科学版,2004,30(2):141-146.
[17]骆祝华,黄翔玲,叶德赞.环境内分泌干扰物——邻苯二甲酸酯的生物降解研究进展[J].应用与环境生物学报,2008,14(6):890-897.
[18]WU Xueling,LIANG Renxing,DAI Qinyun,et al.Complete degradation of di-n-octyl phthalate by biochemical cooperation between Gordonia sp strain JDC-2 and Arthrobacter sp strain JDC-32 isolated from activated sludge[J].Journal of Hazardous Materials,2010,176:262-268.
