可降解聚己内酯泡沫制备研究进展
2013-09-02朱光明郑曙光
刘 哲,朱光明,郑曙光
(西北工业大学理学院应用化学系,陕西 西安710129)
0 前言
可降解泡沫塑料因其可循环再生性及可生物降解性而引起广泛关注。目前,国内外学者对可降解泡沫塑料的研究与应用,主要集中于聚氨酯(PU)[1-6]、聚乳酸(PLA)[7-11]、PCL[12-14]、聚 酸 酐[15-16]、淀 粉[17]等 聚 合物,其中PCL泡沫因其具有良好的生物相容性、可降解性、良好的溶剂溶解性、易加工成型、较为优良的力学强度等特性而被广泛应用于医学领域,如人体组织工程支架材料[18-21]、软 组 织缝合线[22]、可 控 释药物载体[23]等,其中,组织工程支架材料是用来为细胞和组织的生长提供适宜的环境,并随着组织的构建而逐渐降解和消失,从而将新的空间提供给组织和细胞,它是组织工程学研究的热点,具有广泛的应用前景和潜在的巨大经济效益,被许多国家列为21世纪最具发展潜力的产业之一。PCL泡沫的制备方法多样,主要分为4大类:超临界气体发泡法、热致相分离法、溶剂浇铸/粒子沥滤法及快速成型造型法。
1 超临界气体发泡法制备PCL泡沫塑料
超临界气体(CO2、N2或二者的混合气)发泡PCL的原理为聚合物/超临界CO2均相体系在热力学不稳定作用下(压力降低或者温度升高)发生相分离,快速成核,然后经气泡膨胀、冷却固化定型得到PCL泡沫。根据制备方法及工艺的不同,又可以分为间歇成型法(又称为批处理法)、挤出成型法,其中间歇成型法装置简单,可控性强,各种工艺参数与所得微孔结构参数之间的关系清晰,在PCL微孔发泡中最为常见。
1.1 间歇成型法
间歇成型法又称批处理法,主要分为降压法和升温法两大类,如图1[24]所示,其基本原理是首先将一定量的超临界气体(CO2、N2等)溶于聚合物熔体中,经对流、扩散作用形成聚合物/气体均相体系。随后聚合物/超临界气体均相体系在热力学不稳定作用下(压力降低或者温度升高)发生相分离,快速成核,然后经气泡膨胀、冷却固化定型得到泡沫塑料。
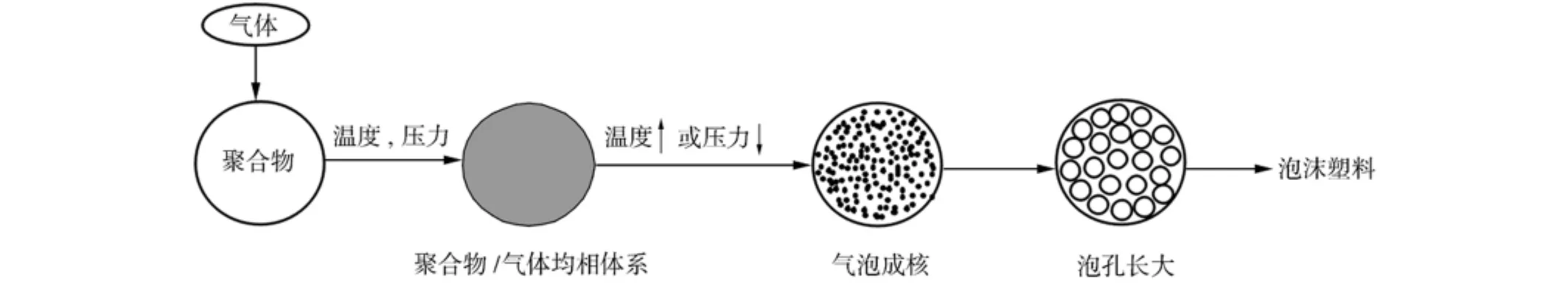
图1 间歇成型法制备泡沫塑料的过程示意图Fig.1 Schematic diagram of preparing cellular plastics by batch molding method
Jenkins[25]采用超临界CO2在65℃下充分饱和PCL小球,随后快速降压制备出平均孔径100~700μm、开闭孔相结合的PCL微孔泡沫,并研究了降压时间对PCL泡沫泡孔结构及性能的影响。结果表明,随着降压时间的延长,PCL泡沫平均泡孔孔径增大,由100μm升高至700μm,泡沫表观密度降低,力学性能逐渐下降,DSC分析则发现PCL泡沫的结晶度(70%)相比未发泡PCL材料升高。研究表明可以通过改变降压时间对PCL微孔泡沫的泡孔结构及力学性能加以控制。Karimi等[26]采用相同的方法制备出平均孔径为10~1500μm的PCL泡沫,并研究了饱和压力、温度及降压速率对PCL泡沫泡孔分布的影响。结果表明,降压速率较快时(1MPa/s),泡孔孔径尺寸分布较窄,大部分孔径为180μm,泡孔孔径分布函数在不同温度下形状相似,只有在较低温度下分布宽度较窄;降压速率较慢时(0.03~0.04MPa/s),初始发泡温度则决定PCL泡沫最终的泡孔分布,在较高温度下泡孔孔径分布较宽,且没有明显的最高峰出现。
Salerno等[27]首先采用3种不同的冷却模式(淬冷、中速冷却、慢速冷却)制备PCL及PCL/纳米羟基磷灰石(nHA)试样,并以超临界CO2为发泡剂,在温度范围37~40℃,压力范围10~20MPa下充分饱和该试样,随后降压制备微孔泡沫塑料,通过调节发泡参数,最终制备出具有开孔结构、孔隙率55%~85%、平均孔径40~250μm、泡孔密度105~108个/cm3的PCL及PCL/nHA泡沫塑料,研究了热历史及发泡参数对泡沫泡孔结构的影响。结果表明,热历史对于超临界CO2发泡PCL、PCL/nHA具有重要影响,冷却速率越快,PCL、PCL/nHA泡沫孔隙率越大,泡孔孔径分布越均匀;降压时间(2~900s)越长,泡孔孔径增大,孔径分布均匀性变差,通过两步降压过程(在较高压力下对试样进行饱和,随后缓慢降压至中压,待体系保持稳定后,再快速降压至常压)制备的PCL及PCL/nHA微孔泡沫塑料在组织工程领域中具有潜在的应用前景。
Salerno等[28]在此基础上以NaCl为致孔剂、超临界CO2/N2混合气体为发泡剂,结合超临界气体发泡技术及反向模板技术制备出具有开孔结构、多尺度(微、纳米尺寸)泡孔相结合的PCL及PCL/nHA泡沫支架,并通过改变NaCl含量、CO2/N2比例、nHA含量来研究多尺度泡孔PCL及PCL/nHA泡沫支架加工、结构、性能之间的相互关系。结果表明,随着NaCl含量增加,泡沫支架孔隙率增加,泡孔开孔率增加,静态压缩强度降低;随着CO2/N2气体中CO2比例的增加,泡孔支架孔隙率增大,平均孔径(微、纳米尺寸)均有所升高,静态压缩强度略有降低;随着nHA含量的升高,泡孔(纳米尺寸)孔径降低,亲水性略有提高,此外,成骨细胞MG63的培养实验表明多尺度泡孔PCL/nHA支架具有极好的生物相容性,表明其在骨再生领域具有潜在的应用前景。
间歇成型法制备的PCL泡沫可呈现开孔、闭孔、开闭孔相结合等多种泡孔形态,发泡参数如饱和时间、饱和压力、降压时间对泡孔结构具有重要影响,可以通过改变发泡参数对PCL泡沫的泡孔结构进行调节。
1.2 挤出成型法
Maio等[29]分别以超临界CO2、N2及二者的混合气为发泡剂,采用挤出发泡方法制备出具有开孔结构、平均孔径20~200μm、密度0.05~0.30g/cm3的PCL微孔泡沫,并对比研究了超临界CO2、N2及共混气体对PCL的发泡特征。结果表明,与N2相比,超临界CO2对PCL具有更优异的溶解性和更高的塑化效率,间歇成型及挤出成型中所需发泡温度更低,得到的PCL泡沫具有更低的表观密度及泡孔密度,超临界CO2/N2发泡的PCL泡沫性能介于二者之间,可以通过改变CO2/N2的比例来控制泡沫塑料的泡孔结构。
挤出成型法制备的PCL泡沫一般呈开孔结构,严格控制发泡参数如CO2浓度、挤出压力、口模温度等可以得到预期泡孔结构的PCL泡沫。
2 热致相分离法制备PCL泡沫塑料
热致相分离(TIPS)技术的原理是在聚合物的熔点以上,将聚合物溶于高沸点、低挥发性的溶剂中,形成均相溶液。随后降温冷却,在冷却过程中,体系会发生相分离。这个过程分两类,一类是固--液相分离(S-L相分离),一类是液- 液相分离(L-L相分离),PCL泡沫的制备过程一般属于固--液相分离,泡孔结构一般为开孔结构。
Gercek等[18]将PCL溶解于四氢呋喃中,随后将聚合物溶液置于-80℃下冷冻--干燥,PCL微球逐渐形成并相互积聚,最终制备出一种新型的、具有三维开孔结构的PCL支架,结构如图2所示,并研究了聚合物溶液浓度对PCL支架泡孔形态及性能的影响。结果表明,当聚合物溶液浓度(w/v)由10%升至20%时,支架孔隙率由95.9%降至74.4%,微球直径从50~70μm升至90~100μm,平均孔径由35~40μm增大至45~70μm;亲水性变化不大,相比作为原料的PCL疏水性增加;力学性能略微提高;降解速率加快;细胞亲和性更为优异;试管细胞培养实验表明牙周韧带细胞可以在溶液浓度为20%的PCL支架上增殖,表明通过冷冻--干燥法制备的PCL支架作为人体组织修复材料具有独特的应用前景。

图2 冷冻干燥的PCL支架的扫描电镜照片Fig.2 SEM micrographs for freeze dried PCL scaffolds
Tanaka等[19]以 含 水 的 1,4--二 氧 杂 环 己 烷(DIOX)为溶剂,采用类似方法制备PCL/左旋聚乳酸(PLLA)微孔泡沫,并研究了共混物溶液的相态特征及共混物泡沫的泡孔形态。结果表明,共混物溶液的相态特征与PCL及PLLA溶液的类似,但是共混物泡沫相比均聚物泡沫则呈现出不同的形态,且随着共混物中组分相对含量的不同而发生变化。
Fabbri等[20]以碳酸二甲酯(DMC)或 DIOX为溶剂,采用固--液相分离技术制备出具有开孔结构、空隙率为88%~92%的PCL/生物玻璃(BG,以SiO2-Na2O-CaO-P2O5体系为基础,具有特殊表面活性,植入体内后可增强与周围组织相互作用的玻璃)泡沫支架,并研究了溶剂种类、PCL溶液浓度、BG含量对PCL泡沫泡孔结构及性能的影响。结果表明,DIOX作为溶剂制备的PCL泡沫支架具有更大的泡孔孔径及更为规整的泡孔形态,且表现出更高的压缩强度及硬度,PCL溶液浓度对泡孔形态及性能影响不大,引入BG则对泡孔规整度有一定破坏,但提高了泡沫的硬度及压缩强度;细胞培养实验表明由于PCL/BG支架的疏水性,细胞增殖能力较弱。Mohan等[21]采用低温固-液相分离技术制备出开孔结构的PCL/PVA泡沫支架,随后采用戊二醛作为交联剂处理PCL/PVA支架得到具有半IPN结构的PCL/PVA泡沫支架,并研究了PVA含量对PCL支架的性能的影响。结果表明,加入PVA改善了PCL泡沫的亲水性,其中PVA相对含量为50%时,PCL泡沫支架具有最佳的力学及膨胀性能,同时加入PVA还为PCL支架的RGD肽改性提供可能。
TIPS法可用于结晶性聚合物微孔滤膜的制备,而且TIPS法容易控制,可由TIPS法获得多种微观结构,如开孔、闭孔、各同向性、各异向性、非对称等。
3 溶剂浇铸/粒子沥滤法制备PCL泡沫塑料
溶剂浇铸/粒子沥滤技术的原理是将聚合物溶解在适当的溶剂中,同时筛分获得所需尺寸大小的致孔剂(一般为不溶于有机溶剂的NaCl、NaHCO3及部分可溶性高聚物)颗粒,将致孔剂颗粒均匀分散在聚合物溶液中,随后将溶液浇铸在适当模具中,待溶剂挥发后,用去离子水浸出聚合物中的水溶性致孔剂,即获得具有开孔结构的聚合物泡沫塑料。
Ozkan等[30]以NaCl为致孔剂、二氯甲烷为溶剂,通过溶液浇铸/粒子沥滤技术,采用双螺杆挤出/螺旋缠绕(TSESW)工艺制备出径向方向具有分级(离散的或者连续的等级)孔隙率、孔径分布、纳米β-磷酸三钙(β-TCP)含量的PCL/纳米β-TCP泡沫支架,如图3所示,随后在PCL泡沫支架中实施了人胚成骨细胞的体外培养实验,并对泡孔结构、β-TCP含量对PCL泡沫支架压缩性能的影响及泡沫支架生物相容性进行了研究。结果表明,在其他泡孔结构不变的前提下,孔隙率增大,压缩强度及模量减小;孔径分布变化,压缩强度及模量变化不大;纳米β-TCP含量增加,结晶度降低,压缩强度及模量增大;体外细胞培养实验显示PCL/纳米β-TCP泡沫支架具有极佳的细胞亲和性,表明PCL泡沫支架可用于修复人体较大的组织损伤,而双螺杆挤出/螺旋缠绕(TSESW)工艺则为复杂的PCL泡沫支架的制备指明了新的方向。

图3 双螺杆挤出/螺旋缠绕过程及制备的典型的泡沫支架Fig.3 Twin screw extrusion/spiral winding progress and the typical foam scaffolds
Diba等[31]以NaCl为致孔剂、氯仿为溶剂,制备出开孔结构、孔隙率为90%、平均孔径100μm左右的PCL/纳米硅酸镁石(MP)复合泡沫支架,并通过研究发现加入MP使得PCL泡沫支架压缩强度增加,弹性模量升高,生物活性也得以提高,降解速率增大,表明可以通过改变MP的含量来调节PCL支架的各种性能。Wu等[32]则以NaCl为致孔剂,以二氯甲烷为溶剂,制备出开孔结构的PCL/MP泡沫,并研究了加入MP对PCL泡沫性能的影响。结果表明,加入MP改善了PCL的亲水性,对泡沫孔隙率影响不大,但力学性能下降,体外降解实验表明随着MP含量增大,降解速率逐渐加快,可以通过改变MP含量调节PCL支架的降解速率。
Wang[33]以 NaCl为致孔剂,将PCL、nHA 及致孔剂等熔融混合模塑成型,随后在水中沥滤除去致孔剂,制备出具有开孔结构的PCL/nHA泡沫支架,并研究了加入nHA对PCL泡沫支架力学性能及降解性能的影响。结果表明,随着nHA含量的增加,PCL泡沫支架压缩模量逐渐降低,由24.48MPa降为2.69MPa,孔隙率基本不变,保持为70%,经过6个月的体外降解实验,PCL/nHA支架的力学性能及泡孔结构基本保持不变,7d的细胞培养实验表明PCL/nHA泡沫支架具有良好的生物组织亲和性,表明其在骨组织工程方面具有巨大的应用潜力。Cannillo等[34]则以NaCl、NaHCO3为致孔剂,采用粒子沥滤技术制备出开孔结构的PCL/BG泡沫支架,并对PCL泡沫支架的性能进行了研究。结果表明,BG含量对PCL泡沫支架的力学性能影响不大,沥滤过程中BG与水接触生成方解石,疏水性增加,降低了对细胞的亲和性。
Liu等[38]以NaCl和聚乙二醇(PEG)为复合致孔剂,采用熔融模塑/粒子沥滤技术制备出具有开孔结构PCL/nHA复合泡沫支架,并研究了致孔剂配比及PEG种类对PCL支架性能的影响。结果表明,致孔剂中PEG含量越小、相对分子质量越低,PCL支架中大孔(大于50μm)比例越大,力学性能越高,降解实验中质量损失也越低,对细胞的亲和性也愈佳,表明泡孔结构中大孔比例越高、泡孔连通性愈好,PCL泡沫支架表现出更好的力学性能及更高的生物亲和性。
溶液浇铸/粒子沥滤法制备的PCL泡沫泡孔结构受NaCl含量及颗粒尺寸影响较大,泡孔内部相互贯穿,泡孔结构不规整。
4 快速成型造型法制备PCL泡沫塑料
快速成型制造法是近年来兴起的一种制备聚合物泡沫支架的新技术,它将有限元模型分析与计算机设计及制造有机结合,可以制备泡孔结构预先设计和确定、结构复杂的聚合物泡沫,具有巨大的应用前景。其中又可分为4类:立体光刻法、3D印刷法、熔融沉积制造法与选区激光烧结法。对于PCL,主要介绍熔融沉积制造法及选区激光烧结法。
4.1 熔融沉积造型法
熔融沉积造型(FDM)技术的原理是利用热塑性树脂的热熔性和黏结性,在计算机控制下让热塑性树脂层层堆积成型。丝状材料由送丝机构送进喷头并在喷头内加热成熔融状态,喷头在计算机的控制下,按照模型的CAD分层数据控制的零件截面轮廓和填充轨迹作X-Y平面运动,同时将熔化的材料以较低的速度挤出并控制其流量,材料被选择性的沉积在层面指定位置后迅速凝固,形成截面轮廓,并与周围的材料凝结。一层截面完成后,工作台下降一层的高度,再继续进行下一层的沉积,直至完成整个零件或实体的制造。FMD方法无材料浪费,环境整洁,尤其制造薄壁空心零件时速度较快,材料价格比较较低,性价比较高。目前主要用于模具制造和医疗产品的加工。
Hutmacher等[36]采用FDM 技术制备出开孔结构、孔隙率为(61±1)%的PCL泡沫支架,并研究了两种沉积模式下PCL泡沫支架的力学性能。结果表明:0/60/120°沉积模式下PCL支架在空气中及37℃盐溶液中的压缩强度为分别为(41.9±3.5)MPa与(29.4±4.0)MPa,0/72/144/36/108°沉积模式下的PCL对应的抗压强度则分别为(20.2±1.7)MPa与(21.5±2.9)MPa,表明3角度沉积模式下PCL支架具有更优异的力学性能;细胞培养实验则表明PCL泡沫支架具有极佳的生物相容性,表明FDM作为一种设计和制造具有定制结构组织工程材料的新技术,具有广阔的应用前景。
Jiang等[37]采用一种新的微沉积系统(MDS)技术制备出具有开孔结构、孔隙率为54.6%、X-Y平面平均孔径716μm、z轴方向孔径为116μm泡孔结构可控的PCL/HA泡沫支架,并研究了加入HA对PCL支架性能的影响。研究表明,HA含量从0升至40%时,吸水率由8%升至39%,压缩强度由26.5MPa升至49.8MPa,并成功制备出具有开孔结构、泡孔贯通的人体下颚骨模型,表明MDS技术在制备结构可控泡沫塑料方面具有巨大的应用前景。
FDM技术是通过按照一定的模式层层沉积聚合物熔体来得到特定结构PCL泡沫支架的方法,要求原料为细丝状热塑性聚合物,MDS技术原理与之类似,但对原料形态并无要求,具有更强的可操作性。
4.2 选择性激光烧结法
选择性激光烧结(SLS)技术的原理是首先生成一个产品的三维CAD模型或曲面模型文件,将其转换成STL格式,再从STL文件“切”出设定厚度的一系列片层,或者直接从CAD文件切出一系列的片层,这些片层按次序累积起来便是所涉及零件的形状,随后采用激光有选择地分层烧结固体粉末,并使烧结成型的固化层层层叠加生成所需形状的零件。其整个工艺过程包括CAD模型的建立及数据处理、铺粉、烧结以及后处理等,具有工艺简单、精度高、材料利用率高、适用于多种材料等优点。
Eshraghi等[38]采用SLS技术制备出具有一维、二维、三维正交直线泡孔结构的PCL泡沫支架,并对PCL固体、PCL泡沫支架的拉伸及压缩性能的实验测试和有限元模型分析进行研究。研究表明,PCL泡沫支架拉伸断面孔隙率为56.87%~83.30%,拉伸强度为1.1 ~4.5MPa,拉伸模量为35.5~140.5MPa,拉伸屈服强度为0.76~3.2MPa;压缩断面孔隙率为51.1 %~80.9%,压缩强度0.6~10.0MPa,压缩模量12.1 ~14.9MPa,压缩屈服强度0.42~4.25MPa,相比PCL固体力学性能下降较大;随着孔隙率升高,一维泡孔分布PCL支架力学性能急剧下降,二维、三维泡孔分布PCL支架力学性能下降趋势变缓;有限元分析表明PCL固体及PCL泡沫力学性能实测值与计算有效值吻合性极佳,表明可以通过SLS技术制备出具有定向泡孔结构、可预测力学性能的PCL泡沫支架。
Eosoly等[39]采用SLS制备出具有二维、三维泡孔结构的PCL/HA泡沫支架,并研究了加入HA和细胞培养对PCL/HA泡沫支架表面形貌及力学性能的影响。结果表明,加入HA对PCL面形貌影响不大,但改善了PCL的亲水性,提高了其生物活性,在较低含量下(15%),细胞具有更强的代谢活性;细胞增殖则使PCL表面变得平滑,但对PCL泡沫支架的弹性模量影响不大,随着增殖过程的进行,PCL压缩强度先降低,2周后又恢复到未增殖前水平。Yeong等[40]结合选区激光烧结技术与计算机辅助系统(CASTS),制备出平均孔径40~100μm、压缩模量为345kPa的软质PCL泡沫支架。细胞培养实验表明C2C12成肌细胞在PCL中具有极佳的代谢活性,表明PCL软质泡沫支架在心脏组织工程领域具有潜在应用价值。
SLS可采用多种原料,无须设计与制造支撑,也无须对制品进行后矫正,原料可重复利用,具有较大的发展潜力。
5 前景与展望
近20年来,国内外关于可降解医用PCL泡沫材料进行了大量的的研究,也取得了卓越的成果:初步探索了PCL泡沫的制备方法,研发了PCL泡沫的生产设备,设计了相关的制备工艺,并初步研究了细胞在PCL泡沫支架中的增殖特征,制备了泡孔结构、形态、性能各异的PCL泡沫支架。然而,人体组织用PCL泡沫的临床应用还远未实现,泡孔结构的精确控制、泡沫力学性能的精确控制及与细胞增殖的关系、泡沫表面结构与细胞增殖的关系、细胞活性物质在PCL界面间的传输等问题还亟待解决,相关的生产设备与生产工艺也需要改进,相关理论也亟需丰富和完善,需要计算机、化学、生物学、机械等多学科通力合作以推动改领域的发展。
快速成型制造法包括立体光刻法、3D印刷法、熔融沉积制造法与选区激光烧结法等,是制备具有可控泡孔结构、可控性能、结构复杂的聚合物泡沫的有效方法,具有广阔而美好的应用前景。
[1] Chuayjuljit S,Maungchuareon A,Saravari O.Preparation and Properties of Palm Oil-based Rigid Polyurethane Nanocomposite Foams[J].Journal of Reinforced Plastics and Composites,2010,29(2):218-225.
[2] Liu J J,Chen F G,Qiu M H.Liquefaction of Bagasse and Preparation of Rigid Polyurethane Foam from Liquefaction Products[J].Journal of Biobased Materials and Bioenergy,2009,3(4):401-407.
[3] Chen F G,Lu Z M,Liquefaction of Wheat Straw and Preparation of Rigid Polyurethane Foams from the Liquefaction Products[J].Journal of Applied Polymer Science,2009,111:508-516.
[4] Ahern A,Verbist G,Weaire D,et al.The Conductivity of Foams:a Generalization of the Electrical to the Thermal Case[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2005,263:275-279.
[5] Hakima A A A,Nassara M,Emamb A,et al.Preparation and Characterization of Rigid Polyurethane Foam Prepared from Sugar-cane Bagasse Polyol[J]. Materials Chemistry and Physics,2011,129:301-307.
[6] Kurimoto Y,Takeda M,Koizumi S,et al.Mechanical Properties of Polyurethane Films Prepared from Liquefied Wood with Polymeric MDI[J].Bioresource Technology,2000,74:151-157.
[7] Wang J,Zhu W L,Tao H T,et al.Continuous Processing of Low-density,Microcellular Poly(Lactic Acid)Foams with Controlled Cell Morphology and Crystallinity[J].Chemical Engineering Science,2012,75:390-399.
[8] Lu L C,Peter S J,Lyman M D,et al.In Vitro Degradation of Porous Poly(L-Lactic Acid)Foams[J].Biomaterials,2009,21:1595-1605.
[9] Georgior G,Mathieu L,Pioletti D P,et al.Polylactic Acid-phosphate Glass Composite Foams as Scaffolds for Bone Tissue Engineering[J].Journal of Biomedical Materials Research,Part B:Applied Biomaterials,2007,80B:322-331.
[10] Rowlands A S,Lim S A,Martin D,et al.Polyurethane/Poly(Lactic-Co-Glycolic)Acid Composite Scaffolds Fabricated by Thermally Induced Phase Separation[J].Biomaterials,2007,28:2109-2121.
[11] Teng X R,Ren J,Gu S Y.Preparation and Characterization of Porous PDLLA/HA Composite Foams by Supercritical Carbon Dioxide Technology[J].Journal of Biomedical Materials Research,Part B:Applied Biomaterials,2007,81B:185-193.
[12] Xu Q,Ren X W,Chang Y N,et al.Generation of Microcellular Biodegradable Polycaprolactone Foams in Supercritical Carbon Dioxide[J].Journal of Applied Polymer Science,2004,94:593-597.
[13] Jaina L P,Modia S,Dombb A J,et al.Role of Polyan-hydrides as Localized Drug Carriers[J].Journal of Controlled Release,2005,103:541-563.
[14] Kattia D S,Lakshmia S,Langerb R,et al.Toxicity,Biodegradation and Elimination of Polyanhydrides[J].Advanced Drug Delivery Reviews,2012,54:933-961.
[15] Holmbom J,Sodergard A,Ekholm E,et al.Long-term Evaluation of Porous Poly(β-Caprola ctone-co-llactide)as a Bone-filling Material[J].Journal of Biomedical Materials Research,Part A,2005,75A:308-315.
[16] Williamsa J M,Adewunmib A,Schek R M,et al.Bone Tissue Engineering Using Polycaprolactone Scaffolds Fabricated Via Selective Laser Sintering[J].Biomaterials,2005,26:4817-4827.
[17] Salgado P R,Schmidt V C,Molina Ortiz S E,et al.Biodegradable Foams Based on Cassava Starch,Sunflower Proteins and Cellulose Fibers Obtained by a Baking Process[J].Journal of Food Engineering,2008,85:435-443.
[18] Gercek I,Tigli R S,Gumusderelioglu M.A Novel Scaffold Based on Formation and Agglomeration of PCL Microbeads by Freeze-drying[J].Journal of Biomedical Materials Research,Part A,2008,86A:1012-1022.
[19] Tanaka T,Eguchi S,Saitoh H,et al.Microporous Foams of Polymer Blends of Poly(L-Lactic Acid)and Poly(ε-Caprolactone)[J].Desalination,2008,234:175-183.
[20] Fabbri P,Cannillo V,Sola A,et al.Highly Porous Polycaprolactone-45S5Bioglass Scaffolds for Bone Tissue Engineering[J].Composites Science and Technology,2010,70:1869-1878.
[21] Mohan N,Nair P D.Polycaprolactone Coated Porous Tricalcium Phosphate Scaffolds for Controlled Release of Protein for Tissue Engineering[J].Journal of Biomedical Materials Research,Part B:Applied Biomaterials,2009,91B:831-838.
[22] Tay B Y,Zhang S X,Myint M H,et al.Processing of Polycaprolactone Porous Structure for Scaffold Development[J].Journal of Materials Processing Technology,2007,182(1-3):117-121.
[23] Kim H W,Lee E J,Jun I K,et al.Degradation and Drug Release of Phosphate Glass/Polycaprolactone Biological Composites for Hard-tissue Regeneration[J].Journal of Biomedical Materials Research,Part B:Applied Biomaterials,2005,75B:34-41.
[24] Xu Z M,Jiang X L,Liu T,et al.Foaming of Polypropylene with Supercritical Carbon Dioxide[J].The Journal of Supercritical Fluids,2007,41:299-310.
[25] Jenkins M J,Harrison K L,Silva M M C G,et al.Characterisation of Microcellular Foams Produced from Semi-crystalline PCL Using Supercritical Carbon Dioxide[J].European Polymer Journal,2006,42:3145-3151.
[26] Karimia M,Heuchel M,Weigel T,et al.Formation and Size Distribution of Pores in Poly(ε-Caprolactone)Foams Prepared By Pressure Quenching Using Supercritical CO2[J].Journal of Supercritical Fluids,2012,61:175-190.
[27] Salerno A,Maio E D,Iannace S,et al.Solid-state Supercritical CO2Foaming of PCL and PCL-HA Nano-composite:Effect of Composition,Thermal History and Foaming Process on Foam Pore Structure[J].Journal of Supercritical Fluids,2011,58:158-167.
[28] Salerno A,Zeppetelli S,Maio E D,et al.Processing/Structure/Property Relationship of Multi-scaled PCL and PCL HA Composite Scaffolds Prepared via Gas Foaming and NaCl Reverse Templating[J].Biotechnol Bioeng,2011,108:963-976.
[29] Maio E D,Mensitieri G,Iannace S,et al.Structure Optimization of Polycaprolactone Foams by Using Mixtures of CO2and N2as Blowing Agents[J].Polymer Engineering &Science,2005,45:432-441.
[30] Ozkan S,Kalyon D M,Yu X Y.Functionally Graded BTCP/PCL Nanocomposite Scaffolds:In Vitro Evaluation with Human Fetal Osteoblast Cells for Bone Tissue Engineering[J].Journal of Biomedical Materials Research,Part A,2010,92A:1007-1018.
[31] Diba M,Kharaziha M,Fathi M H,et al.Preparation and Characterization of Polyca-prolactone/Forsterite Nanocomposite Porous Scaffolds Designed for Bone Tissue Regeneration[J].Composites Science and Technology,2012,72:716-723.
[32] Wu F,Liu C S,O'Neill Brian,et al.Fabrication and Properties of Porous Scaffold of Magnesium Phosphate/Polycaprolactone Biocomposite for Bone Tissue Engineering[J].Applied Surface Science,2012,258:7589-7595.
[33] Wang Y Y,Liu L,Guo S R.Characterization of Biodegradable and Cytocompatible Nano-Hydroxyapatite/Polycaprolactone Porous Scaffolds in Degradation in Vitro[J].Polymer Degradation and Stability,2010,95:207-213.
[34] Cannillo V,Chiellini F,Fabbri P,et al.Production of Bioglass-Polycaprolactone Composite Scaffolds Via Salt-Leaching[J].Composite Structures,2010,92:1823-1832.
[35] Liu L,Wang Y Y,Guo S R,et al.Porous Polycaprolactone/Nanohydroxyapatite Tissue Engineering Scaffolds Fabricated By Combining NaCl and PEG as Coporogens:Structure,Property,and Chondrocyte-scaffold Interaction in Vitro[J].Journal of Biomedical Materials Research,Part B:Applied Biomaterials,2012,100B:956-966.
[36] Hutmacher D W,Schantz T,Zein I,et al.Mechanical Properties and Cell Cultural Response of Polycaprolactone Scaffolds Designed and Fabricated Via Fused Deposition Modeling[J].Journal of Biomedical Materials Research,Part A,2001,55:203-216.
[37] Jiang W B,Shi J,Li W,et al.Morphology,Wettability,and Mechanical Properties of Polycaprolactone/Hydroxyapatite Composite Scaffolds With Interconnected Pore Structures Fabricated by a Mini-deposition System[J].Polymer Engineering & Science,2012,52(11):2396-2402.
[38] Eshraghi S,Das S. Mechanical and Microstructural Properties of Polycaprolactone scaffoldswith One-dimensional,Two-dimensional,and Three-dimensional Orthogonally Oriented Porous Architectures Produced By Selective Laser Sintering[J].Acta Biomaterialia,2010,6:2467-2476.
[39] Eosoly S,Vrana N E,Lohfeld S,et al.Interaction of Cell Culture with Composition Effects on the Mechanical Properties of Polycaprolactone-hydroxyapatite Scaffolds Fabricated Via Selective Laser Sintering(SLS)[J].Materials Science and Engineering,Part C,2012,32(8):2250-2257.
[40] Yeong W Y,Sudarmadji N,Yu H Y,et al.Porous Polycaprolactone Scaffold for Cardiac Tissue Engineering Fabricated by Selective Laser Sintering[J].Acta Bioma-terialia,2010,6:2028-2034.
