鸭源呼肠孤病毒Sigma A蛋白的原核表达及免疫活性检测
2013-08-30朱英奇陈宗艳李传峰孟春春王桂军刘光清
朱英奇,陈宗艳,李传峰,孟春春,王桂军,刘光清*
(1.安徽农业大学动物科技学院,安徽合肥 230036;2.中国农业科学院上海兽医研究所,上海 200241)
2011年上半年,中国太湖流域的许多养鸭场陆续发生一种新的鸭病毒性传染病,临床主要表现为发病雏鸭软脚,排白色稀粪,生长发育迟缓,发病率约为20%~60%,病死率在80%以上,给养鸭业造成了较为严重的经济损失[1]。经鉴定造成该次疫情的病原是一种不同于番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)的新型呼肠孤病毒(Duck reovirus,DRV)[2]。
与禽源呼肠孤病毒(Avian reovirus,ARV)相似,该病毒基因组由分节段的10个基因片段组成。其核酸SDS-PAGE电泳图式与ARV相似,与MDRV差异较大;但中片段、小片段迁移率与ARV和MDRV均有较大差异[3]。病毒编码10个蛋白,包括构成衣壳结构的8个结构蛋白和2个非结构蛋白。其中,Sigma A蛋白由S2基因编码,含有417个氨基酸残基,分子量为46.2 ku,是够成内衣壳的主要成分[4]。Sigma A蛋白具有结合dsRNA的功能[5],Martnez-Costas等认为其通过阻断宿主细胞内病毒dsRNA依赖性蛋白激酶(PKR)的激活,从而阻断干扰素的抗病毒效应[6]。目前对呼肠孤病毒S节段编码蛋白的研究主要集中于Sigma B和Sigma C蛋白,Sigma A蛋白的功能有待进一步研究。
本研究对DRV的Sigma A基因进行了克隆和分析,并将其进行原核表达,为进一步研究Sigma A蛋白功能等奠定基础。
1 材料和方法
1.1 病毒株、菌株、载体及实验动物 大肠杆菌DH5α、原核表达载体pET-32a(+)由本实验室保存;大肠杆菌BL21(DE3)购自天根生化科技(北京)有限公司;4月龄雌性新西兰白兔购自上海斯莱克实验动物有限公司。
1.2 主要试剂 TRIzol RNA提取试剂购自Invitrogen公司;M-MLV反转录酶、ExTaqDNA聚合酶、T4DNA连接酶、限制性内切酶均购自TaKaRa公司;质粒提取试剂盒、DNA凝胶回收试剂盒购自生工生物工程(上海)有限公司;His-Tagged Protein Purification Kit购自北京康为世纪生物科技有限公司;HRP标记的羊抗兔IgG(HRP-IgG)购自北京中杉金桥生物技术有限公司;兔抗DRV全病毒血清由本实验室制备保存;弗氏佐剂购自Sigma公司。
1.3 引物设计与合成 根据DRV S2基因序列(GQ664689)设计一对扩增Sigma A完整ORF的特异性引物,SigmaA-F:5'-ACTACGAATTCATGGCGCG TGCCGTGTAC-3'(EcoRⅠ);SigmaA-R:5'-CCGAC TCGAGTTAGACGGTAAAGTG-3'(XhoⅠ)。预期扩增片段为1 251 bp,引物由上海杰李生物技术有限公司合成。
1.4 目的基因的扩增与克隆 参考文献[7]的方法提取DRV TH-11株病毒基因组,RT-PCR扩增SigmaA ORF片段,PCR扩增条件为:94℃5 min;94℃45 s、58℃45 s、72℃1m in 30 s,30个循环;72℃10 Min。产物经EcoRⅠ和XhoⅠ酶切后克隆至原核表达载体pET-32a(+)中,构建的重组表达质粒pET-SigmaA由上海杰李生物技术有限公司测序。
1.5 重组蛋白的诱导表达 将pET-SigmaA转化宿主菌BL21(DE3)中,加入终浓度为0.5 mmol/L的IPTG进行诱导表达,并分别在诱导前及诱导后第2 h、4 h、6 h取出1m L菌液进行SDS-PAGE,以确定最佳诱导时间。超声破碎诱导6 h后的菌体细胞,进行SDS-PAGE分析Sigma A蛋白的表达。
1.6 重组蛋白的纯化及反应原性检测 采用镍离子亲和纯化柱进行纯化。以纯化的Sigma A重组蛋白为抗原,兔抗DRV TH11全病毒血清为一抗,以羊抗兔HRP-IgG为二抗进行western blot分析,检测Sigma A蛋白的反应原性。
1.7 多克隆抗体的制备及其效价测定 将纯化蛋白免疫新西兰白兔,初次免疫后每间隔两周进行1次免疫,共3次。第4次免疫一周后采血,用全病毒作为包被抗原建立的间接ELISA方法测抗体效价。
1.8 多克隆抗体间接免疫荧光(IFA)检测 将DRV接种于鸭胚成纤维细胞(DEF),培养2 d,加入4%多聚甲醛固定细胞,以制备的多克隆抗体为一抗,FITC标记的羊抗兔IgG为二抗,同时设未接种病毒的细胞为阴性对照,进行IFA鉴定。
2 结果与讨论
2.1 Sigm a A基因的克隆 用引物SigmaA-F和SigmaA-R扩增出DRV TH11株的Sigma A基因,其大小约为1 200 bp(图1),与预期结果相符。将纯化的PCR产物用EcoRⅠ和XhoⅠ双酶切后,克隆于pET-32a(+)中,获得pET-SigmaA。该重组质粒经酶切与测序鉴定,表明获得DRV Sigma A基因。
2.2 Sigma A蛋白表达与纯化 将pET-SigmaA转化至BL21(DE3),用IPTG进行诱导,经优化,确定IPTG的最佳诱导浓度为0.5 mmol/L。用IPTG诱导6 h后,进行SDS-PAGE电泳。结果显示,重组Sigma A蛋白获得了表达,分子量大小约为66 ku(图2)。而且在菌体上清和包涵体中均有蛋白表达。用 6×His-Tagged Protein Purification Kit纯化重组蛋白,采用western blot进行鉴定,表明重组Sigma A蛋白可以与兔抗DRV阳性血清呈特异性反应(图2),证明纯化后的重组Sigma A蛋白具有良好反应原性。
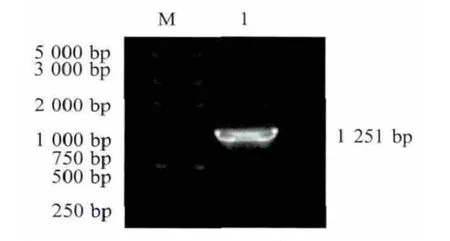
图1 DRV Sigma A基因的RT-PCR扩增结果Fig.1 Amplification result of DRV Sigma A gene by RT-PCR
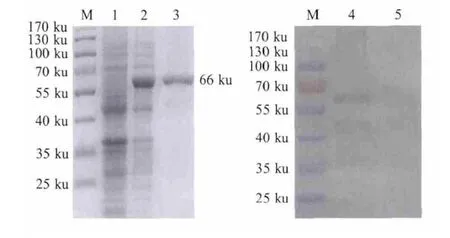
图2 SDS-PAGE(A)和western blot(B)鉴定、分析重组蛋白Fig.2 Identification of the recombinant protein bySDS-PAGE(A)and western blot(B)
2.3 多克隆抗体制备及其效价检测 以纯化的重组Sigma A蛋白免疫新西兰白兔,初次免疫后每间隔两周进行1次加强免疫,共3次。第四次免疫一周后采血,用间接ELISA测抗体效价,其效价在1∶20 000 以上。
2.4 多克隆抗体的IFA检测 DRV感染DEF细胞后,采用IFA检测到多克隆抗体与细胞中病毒Sigma A蛋白特异性结合,产生绿色荧光;而阴性对照组的细胞无荧光信号(图3)。
ARV Sigma A蛋白是主要内衣壳蛋白,具有阻断干扰素抗病毒的功能,在ARV的病毒粒子结构的稳定和致病机理上具有重要作用[8]。本研究采用RT-PCR技术扩增出了DRV-TH11株完整的Sigma A编码基因,将其插入原核表达载体pET-32a(+)中,在大肠杆菌种获得了高效表达,通过对诱导条件进行优化,表达的融合蛋白主要存在于上清中。重组蛋白经6×His-Tagged Protein Purification Kit纯化后经western blot检测表明重组蛋白具有良好的抗原性。以纯化的蛋白作为免疫原,制备了高效价、特异性结合的多克隆抗体。为今后进一步研究Sigma A蛋白功能以及检测方法等奠定了基础。

图3 多克隆抗体的IFA鉴定结果Fig.3 Detection of anti-SigmaA serum in DRV infected DEF cell by IFA
[1]Chen Zong-yan,Zhu Ying-qi,Li Chuang-feng,et al.Outbreak-associated Novel Duck reovirus,China,2011[J].Emerg Infect Dis,2012,18(7):1209-1211.
[2]陈宗艳,朱英奇,王世传,等.一株鸭源呼肠孤病毒(TH11株)的分离与鉴定[J].中国动物传染病学报,2012,20(1):10-15.
[3]陈少莺,陈仕龙,林锋强,等.新型鸭呼肠孤病毒的分离与鉴定[J].病毒学报,2012,28(3):224-230.
[4]Martnez-Costas J,Grande A,Varela R,et al.Protein architecture of avian reovirus S1133 and identification of the cell attachment protein[J].JVirol,1997,71(1):59-64.
[5]Yin H S,Shien JH,Lee L H.Synthesis inEscherichia coliof avian reovirus core proteinσA and its dsRNA-binding activity[J].Virology,2000,266(1):33-41.
[6]Martnez-Costas J,Gonzalez-Lopez C,Vakharia V N,et al.Possible involement of the double-stranded RNA-binding core proteinσA in the resistance of avian reovirus to interferon[J].J Virol,2000,74(3):1124-1131.
[7]刘光清,倪征,张玉颖,等.兔病毒性出血症病毒JX/97株衣壳蛋白基因的序列测定与分析[J].农业生物技术学报,2006,14(2):191-196.
[8]Xu W,Patrick MK,Hazelton P R,et al.Avian reovirus temperature-sensitive mutant tsA12 has a lesion in major core proteinσA and is defective in assembly[J].JVirol,2004,78(20):11142-11151.
