动物性食品中氯化亚汞、硝酸亚汞和醋酸汞的总汞残留测定方法研究
2013-08-29陈妍召孙永学
陈 超,陈妍召,张 草,孙永学
(华南农业大学 兽医学院,广东 广州 510642)
由于工业化的发展及人类生产、生活的活动范围扩大,使得现今的重金属污染严重.食品中的重金属残留已成为食品安全的主要问题之一.硝酸亚汞是一种水产养殖上治疗小瓜虫病和水霉病的鱼药,同类的含汞杀虫剂还有氯化亚汞、醋酸汞、吡啶基醋酸汞等.根据我国农业部第235 号公告,以上几类含汞杀虫剂被禁止使用.另外,氯化亚汞在人医药上也被用作杀真菌剂、泻剂、防腐剂、利尿剂等.如果用含汞废水灌溉或不合理地使用违禁含汞农药、渔药,会使农作物和水产品中汞含量增高,并通过食物链的逐步富集最终危害到人类的健康.
目前,对食品中汞的测定法有二硫腙比色法、冷原子吸收法和原子荧光光谱法[1].但二硫腙比色法[2]现已很少使用,冷原子吸收法(CV-AAS)[3-6]由于操作复杂,分析时间长,灵敏度与准确度也较差,现已不能满足新的卫生标准要求.氢化物发生-原子荧光法(HG-AFS)具有操作简便、灵敏度高、结果准确等优点,已被广泛使用于水质监测[7-10]、土壤[11-14]、化妆品[15-16]和食品[17-24]中汞的含量检测.本文采用微波消解处理、氢化物发生-原子荧光光谱法建立了动物性食品中经氯化亚汞、硝酸亚汞和醋酸汞污染源性的总汞残留量测定方法,此法具有取样量少、操作简单、分析时间短、灵敏度和准确度高等优点.
1 材料与方法
1.1 药品与试剂
氯化亚汞(质量分数为99.5%),二水合硝酸亚汞(质量分数≥97%),醋酸汞(质量分数为98.0%),均为CAS 级,美国Sigma-Aldrich 公司产品;硝酸,优级纯;体积分数为30%过氧化氢,氢氧化钾和硼氢化钾均为分析纯;氩气,体积分数>99.99%;试验所用玻璃器皿均经过体积分数为40%硝酸浸泡过夜后洗净晾干待用.
猪肉、猪肝脏和鸡肉空白样品由农业部畜禽产品质量监督检验测试中心(广州)提供;猪肾脏由市场上所购.
1.2 试验仪器
双道原子荧光光度计(AFS-9130),北京吉天仪器有限公司生产;微波消解仪(ETHOS),意大利Milestone 公司生产;电子分析天平,感量0.000 01~0.001 00 g;超纯水机,美国Millipole 公司产品.
1.3 试液配制
1.3.1 标准储备液 3 种汞制剂均配制成1 g/L 的标准储备液,用体积分数为5%盐酸溶解并定容.其中氯化亚汞需先加入适量的王水溶解,再用体积分数为5%盐酸定容.此3 种溶液每毫升含1 mg 汞.
1.3.2 标准使用液 氯化亚汞标准使用溶液:用移液管吸取1 mL 氯化亚汞标准储备液(1 g/L)于100 mL 容量瓶中,用体积分数为5%盐酸溶液稀释至刻度,混匀,此溶液质量浓度为10 mg/mL.再吸取10 mg/mL 氯化亚汞标准溶液1 mL 于100 mL 容量瓶中,用体积分数为5%盐酸稀释至刻度,混匀,此溶液质量浓度为100 μg/L,用于制作标准曲线.硝酸亚汞和醋酸汞标准使用溶液的处理过程同氯化亚汞.
1.3.3 载流液与还原剂 载流液(体积分数为5%盐酸溶液):量取50 mL 浓盐酸,与950 mL 的超纯水,混匀备用.
还原剂(10 g/L 硼氢化钾+5 g/L 氢氧化钾):称取10.0 g 硼氢化钾溶于1 L 氢氧化钾溶液(5 g/L)中,混匀,现配现用.
1.4 样品处理方法
准确称取约(0.2±0.002)g 匀质解冻肉类样品,置于干燥洁净的聚四氟乙烯消解罐中,加入6 mL HNO3,平衡10 min 后再加入2 mL H2O2,装入微波消解控制系统,开启升温程序.加热消解完毕后降至室温,消解液为澄清透明无色或略呈淡黄色.用超纯水转入50 mL 比色管中并定容至刻度,摇匀待测.同时设平行空白试样3 份.
1.5 仪器检测条件
以体积分数为5%盐酸作载液,高纯氩气作载气和屏蔽气,10 g/L 硼氢化钾为还原剂.仪器测量参数:灯电流30 mA、光电倍增管负高压270 V、原子化器高度10 mm、载气流量400 mL/min、屏蔽气流量800 mL/min.测量方式为标准曲线法,读数方式为峰面积.
预热稳定2 h,待标准空白读数稳定后进行测定.得到试样荧光强度(If),按标准曲线回归方程求出试样空白液和样品液中总汞质量浓度.
2 结果
2.1 线性范围
我国食品中污染物限量标准(GB 2762—2005)规定肉类食品中总汞限量(MRLs,以Hg 计)为0.05 mg/kg.按照“1.4”处理方法,汞质量浓度不超过0.2 μg/L,配制0.05、0.10、0.20、0.50、1.00 和2.00 μg/L线性范围曲线方程,r≥0.9990,线性良好.
2.2 回收率与变异系数
准确称取(0.2±0.002)g 匀质解冻肉类样品,按“1.4”和“1.5”方法处理和测定,在其1/2 残留限量、残留限量和5 倍残留限量3 个水平进行低、中、高添加回收试验,每质量浓度5 批次,每批次5 个平行.用3 种汞标准溶液配制出低(25 μg/kg)、中(50 μg/kg)和高(250 μg/kg)3 个系列质量分数进行空白添加和上机检测.添加3 种汞制剂在动物源性组织中总汞的回收率见表1~3.
2.3 精密度、检测限与定量限
取3 种汞标液的标准曲线上最大质量浓度点不间断重复测定15 次,取最后11 次测定值计算其相对标准偏差(RSD),即精密度;对标准空白溶液连续测定15 次,取其后连续11 次求得标准偏差(SD),其3 倍标准偏差(SD)除以标准曲线的斜率(K),即3×SD/K,得到检出限;以其10 倍的SD/K,即10×SD/K为定量限,由取样量和检出限计算此方法的样品最低检出质量浓度,见表4.
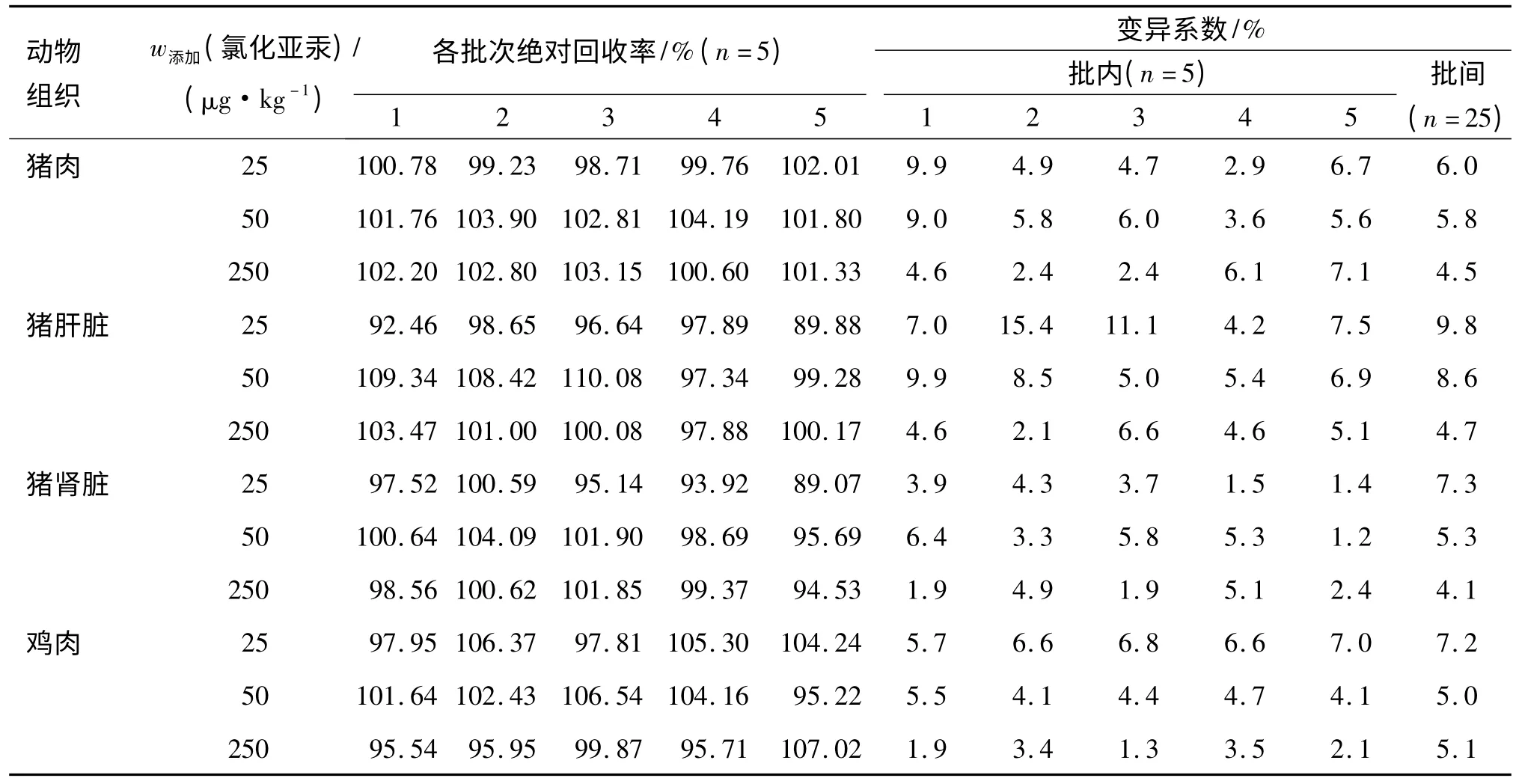
表1 空白动物源性食品中添加氯化亚汞的绝对回收率和变异系数Tab.1 The recovery and RSD of added mercurous chloride in blank animal derived food
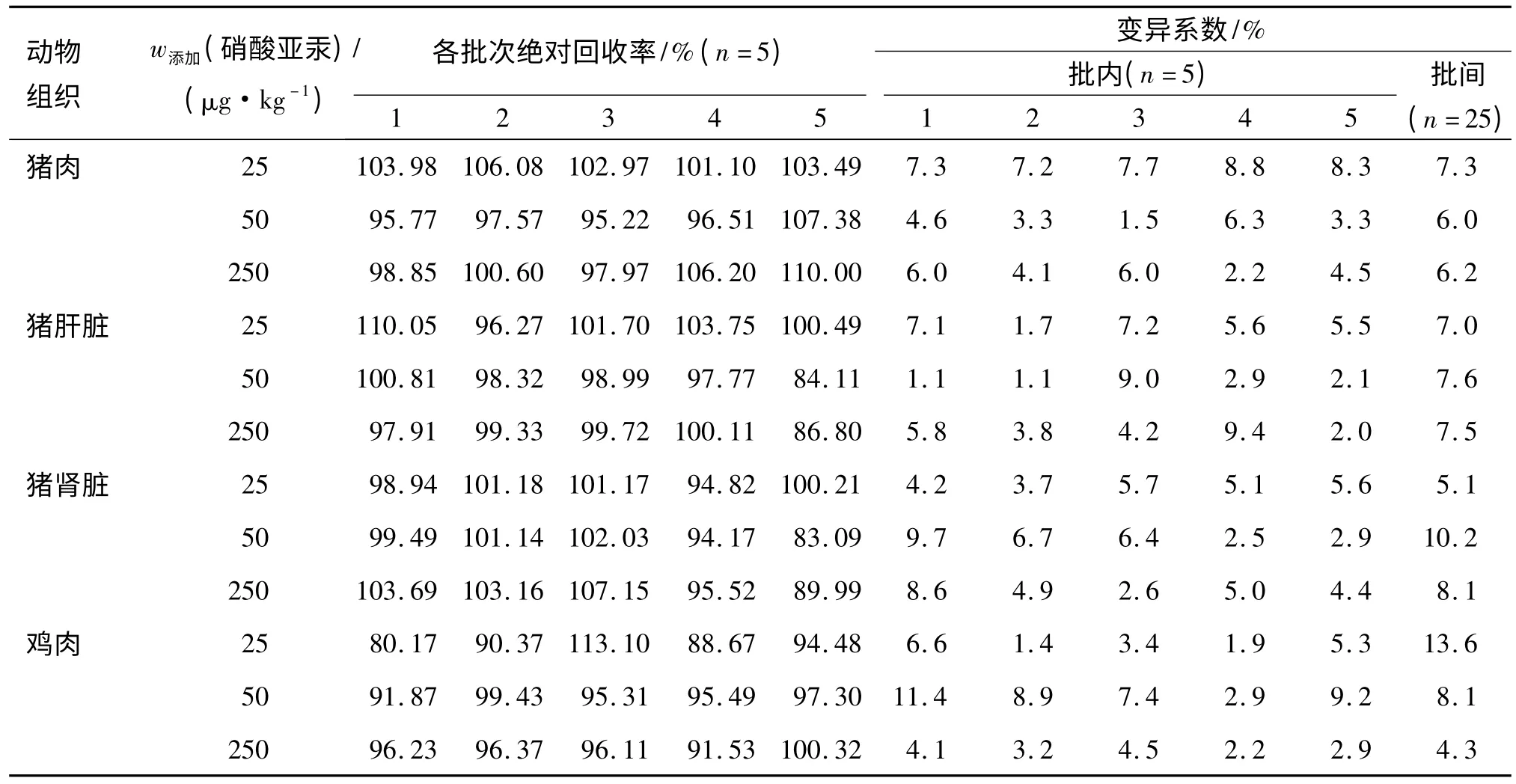
表2 空白动物源性食品中添加硝酸亚汞的绝对回收率和变异系数Tab.2 The recovery and RSD of added mercurous nitrate in blank animal derived food
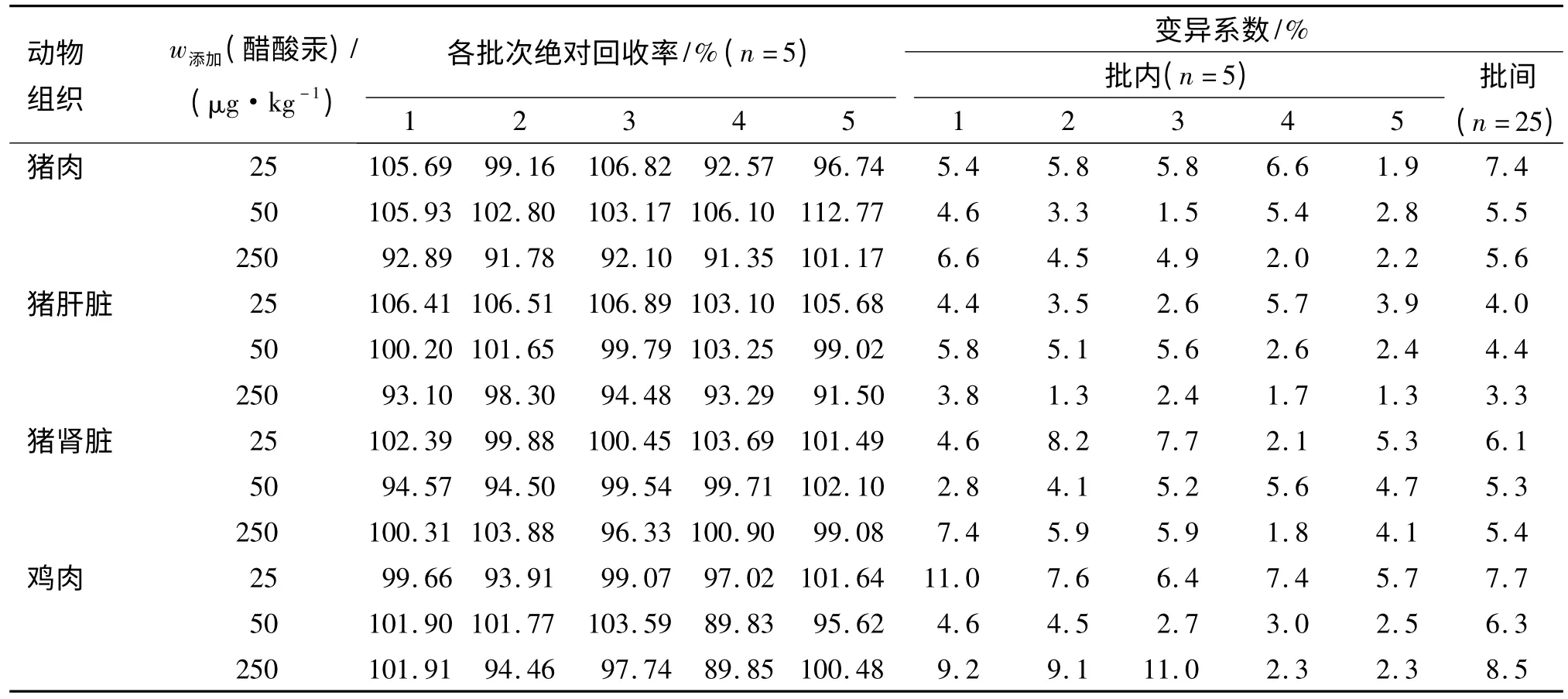
表3 空白动物源性食品中添加醋酸汞的绝对回收率和变异系数Tab.3 The recovery and RSD of added mercuric acetate in blank animal derived food
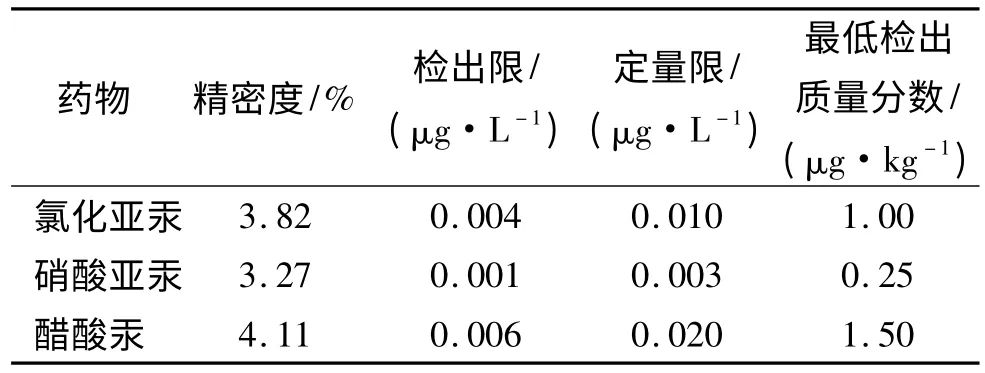
表4 3 种汞制剂的精密度、检出限、定量限和样品最低检出质量分数Tab.4 The relative standard deviation,the limit of detection,limit of quantification and the minimum detectable concentration of three drugs
3 讨论与结论
3.1 样品处理方法选择
采用微波消解肉制品时,应用HNO3-H2O2消解体系[19-23],H2O2是一种弱酸性氧化剂,在较低温度下能分解高能态活性氧,与HNO3共用可大幅度提高氧化能力,降低氮氧化物的产生.本试验确定采用HNO3-H2O2[V(HNO3)∶V(H2O2)=3∶1]对样品消解.当用湿法消解时,孙引等[3]采用HNO3-HCLO4[V(HNO3)∶V(HCLO4)=4∶1]体系消解鸡肉.
3.2 检测条件
原子荧光光度计工作的参数选择上,空心阴极灯电流、光电倍增管负高压(PMT)、载气和屏蔽气流量选用仪器默认参数即可满足试验的灵敏度要求.选用的这些参数分别是30 mA、270 V,载气流量为400 mL/min,屏蔽气流量为800 mL/min.在原子化器参数的选择上,原子化器高度与待测元素的原子化率即荧光强度有关,适当的炉高有助于保持较高的灵敏度,过高或过低会导致灵敏度和测定精度的下降和空白信号增高.测汞时产生的是汞蒸汽,而非类似砷、铅等生成气态金属氢化物,基于这点特殊性,本试验中选择原子化器高度为10 mm.读数时间与延迟时间[20]条件选择,不同元素氢化反应,产生的蒸汽发生速度及不同浓度所形成峰的时间,都会对读数时间的设置有影响.不同元素反应速度不同,延迟时间也不同.一般为注入时间>读数时间+ 延迟时间(一般大于2~3 s).本法选择读数时间13 s、延迟时间0.5 s,出峰完整,峰形最好.
3.3 氢化物发生条件的选择
应用原子荧光光度计测定食品中总汞时,对酸度允许较宽,盐酸体积分数在1.5%~10.0%范围内均可[25].同时考虑到盐酸对仪器管路及测定系统的腐蚀性,本试验选用盐酸体积分数为5%.硼氢化钾作为反应体系挥发性物质发生的还原剂,质量浓度的高低对汞荧光强度影响较大,影响汞原子蒸汽的生成效率和氢氩火焰的质量,从而直接影响方法的灵敏度和稳定性,同时也是区别冷原子荧光法和一般原子荧光法(热汞法).冷原子荧光法所需的硼氢化钾的质量浓度极低,童俊[8]用的0.5 g/L 硼氢化钾和1.0 g/L 氢氧化钾作为还原体系,而热汞法一般用硼氢化钾的质量浓度范围是10~20 g/L[9-10,15,19,26].又因硼氢化钾水溶液极不稳定,加入氢氧化钾可以提高稳定性.故本试验中选择10 g/L 硼氢化钾和5 g/L 氢氧化钾作为还原体系.
综上所述,在测定动物性食品中的总汞残留量时,相比湿法消解处理冷汞法测定,采用微波消解处理和氢化物发生-原子荧光光谱法测定总汞残留量,具有样品量少、操作简单快速、灵敏度和准确度高等优点.
本方法的建立可作为氯化亚汞、硝酸亚汞和醋酸汞这3 种汞制剂在动物性食品中总汞残留量测定的依据.
[1]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009 17—2003 食品中总汞及有机汞的测定[S].北京:中华人民共和国卫生部,中国国家标准化管理委员会,2003.
[2]郑礼胜,王士龙,安红.双硫腙水相分光光度法测定废水中汞[J].环境监测管理与技术,1996,8(3):32-33.
[3]孙引,郑建明.原子荧光法检测鸡肉中铅、砷、汞[J].广州化工,2011,39(6):117-119.
[4]王安俊,郎春燕.微波消解冷原子荧光法测定市售猪肉中的痕量汞[J].广东微量元素科学,2005,12(12):44-46.
[5]魏中文.利用冷原子吸收法在原子吸收分光光度计上测定水样汞[J].云南环境科学,2004,23(51):204-205.
[6]唐莲仙,丁亚明.冷原子荧光光谱法测定化妆品中汞[J].中国测试技术,2007,33(1):133-135.
[7]杨秀琳.原子荧光光谱法测定水中的痕量砷、硒、汞[J].化学分析计量,2004,13(1):32-34.
[8]童俊,臧道德.双道原子荧光光谱法测定水中痕量Hg、As、Se、Sb[J].净水技术,2004,23(6):27-29.
[9]乔凌霞.原子荧光法同时测定砷、汞混合水样[J].医学动物防制,2010,26(3):288-290.
[10]陆文娟.顺序注射氢化物发生原子荧光光度法测定水中As、Se、Sb、Hg[J].现代仪器,2007,13(6):81-82.
[11]栗云霞,李伟国,陆安祥,等.原子荧光光谱法同时测定土壤中的砷和汞[J].安徽农业科学,2009,37(12):5344-5346.
[12]董大鹏.氢化物发生原子荧光光谱法测定土壤中的汞[J].广州化工,2009,37(8):176-178.
[13]李艳.氢化物发生-原子荧光光谱法测定土壤中的汞[J].光谱实验室,2004,21(4):831-832.
[14]耿勇超,王建滨,付艳慧.微波消解-原子荧光光度法测定土壤中汞[J].江苏环境科技,2008,21(增刊1):58-59.
[15]刘双德.双道原子荧光光度计同时测定化妆品中砷和汞[J].现代预防医学,2010,37(7):1336-1337.
[16]李红芸,田海燕,李明艳.氢化物原子荧光分光光度法测定化妆品中微量汞[J].中国卫生检验杂志,2009,19(4):804-805.
[17]刘裕婷,朱力.原子荧光光谱法同时测定食品中汞和锡[J].中国卫生检验杂志,2008,18(7):1308-1309.
[18]蔡秋.氢化物原子荧光光谱法测定水产品中的痕量汞[J].光谱实验室,2003,20(1):98-101.
[19]鲍华.氢化物原子荧光光度法同时测定食品中砷和汞[J].河南预防医学杂志,2008,19(1):22-23.
[20]王颖.氢化物原子荧光光度法测定食品中汞的探讨[J].中国卫生检验杂志,2010,20(10):2632-2633.
[21]陈彩燕,梁群珍,林坤立.微波消解-氢化物发生-原子荧光法测定肉及肉制品中汞[J].中国卫生检验杂志,2010,20(5):1021-1022.
[22]徐燕.微波消解-氢化物发生原子荧光光度法测定食品中的砷和汞[J].预防医学论坛,2008,14(1):47-48.
[23]王铁良,司敬沛,张玲,等.微波消解-原子荧光光谱法快速测定食品中汞和砷的方法研究[J].河南农业科学,2010(2):128-131.
[24]方兰云,王立.微波消解-原子荧光光谱法测定大米中的痕量汞[J].中国卫生检验杂志,2010,20(3):519-521.
[25]刘雨.氢化物发生-原子荧光法同时测定砷和硒、铬和汞的研究及应用[D].济南:山东大学,2010.
[26]刘铭,刘凤枝,蔡彦明.土壤中总汞砷铅的氢化物发生-原子荧光法的研究[J].农业环境与发展,2004,21(6):42-44.
