黑曲霉分泌表达载体的构建以及绿色荧光蛋白的表达
2013-08-29郑红玉黄毓茂余希尧钟泽民项林盛唐丽云
郑红玉,黄毓茂,余希尧,钟泽民,项林盛,唐丽云
(华南农业大学 兽医学院,广东 广州 510642)
丝状真菌在自然界的土壤、有机废物、动植物细胞中普遍存在,这类真菌能够分泌大量不同种类的代谢产物和酶类,使其可以充分利用周围的有机成分作为营养物质,高效完成自身生命过程[1-2].随着分子生物学技术的快速发展,越来越多的丝状真菌作为表达宿主用于生产外源蛋白[3-4].包括黑曲霉在内的多种丝状真菌,就是由于具有极强的活性蛋白分泌能力以及蛋白质翻译后加工能力,成为工业化生产过程中极具吸引力的代表[5-6].通过各种条件的优化,黑曲霉自身糖化酶产量甚至达到了30 g/L[7].
作为表达宿主,虽然丝状真菌已经成功表达多种外源蛋白,但是大部分非真菌蛋白的产量还远远达不到工业化生产的要求[8].研究者已经采用了多种方法来提高异源蛋白的产量,包括使用强启动子[9]、增加目的基因的拷贝数[10-11]、密码子优化[12]、融合策略[13]、应用蛋白酶缺陷菌株、引入内含子[14]、引入糖基化相关基因、优化发酵条件[15-17]等.本试验采用强启动子PglaA,应用融合策略成功构建了黑曲霉表达载体,实现了增强型绿色荧光蛋白的表达,验证了表达系统的正确性,同时清晰地观察到了蛋白在菌丝水平的分泌特点,为其他目的基因在黑曲霉中的表达奠定了基础.
1 材料与方法
1.1 试验材料
黑曲霉糖化酶生产菌株,购自中国工业微生物菌种保藏管理中心;大肠埃希菌DH5α 购自广州佰思公司;质粒sGFP 和pEN51 由华南农业大学兽医学院传染病教研室保存,sGFP 含有潮霉素抗性基因和色氨酸基因终止子,pEN51 含有EGFP 基因;rTaq DNA 聚合酶,LA Taq DNA 聚合酶,限制性内切酶EcoRⅠ、AvrⅡ、XhoⅠ、AflⅡ、HindⅢ、SpeⅠ、ApaⅠ、NotⅠ,T4 DNA 连接酶,pUC19 质粒,pMD-18 T 载体,DNA Marker 为大连宝生物工程公司(TaKaRa)产品;质粒提取试剂盒,DNA 胶回收试剂盒,DNA 纯化试剂盒为Omiga 公司产品;潮霉素B、氨苄青霉素为广州鼎国公司产品.
1.2 试验方法
1.2.1 PCR 引物的设计与序列扩增 从GeneBank中分别查找黑曲霉糖化酶基因启动子(PglaA X00712),色氨酸基因终止子序列(TtrpC),糖化酶基因序列,增强型绿色荧光蛋白序列(EGFP).根据序列信息,设计引物扩增TtrpC、EGFP 和PglaA-g(糖化酶启动子和糖化酶前498 个氨基酸基因);其中PglaA-g 基因中含有糖化酶基因信号肽序列和KEX2 多肽酶切割位点.同时,根据质粒sGFP 的序列信息,设计引物扩增潮霉素抗性基因(PHT).所设计引物都含有不同的酶切位点,用于各个片段的连接,其中PglaA-g 下游引物中含有4 个酶切位点XhoⅠ、NotⅠ、ApaⅠ和SpeⅠ,作为多克隆位点,用于引入目的基因.另外,设计检测引物用于转化后黑曲霉阳性转化子的鉴定,上游引物位于糖化酶基因中,下游引物位于EGFP 基因中,以阳性转化子基因组为模板可以扩增到1 700 bp 左右的片段.以上设计的全部引物序列见表1.

表1 PCR 引物设计Tab.1 Design of PCR primers
1.2.2 EGFP 分泌表达载体的构建 将TtrpC 的PCR 产物通过EcoRⅠ、HindⅢ双酶切与质粒pUC19连接,得到中间质粒pUC19-TtrpC;pUC19-TtrpC 与PglaA-g 通过AvrⅡ、XhoⅠ双酶切后连接,获得质粒pUC19-PglaA-g-TtrpC;pUC19-PglaA-g-TtrpC 再与PHT的PCR 产物通过AflⅡ、HindⅢ双酶切连接,得到骨架质粒pPHT;将EGFP 基因质粒通过SpeⅠ、XhoⅠ双酶切与质粒pPHT 连接,最终得到黑曲霉表达载体pPHT-EGFP,载体质粒构建过程如图1 所示.
1.2.3 表达质粒转化黑曲霉 接种黑曲霉孢子于马铃薯葡萄糖液体培养基中(使孢子浓度达到106mL-1),振荡培养(30℃,150 r/min)14 h,用混合酶解液(在5 mL 高渗溶液中加入0.05 g 溶壁酶、0.05 g 蜗牛酶、0.025 g 溶菌酶,充分溶解后,离心,过滤除菌)悬浮适量菌丝,振荡酶解(34℃、100 r/min)3 h,当大量原生质体生成时,用过滤器过滤收集原生质体,然后用聚乙二醇/氯化钙方法进行外源DNA 的转化试验.
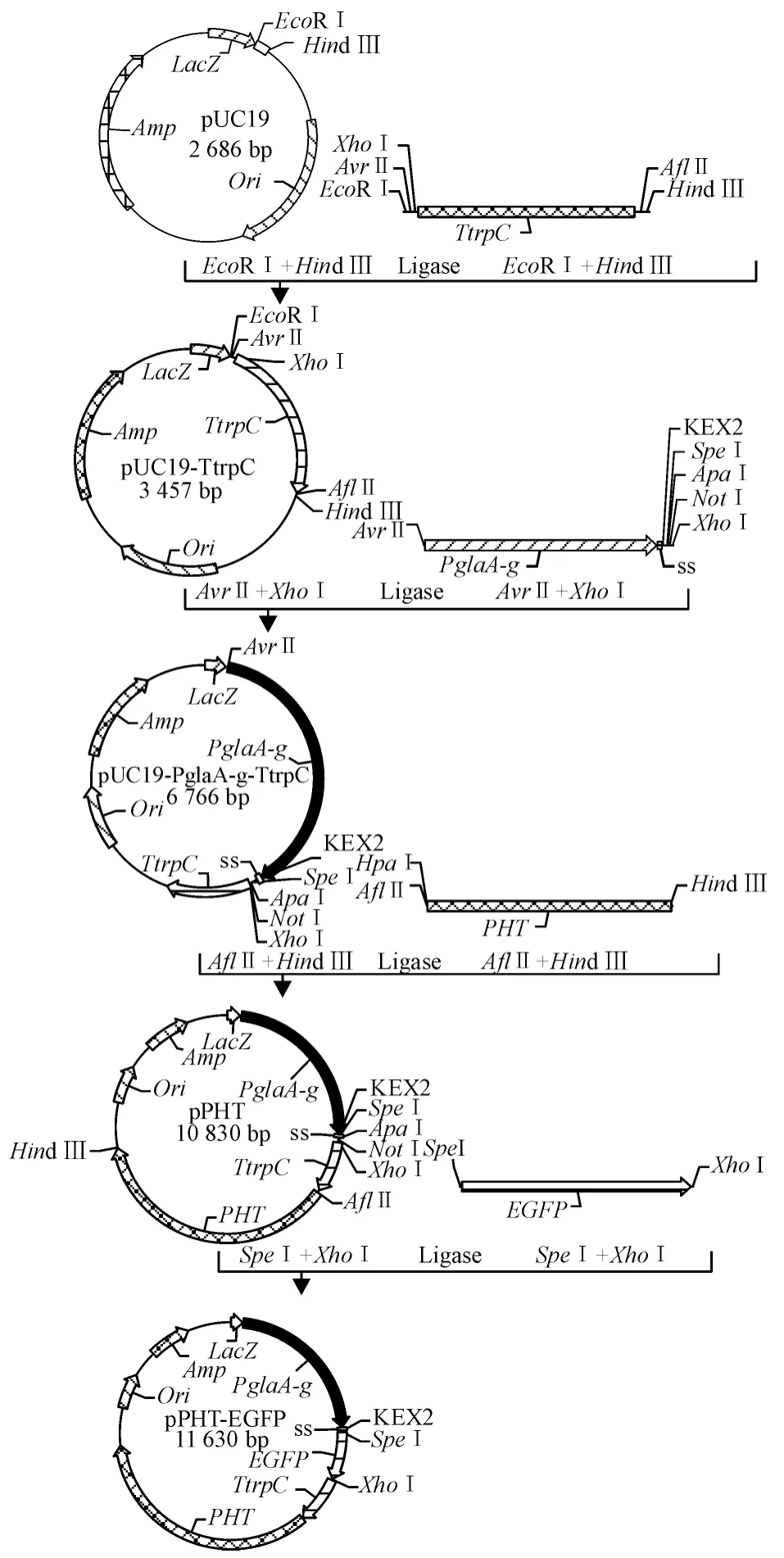
图1 黑曲霉分泌表达载体pPHT-EGFP 的构建(PHT:PgpdA-HygR-TtrpC)Fig.1 Construction of secretory expression vector of Aspergillus niger pPHT-EGFP
1.2.4 阳性转化子的筛选和鉴定 将100 μL 上述转化液涂布于再生培养基(再生培养基:麦芽糖5 g,酵母膏5 g,葡萄糖10 g,琼脂粉15 g,ddH2O 1 L,蔗糖0.8 mol/L,潮霉素0.1 g/L),30℃培养3~4 d.将在抗性平板上长出的转化子转移到PDA 抗性平板上(含有0.1 g/L 潮霉素)继续培养.提取单个转化子的基因组,PCR 鉴定.将PCR 鉴定为阳性的转化子孢子培养2 d(不加葡萄糖的PDA 培养基),荧光显微镜紫外线下观察菌丝形态.
1.2.5 菌丝的培养 采用载片培养法(图2):取圆形滤纸1 张,铺放于1 个玻璃平皿底部,上面放一U形玻棒,其上再平放1 张干净的载玻片与1 张盖玻片,盖好平皿盖进行灭菌.将1 cm2左右的较薄的原生质体再生固体培养基放于载玻片中央,用接种环接种孢子,加上盖玻片,并轻轻下压.为防止培养过程中培养基干燥,在培养皿中加入7~8 mL 灭菌的甘油(20 g 甘油溶于一定体积水中使总体积达到100 mL),然后盖上平皿盖,30℃条件下培养,2 d 后在荧光显微镜下观察.
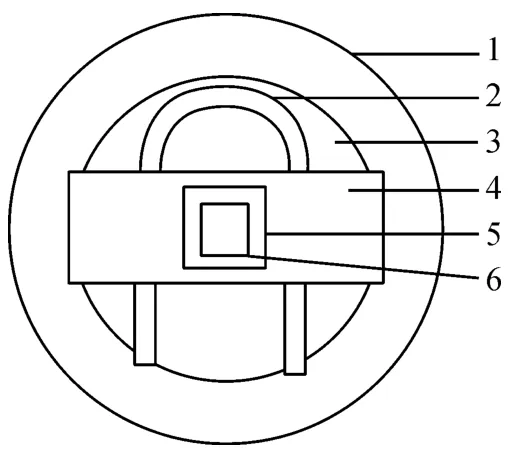
图2 真菌载片培养法Fig.2 Slide culture of fungi
2 结果与分析
2.1 黑曲霉基因组DNA 的提取
接种黑曲霉孢子于铺有玻璃纸的PDA 培养基,30℃培养18 h,孢子再次长出之前,收集玻璃纸上的白色菌丝体,CTAB 法提取基因组DNA,基因组提取结果如图3 所示,可以看到大于10 kb 的条带.

图3 黑曲霉基因组电泳检测Fig.3 Electrophoresis analysis of Aspergillus nigerr genome
2.2 TtrpC、PglaA-g、PHT 和EGFP 基因的克隆
以质粒sGFP 为模板,扩增得到约800 bp 的TtrpC 基因,结果如图4;以黑曲霉基因组DNA 为模板扩增到约2 700 bp 的PglaA-g 基因,结果如图5;以质粒pEN51 为模板,PCR 扩增得到约800 bp 的EGFP 基因,结果如图6;以质粒sGFP 为模板扩增得到约4 000 bp的PHT 基因,PCR 扩增结果如图7.

图4 TtrpC 扩增结果Fig.4 PCR result of TtrpC
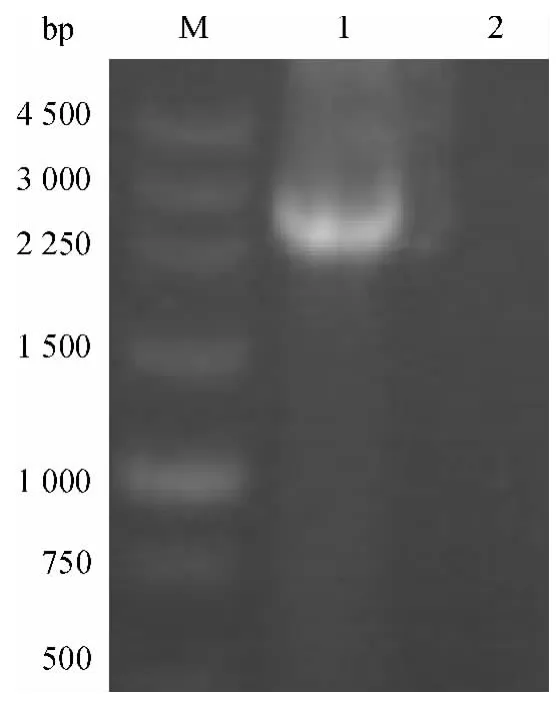
图5 PglaA-g 扩增结果Fig.5 PCR result of PglaA-g

图6 EGFP 扩增结果Fig.6 PCR result of EGFP

图7 HygR 抗性筛选标记扩增结果Fig.7 PCR result of HygR gene
对PglaA-g 基因进行测序,测序结果与Gene-Bank 登录号为X00712 的糖化酶基因序列对比,Blast 分析显示基因序列相似性为99%,图8 所示为测序结果中部分糖化酶基因启动子、信号肽以及KEX2 多肽酶切割位点序列.

图8 启动子、信号肽以及KEX2 多肽酶切割位点序列Fig.8 Sequences of promotor,signal peptide and KEX2
2.3 pPHT-EGFP 表达载体的双酶切鉴定
通过双酶切、连接的方法,依次将TtrpC、PglaAg、PHT、EGFP 与pUC19 质粒连接,构建pPHT-EGFP表达载体.将构建好的表达载体用SpeⅠ、XhoⅠ双酶切鉴定,酶切结果如图9 所示,切出约11 000 bp的pPHT 载体片段和约800 bp 大小的EGFP 基因片段,表明pPHT-EGFP 表达载体构建成功.
2.4 转化子的PCR 鉴定
原生质体转化后,按照CTAB 法提取转化子的基因组,并以基因组为模板采用表1 中的检测引物进行PCR 检测,结果如图10 所示,挑取的4 株转化子基因组PCR 均得到约1 700 bp 大小的条带,表明4 株转化子全部为阳性转化子,表达质粒已经成功转化入宿主菌.

图9 pPHT-EGFP 质粒双酶切鉴定Fig.9 Identification of restriction enzyme digestion of pPHTEGFP
2.5 绿色荧光的观察
将阳性转化子的孢子接种于PDA 固体培养基中(不加葡萄糖),2 d 后于荧光显微镜下观察菌丝形态.

图10 阳性转化子鉴定结果Fig.10 Identification of positive transformants
当荧光显微镜激发出紫外光时,可以看到整个培养基都发出强烈的绿光,看不到菌丝,而培养基之外的区域可以清晰地观察到单个菌丝的形态和荧光分布(图11a),只有绿色荧光蛋白分泌到胞外培养基中,培养基自身才可观察到绿色荧光,所以本试验所构建的载体属于分泌性表达载体,由于糖化酶是黑曲霉自身的一种分泌性蛋白,所以糖化酶基因的信号肽序列(ss)有效地辅助了EGFP 的分泌过程;菌丝水平上,菌丝的横膈处可以清晰地观察到荧光聚集(图11b),菌丝胞质中基本看不到亮光,菌丝顶端也可以看到明显聚集的荧光(图11c),这些荧光聚集的部位暗示了蛋白的分泌部位,表明蛋白的分泌可能存在于菌丝的顶端和横隔等处.

图11 阳性转化子绿色荧光的观察Fig.11 Observation of green fluorescence of positive transformants
3 讨论与结论
黑曲霉是一种拥有巨大蛋白分泌潜力的微生物,长期以来一直被认为是安全的工业生产菌株,而且与酵母表达系统相比,黑曲霉具有更高级的蛋白修饰和加工系统.迄今为止已经有大量蛋白在黑曲霉细胞工厂中成功表达,如全长免疫球蛋白的成功表达,其在亲和力、药动学等方面的特性与从哺乳动物细胞中获得的产物极为相似[18];棘孢曲霉β-甘露聚糖酶在黑曲霉中的高效表达,其表达量达到了自身产量的12 倍[19];而IL-6 在黑曲霉蛋白缺陷菌株中的表达量可以达到150 mg/L[7].由于黑曲霉广阔的应用前景,进一步研究这一表达系统并且用于各种蛋白的表达,成为一个研究的新方向.
本试验采用融合表达策略[20],成功构建黑曲霉EGFP 表达载体,在启动子下游融合了部分糖化酶基因用于提高表达量,而且引入糖化酶基因自身的信号肽序列用于目的蛋白的分泌性表达[21-22];同时,还引入黑曲霉KEX2 多肽酶切割位点用于融合蛋白与目的蛋白的分离[23];通过在引物中加入限制性酶切位点,在载体中引入用于连接外源目的基因的多克隆位点(SpeⅠ-ApaⅠ-NotⅠ-XhoⅠ).与以往转化试验效率较低不同,本试验成功摸索出高效的黑曲霉原生质体转化方法,所挑取的4 个转化子经过PCR 鉴定,全部为阳性.菌丝顶端是丝状真菌最主要的分泌部位,菌体中合成的大部分分泌性蛋白都要通过膈膜上的小孔运输到菌丝顶端,在这里实现胞外分泌[24],本试验通过EGFP 的成功表达,清楚地观察到黑曲霉的分泌特点,表达产物主要集中在培养基、菌丝顶端和菌丝膈膜等处.结果表明,在糖化酶信号肽和分泌性囊泡的辅助下,菌丝不同部位所表达的EGFP 通过膈膜向菌丝顶端聚集并完成分泌,在通过膈膜的过程中,一部分蛋白可能会滞留在膈膜上,形成膈膜上聚集的荧光.EGFP 的成功表达证实了该黑曲霉菌株作为外源蛋白生产宿主的可行性,为外源蛋白在黑曲霉中的表达奠定了坚实的基础.
[1]WARD O P.Production of recombinant proteins by filamentous fungi[J].Biotechnol Adv,2012,30(5):1119-1139.
[2]LUBERTOZZI D,KEASLING J D.Developing Aspergillus as a host for heterologous expression[J].Biotechnol Adv,2009,27(1):53-75.
[3]DEMAIN A L,VAISHNAV P.Production of recombinant proteins by microbes and higher organisms[J].Biotechnol Adv,2009,27(3):297-306.
[4]NEVALAINEN K M,TE'O V S,BERGQUIST P L.Heterologous protein expression in filamentous fungi[J].Trends Biotechnol,2005,23(9):468-474.
[5]GOUKA R J,PUNT P J,VAN DEN HONDEL C A.Efficient production of secreted proteins by Aspergillus:Progress,limitations and prospects[J].Appl Microbiol Biotechnol,1997,47(1):1-11.
[6]GOUKA R J,PUNT P J,HESSING J G,et al.Analysis of heterologous protein production in defined recombinant Aspergillus awamori strains[J].Appl Environ Microbiol,1996,62(6):1951-1957.
[7]PUNT P J,VAN BIEZEN N,CONESA A,et al.Filamentous fungi as cell factories for heterologous protein production[J].Trends Biotechnol,2002,20(5):200-206.
[8]SHARMA R,KATOCH M,SRIVASTAVA P S,et al.Approaches for refining heterologous protein production in filamentous fungi[J].World J Microbiol Biotechnol,2009,25(12):2083-2094.
[9]WANG Liping,RIDGWAY D,GU Tingyue,et al.Bioprocessing strategies to improve heterologous protein production in filamentous fungal fermentations[J].Biotechnol Adv,2005,23(2):115-129.
[10]LOMBRANA M,MORALEJO F J,PINTO R,et al.Modulation of Aspergillus awamori thaumatin secretion by modification of bipA gene expression[J].Appl Environ Microbiol,2004,70(9):5145-5152.
[11]VERDOSE J C,PUNT P J,STOUTHAMER A H,et al.The effect of multiple copies of the upstream region on expression of the Aspergillus niger glucoamylase-encoding gene[J].Gene,1994,145(2):179-187.
[12]TE'O V S,CZIFERSZKY A E,BERGQUIST P L,et al.Codon optimization of xylanase gene xynB from the thermophilic bacterium Dictyoglomus thermophilum for expression in the filamentous fungus Trichoderma reesei[J].FEMS Microbiol Lett,2000,190(1):13-19.
[13]FOWLER T,BERKA R M.Gene expression systems for filamentous fungi[J].Curr Opin Biotechnol,1991,2(5):691-697.
[14]HOEGENHAUG H K,SCHNORR K M,HANSEN M T.Expression of defensins in filamentous fungi:USA,US2006211089Al[P].2006-09-21.http:112.81.110.101/world/Fulltext/US2006211089Al.
[15]LU Xin,SUN Jibin,NIMTZ M,et al.The intra-and extracellular proteome of Aspergillus niger growing on defined medium with xylose or maltose as carbon substrate[J].Microb Cell Fact,2010,9:23.
[16]POLLACK J K,HARRIS S D,MARTEN M R.Autophagy in filamentous fungi[J].Fungal Genet Biol,2009,46(1):1-8.
[17]JARAI G,BUXTON F.Nitrogen,carbon,and pH regulation of extracellular acidic proteases of Aspergillus niger[J].Curr Genet,1994,26(3):238-244.
[18]WARD M,LIN C,VICTORIA D C,et al.Characterization of humanized antibodies secreted by Aspergillus niger[J].Appl Environ Microbiol,2004,70(5):2567-2576.
[19]VAN ZYL P J,MOODLEY V,ROSE S H,et al.Production of the Aspergillus aculeatus endo-1,4-beta-mannanase in A.niger[J].J Ind Microbiol Biotechnol,2009,36(4):611-617.
[20]MIKOSCH T,KLEMM P,GASSEN H G,et al.Secretion of active human mucus proteinase inhibitor by Aspergillus niger after KEX2-like processing of a glucoamylase-inhibitor fusion protein[J].J Biotechnol,1996,52(2):97-106.
[21]JALVING R,VAN DE VONDERVOORT P J,VISSER J,et al.Characterization of the Kexin-like maturase of Aspergillus niger[J].Appl Environ Microbiol,2000,66(1):363-368.
[22]VON HEIJNEG.The signal peptide[J].J Membr Biol,1990,115(3):195-201.
[23]PUNT P J,DRINT-KUIJVENHOVEN A,LOKMAN B C,et al.The role of the Aspergillus niger furin-type protease gene in processing of fungal proproteins and fusion proteins:Evidence for alternative processing of recombinant(fusion-)proteins[J].J Biotechnol,2003,106(1):23-32.
[24]TAHERI-TALESH N,HORIO T,ARAUJO-BAZ A N L,et al.The tip growth apparatus of Aspergillus nidulans[J].Mol Biol Cell,2008,19(4):1439-1449.
