癌蛋白HBXIP对卵巢癌细胞增殖功能的影响
2013-08-28徐福强杨莹张晓东叶丽虹姚元庆
徐福强,杨莹,张晓东,叶丽虹,姚元庆
乙肝病毒X蛋白结合蛋白(hepatitis B X-interacting protein,HBXIP)是一种新发现的癌蛋白,由于它与乙肝病毒X蛋白结合而命名。研究发现HBXIP能与人体内多种蛋白结合,参与细胞凋亡与增殖﹑细胞周期进程﹑中心体复制﹑肿瘤细胞迁移等过程[1-4]。HBXIP是一个多功能的调节蛋白,可通过调节不同的转录因子影响基因表达[5-6]。HBXIP还参与mTORC1信号通路和氨基酸代谢[7]。但目前尚未见卵巢癌中HBXIP表达的相关研究。Skp2是一种重要的细胞增殖周期调节因子[8],在卵巢癌中高表达[9],最新研究表明HBXIP可以通过Skp2途径促进乳腺癌细胞的增殖[6]。本研究探讨HBXIP基因对卵巢癌细胞增殖功能的影响,以及可能的作用机制,旨在为HBXIP成为治疗靶点提供依据。
1 材料与方法
1.1 主要材料
1.1.1 真核表达载体与细胞株 真核表达载体pGL3-Basic,pCMV-Tag2B和pCMV-HBXIP由本室保存[10]。卵巢癌SKOV3细胞由南开大学医学院赵青博士惠赠。
1.1.2 引物设计 针对GenBank报道的Skp2启动子的基因片段(NC-000005.9)设计引物,5'端添加限制性内切酶Hind Ⅲ酶切位点,3'端添加Xho Ⅰ酶切位点。引物序列如下:正义链,5'-CGGGGTACCCCG TCCCTTCTTTACACCAATCTC-3';反义链,5'-CC GCTCGAGCGGCGTTTACCTGTGCATAGCG-3'。针对HBXIP的核酸序列(NM_006402)设计引物:正义链,5'-ATGGAGCCAGGTGCAGGTC-3';反义链,
5'-TGGAGGGATTCTTCATTGTG-3'。GAPDH作为内参,正义链,5'-CATCACCATCTTCCAGGAGCG-3';反义链,5'-TGACCTTGCCCACAGCCTTG-3'。引物由北京华大基因生物公司合成。
1.1.3 主要试剂 RPMI 1640培养基和胎牛血清购自Gibco公司;M-MLV反转录酶﹑Taq DNA聚合酶﹑T4DNA连接酶及限制性内切酶均为宝生物(大连)生物工程有限公司产品;Lipofectamine 2000购自Invitrogen公司;ECL Western blotting显色试剂盒购自Amersham Biosciences公司;MTT试剂﹑β-actin单克隆抗体及HBXIP多克隆抗体购自Sigma公司;Skp2多克隆抗体购自Boster公司;双荧光素酶测试试剂盒购自Promega公司。
1.2 方法
1.2.1 细胞培养 采用RPMI 1640培养基培养卵巢癌SKOV3细胞,培养基中含有10%胎牛血清,100U/ml青霉素和100μg/ml硫酸链霉素,在37℃孵箱5% CO2条件下培养。
1.2.2 反转录PCR 用Trizol法提取卵巢癌细胞系SKOV3的总RNA,通过M-MLV反转录酶合成cDNA第一链,以此为模板进行PCR反应,以超纯水作为对照。取PCR产物行琼脂糖凝胶电泳,溴化乙啶染色,紫外灯下观察结果并照相记录。实验均重复3次,Quantity One软件分析电泳条带灰度。
1.2.3 真核表达载体pGL3-Skp2启动子的构建构建真核表达载体pGL3-Skp2启动子,以卵巢癌SKOV3细胞基因组为模板,通过PCR方法扩增Skp2启动子区域,酶切后嵌入表达载体pGL3-Basic。转化到感受态细胞Trans5α中,通过氨西林抗性筛选阳性克隆,然后进行载体酶切和序列测定。
1.2.4 瞬时转染 真核表达载体pCMV-HBXIP质粒由本室构建[11]。将上述pCMV-HBXIP质粒瞬时转染SKOV3细胞作为实验组,pCMV-Tag2B载体转染SKOV3细胞为对照组,转染方法参照Lipofetamine 2000说明书,转染前24h将细胞传代,待细胞生长至60%~70%融合后进行转染,6h后更换为含10%胎牛血清的完全培养基。
1.2.5 平板克隆 将pCMV-HBXIP和pCMV-Tag2B质粒分别转染入卵巢癌细胞SKOV3,作为实验组和对照组,培养至对数生长期,分别计数后按每板500个细胞接种至6孔细胞培养板中。常规培养2周后行甲醇固定,亚甲基蓝染色,镜下计数细胞数多于50个的克隆数并照相记录。
1.2.6 MTT分析 胰酶消化生长至对数期的卵巢癌细胞[12],计数并调整细胞浓度为1×105个/ml,接种于96孔板,各孔细胞数约为1×103个。每组设6个平行孔,待细胞贴壁后分别转染pCMV-HBXIP及pCMV-Tag2B质粒,于37℃﹑5%CO2条件下培养箱中培养。分别在0﹑48h,加入20μl浓度为5g/L的MTT,继续培养4h,吸去孔内培养液,再加入150ml DMSO,室温振荡10min,用酶标仪(波长570nm)测定各孔的吸光度(A)值。
1.2.7 荧光素酶报告基因分析 为研究HBXIP促进卵巢癌细胞增殖的机制,我们克隆了Skp2启动子,并检测HBXIP对Skp2启动子活性的影响。将质粒pRL-TK﹑pGL3-Skp2及pCMV-HBXIP(或pCMVTag2B)共转染至SKOV3细胞中,以海肾荧光素酶表达载体pRL-TK为内参。转染48h后按照荧光素酶试剂盒说明测定光输出值。每组实验重复3次,以pCMV-Tag2B质粒为对照。
1.2.8 Western blotting检测 用预冷的PBS洗细胞2次,加入细胞裂解液(10mmol/L Tris-HCl﹑pH8.0﹑1mmol/L EDTA﹑150mmol/L NaCl﹑1mmol/L PMSF﹑1% NP-40﹑1% SDS﹑蛋白酶抑制剂)冰上放置20min,4℃ 15 000r/min离心20min,收集上清行定量分析。取30~40μg总蛋白行12% SDS-PAGE电泳,电转移至硝酸纤维素膜,5%脱脂奶粉封闭过夜,加入一抗,室温培育3h,PBST洗膜,再分别加入抗鼠﹑抗兔的IgG室温培育1h,PBST洗膜,应用增强型ECL显色试剂盒于暗室曝光显影,实验均重复3次,Quantity One软件分析蛋白灰度。
1.3 统计学处理 采用SPSS 17.0统计软件进行分析,数据以±s表示,组间比较采用Student's-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 HBXIP在卵巢癌细胞中的表达 PCR检测结果显示,对照组中未见GAPDH基因表达,与对照组相比,卵巢癌细胞SKOV3中可检测到GAPDH表达(99.33±3.21),差异有统计学意义(P<0.001)。同时在卵巢癌细胞SKOV3中也检测到HBXIP基因表达(100.33±4.73),而对照组中亦未检测到HBXIP基因的表达,差异有统计学意义(P<0.001,图1)。
2.2 HBXIP对卵巢癌细胞增殖的作用 平板克隆形成实验结果显示,与对照组(68.2±4.8)相比,实验组卵巢细胞形成克隆的数目(117.0±9.1)明显增加,差异有统计学意义(P<0.01,图2)。采用MTT法分别检测实验组和对照组细胞的生存率,结果表明,转染48h后,实验组卵巢癌细胞A值(0.287±0.030)显著高于对照组(0.227±0.024),差异有统计学意义(P<0.05)。
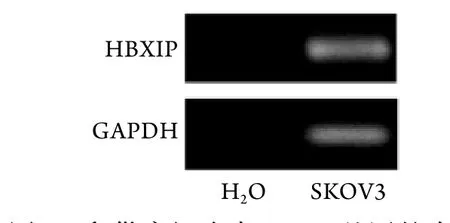
图1 卵巢癌细胞中HBXIP基因的表达Fig.1 Expression of HBXIP gene in ovarian cancer cells

图2 克隆形成数目比较Fig.2 Comparison of number of formed clones
2.3 HBXIP对Skp2启动子活性的作用 荧光素酶报告基因分析结果显示,与对照组(171.09±5.81)相比,实验组Skp2启动子活性(411.55±15.91)显著增加,差异有统计学意义(P<0.01)。
2.4 Western blott ing检测Skp2蛋白表达 采用Western blotting检测实验组和对照组细胞中HBXIP和Skp2蛋白的表达水平,结果显示,实验组卵巢癌细胞中HBXIP蛋白的灰度值(156.67±5.51)高于对照组(141.33±3.37),差异有统计学意义(P<0.05)。同时Skp2蛋白的灰度值(216.52±9.54)也随着HBXIP的过表达而升高,高于对照组中Skp2的表达(184.72±11.93),差异有统计学意义(P<0.05,图3)。

图3 HBXIP和Skp2蛋白的表达Fig.3 Expression of HBXIP and Skp2 protein in respective group
3 讨 论
HBXIP是一种细胞组成型表达蛋白,Melegari等[13]1998年首次于肝癌细胞株HepG2中克隆获得HBXIP,作为乙肝病毒编码的蛋白HBx的作用因子,并因此命名。HBXIP 基因定位于人染色体1p13.3,其开放阅读框基因编码全长173个氨基酸,分子量约为19kD。HBXIP与HBx的C末端结合后可下调HBx的活性,从而改变HBV的复制周期,同时抑制HBx对激活蛋白1(activating protein-1,AP-1)和内源性HBV启动子或增强子的反式激活作用,从而影响HBV的复制周期。研究发现HBXIP具有多种生物学功能,可与survivin和HBx形成复合物,并与pro-caspase-9结合,阻止其被凋亡酶激活因子Apaf-1招募,抑制线粒体或细胞色素C介导的凋亡途径[1]。HBXIP可以通过调节细胞周期蛋白,调节hTERT的表达水平,调控NF-κB信号途径而促进细胞增殖[2-4]。HBXIP还可以通过调节S100A4促进乳腺癌细胞的增殖和迁移[14]。这些结果提示HBXIP可通过多种途径和机制促进肿瘤的增殖和迁移。
为进一步阐明HBXIP对卵巢癌细胞的影响,本研究对HBXIP促进卵巢癌细胞的增殖作用以及Skp2在其中的机制进行了探讨。Skp2在多种恶性肿瘤中高表达,主要调节细胞从细胞周期的G1期进入到S期。Skp2的过表达促进了基因的复制和细胞增殖,与肿瘤的发生﹑浸润﹑转移及复发密切相关[15-17]。大量研究表明,Skp2的过表达与卵巢癌的发生密切相关,Inuzuka等[18]发现Skp2在SKOV3等细胞中表达。Shigemasa等[9]发现Skp2的表达对卵巢癌的进展和发展具有重要意义,Skp2的过度表达可作为卵巢癌患者独立的预后指标。Lu等[19]研究表明Skp2的表达水平与卵巢癌的临床分期和病理分级显著相关。最近研究表明,HBXIP可以结合Skp2启动子中的转录因子E2F1,激活Skp2启动子活性,同时上调Skp2的mRNA和蛋白表达,进而通过促进细胞周期进程来促进乳腺癌细胞的增殖[6]。但是,HBXIP在卵巢癌中是否也发挥同样的作用,有待于更深入的研究。
本研究首先通过PCR实验检测到HBXIP基因在卵巢癌细胞中表达,再通过平板克隆形成实验检测了卵巢癌SKOV3细胞的增殖能力,结果表明HBXIP可以促进卵巢癌细胞的增殖,并经MTT实验结果确认。荧光素酶报告基因检测结果显示,HBXIP的过表达具有促进Skp2启动子活性的作用。免疫印迹检测结果显示,在转染pCMV-HBXIP的卵巢癌细胞SKOV3中,HBXIP蛋白表达水平上升,表明pCMVHBXIP成功转染并表达,同时Skp2的蛋白水平也随着HBXIP的转染水平上升。提示卵巢癌中HBXIP可以激活Skp2启动子的活性,进而促进Skp2蛋白的表达。这与之前的研究结果相符合[6],上述结果提示HBXIP可提高Skp2启动子活性和蛋白表达,进而通过Skp2发挥促进卵巢癌细胞增殖的作用。
[1] Marusawa H, Matsuzawa S, Welsh K, et al. HBXIP functions as a cofactor of survivin in apoptosis suppression[J]. EMBO J, 2003,22(11): 2729-2740.
[2] Wang FZ, Sha L, Ye LH, et al. Promotion of cell proliferation by HBXIP via upregulation of human telomerase reverse transcriptase in human mesenchymal stem cells[J]. Acta Pharmacol Sin, 2008, 29(1): 83-89.
[3] Wang FZ, Sha L, Qiao L, et al. Promotion of transcriptional activity of NF-κB mediated by HBXIP in hepatoma cells[J].Prog Biochem Biophys, 2007, 34(11): 1197-1201. [王凤泽, 沙丽, 乔玲, 等. 乙肝病毒X 蛋白结合蛋白(HBXIP)增强肝癌细胞NF-κB 转录活性的实验研究[J]. 生物化学与生物物理进展, 2007, 34(11): 1197-1201.]
[4] Wang FZ, Wu LY, Qiao L, et al. Effect of hepatitis B virus X-interacting protein (HBXIP) on cell cycle[J]. Chin J Biochem Mol Biol, 2007, 23(06): 487-491. [王凤泽, 吴莲英, 乔玲, 等.乙型肝炎病毒X 蛋白结合蛋白(HBXIP)对细胞周期的影响[J]. 中国生物化学与分子生物学报, 2007, 23(06): 487-491.]
[5] Zhang Y, Zhao Y, Li L, et al. The oncoprotein HBXIP upregulates PDGFB via activating transcription factor Sp1 to promote the proliferation of breast cancer cells[J]. Biochem Biophys Res Commun, 2013, 434(2): 305-310.
[6] Xu F, You X, Liu F, et al. The oncoprotein HBXIP up-regulates Skp2 via activating transcription factor E2F1 to promote proliferation of breast cancer cells[J]. Cancer Lett, 2013,333(1): 124-132.
[7] Bar-Peled L, Schweitzer LD, Zoncu R, et al. Ragulator is a GEF for the rag GTPases that signal amino acid levels to mTORC1[J].Cell, 2012, 150(6): 1196-1208.
[8] Zhang H, Kobayashi R, Galaktionov K, et al. p19Skp1 and p45Skp2 are essential elements of the cyclin A-CDK2 S phase kinase[J]. Cell, 1995, 82(6): 915-925.
[9] Shigemasa K, Gu L, O'Brien TJ, et al. Skp2 overexpression is a prognostic factor in patients with ovarian adenocarcinoma[J].Clin Cancer Res, 2003, 9(5): 1756-1763.
[10] Liu Q, Bai X, Li H, et al. The oncoprotein HBXIP upregulates Lin28B via activating TF II D to promote proliferation of breast cancer cells[J]. Int J Cancer, 2013, 133(6): 1310-1322.
[11] Hu N, Zhang J, Cui W, et al. miR-520b regulates migration of breast cancer cells by targeting hepatitis B X-interacting protein and interleukin-8[J]. J Biol Chem, 2011, 286(15): 13714-13722.
[12] Zhang W, Zhao XY, Li Y, et al. Effects of defferent concentrations of juglone on the proliferation and apoptosis of Hela cells[J].Med J Chin PLA, 2013, 38(2): 99-102. [张巍, 赵行宇, 李妍,等. 不同浓度胡桃醌对Hela细胞增殖及凋亡的影响[J]. 解放军医学杂志, 2013, 38(02): 99-102.]
[13] Melegari M, Scaglioni PP, Wands JR. Cloning and characterization of a novel hepatitis B virus x binding protein that inhibits viral replication[J]. J Virol, 1998, 72(3): 1737-1743.
[14] Liu S, Li L, Zhang Y, et al. The oncoprotein HBXIP uses two pathways to up-regulate S100A4 in promotion of growth and migration of breast cancer cells[J]. J Biol Chem, 2012, 287(36):30228-30239.
[15] Masuda TA, Inoue H, Sonoda H, et al. Clinical and biological significance of S-phase kinase-associated protein 2 (Skp2)gene expression in gastric carcinoma: modulation of malignant phenotype by Skp2 overexpression, possibly via p27 proteolysis[J]. Cancer Res, 2002, 62(13): 3819-3825.
[16] Signoretti S, Di Marcotullio L, Richardson A, et al. Oncogenic role of the ubiquitin ligase subunit Skp2 in human breast cancer[J]. J Clin Invest, 2002. 110(5): 633-641.
[17] Zhai NN, Zhang W, Yu J, et al. Expression of Skp2 prote in andmRNA in esophageal squamous cell carcinoma tissue[J]. J Zhengzhou Univ (Med Sci), 2011, 46(1): 10-12. [翟娜娜, 张威,于婧, 等. 食管鳞状细胞癌组织中Skp2蛋白及mRNA的表达[J]. 郑州大学学报(医学版), 2011, 46(1): 10-12.]
[18] Inuzuka H, Gao D, Finley LW, et al. Acetylation-dependent regulation of Skp2 function[J]. Cell, 2012, 150(1): 179-193.
[19] Lu M, Zhao Y, Xu F, et al. The expression and prognosis of FOXO3a and Skp2 in human ovarian cancer[J]. Med Oncol,2012. 29(5): 3409-3415.
