慢性不可预测轻度应激诱导的抑郁模型大鼠行为学评定及血清谷胱甘肽过氧化物酶水平检测
2013-08-28朱长强李治国刘勇丁兴华杨树广刘少君
朱长强,李治国,刘勇,丁兴华,杨树广,刘少君
抑郁症是一种常见的慢性易复发精神疾病。目前抑郁症及其复发的真正病因尚未阐明,高复发性是抑郁症治疗面临的巨大难题[1-2]。研究表明,经治疗恢复后的患者约50%会在停药后复发,而在持续药物治疗过程中复发率亦达20%~37%[3-4]。国内外研究证实抑郁症患者及抑郁模型动物的体内存在氧化应激,伴有氧自由基代谢异常及抗氧化酶活性改变[5-7]。Stefanescu等[8]在首发和复发抑郁症患者的血清中均发现过氧化脂质水平升高和谷胱甘肽过氧化物酶(GPX)活性降低。但目前尚未见有关首发及再发抑郁动物模型血清中GPX-3水平变化的报道。
GPX-3是GPX家族成员中已知唯一的细胞外亚型,主要分布在血液。本实验采用慢性不可预测轻度应激(CUMS)方法建立首发和复发抑郁模型大鼠来模拟人类抑郁症及其复发情况,检测抑郁模型大鼠血清GPX-3含量变化,为探讨抑郁症发生及复发机制提供参考。
1 材料与方法
1.1 主要试剂及设备 氟西汀(Lilly公司,美国),旷野实验系统(上海吉利公司),蛋白酶抑制剂(Sigma公司,美国),蔗糖(国药集团化学试剂有限公司)。
1.2 实验动物及分组 实验大鼠由军事医学科学院动物中心提供,实验前适应环境1周,同时进行糖水适应训练,即每个鼠笼上放置两个饮水瓶,分别装有1%的糖水和普通自来水。1周后,评定行为学指标,筛选行为学表现正常的成年健康雄性SD大鼠24只,体重180g~220g,随机均分为4组(n=6):组1(正常饲养),组2(CUMS),组3(正常饲养+生理盐水+正常饲养),组4(CUMS+氟西汀+CUMS)。
1.3 慢性轻度应激方法 本实验选用的CUMS方法包括9种刺激:冷水游泳(4℃,5min),热水游泳(42℃,5min),倾斜鼠笼(倾斜45°,24h),成对饲养(24h),禁食(24h),禁水(24h),足底电击5min(36V,20s/次,1次/10s),昼夜颠倒(24h),潮湿鼠笼(24h,鼠笼中加入适当水)。9种刺激随机安排在4周内完成,每日只能给予一种刺激,并且为使动物不能预测刺激的发生,不连续进行同种刺激。实验组单笼饲养,对照组成对正常饲养。
1.4 抑郁动物模型的建立 组1和组3大鼠正常饲养,组2和组4大鼠给予4周CUMS。4周后对四组大鼠进行行为学评定。行为学评定结束后,组1和组2处死采集血清。组4大鼠给予3周氟西汀[10mg/(kg.d)]治疗,组3大鼠给予3周同剂量生理盐水。一周药物洗脱后,再次对两组大鼠进行行为学评定。组4大鼠再次接触4周CUMS,组3大鼠正常饲养4周,两组大鼠再次进行行为学评定,模型建立流程图见图1。
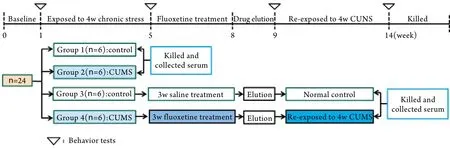
图1 CUMS诱导的抑郁大鼠模型建立流程图Fig.1 Flow chart of experimental procedure in rat model of depression induced by CUMS
1.5 行为学评定
1.5.1 糖水消耗实验 糖水消耗实验时,首先禁水23h,然后在鼠笼上同时放置事先称重的两瓶水,分别为1%蔗糖水和普通自来水。四组大鼠饮用1h后,撤下两瓶水并称重,计算动物对糖水的偏好度:糖水偏好度(%)=糖水消耗量(g)/[糖水消耗量(g)+自来水消耗量(g)]。实验时间安排在8:00–10:30之间。1.5.2 旷野实验 旷野敞箱内径长×宽×高为75cm×75cm×40cm,外周带有视屏录像和照明的隔音箱。大鼠放置于敞箱中央区域,录像系统能自动记录大鼠在5min内的活动路程﹑活动次数﹑不动时间﹑中央区域活动路程及活动平均速度等数据。实验时间安排在8:00–12:00之间。
1.6 血清样品的采集及GPX-3含量测定 大鼠经1%戊巴比妥钠(30mg/kg)腹腔注射麻醉,心脏取血,每1ml血液中加入100μl蛋白酶抑制剂。室温静置1h后1500×g离心10min。收集血清,采用上海劲马实验设备有限公司的酶联免疫吸附(ELISA)试剂盒测定各组大鼠血清中GPX-3含量。
1.7 统计学处理 采用Sigma Plot软件进行统计学分析,计量资料以±s表示,组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结 果
2.1 实验前各组行为学评定结果 基线期,大鼠经1周环境适应和糖水适应性训练后进行行为学检测,结果显示4组大鼠糖水偏好度﹑活动路程及不动时间比较差异均无统计学意义(P>0.05,表1)。
表1 各组大鼠糖水偏好度﹑活动能力的比较(±s, n=6)Tab.1 Comparison of sucrose preference and locomotor activity among 4 groups of rats (±s, n=6)

表1 各组大鼠糖水偏好度﹑活动能力的比较(±s, n=6)Tab.1 Comparison of sucrose preference and locomotor activity among 4 groups of rats (±s, n=6)
Group Sucrose preference(%)Immobility time(s)1 80.5±12.7 2691.3±302.9 48.3±12.1 2 76.9±14.5 2639.1±708.4 47.8±9.8 3 74.8±9.1 2375.7±377.3 54.5±12.6 4 73.5±12.8 2895.3±1053.2 49.5±16.7 Distance moved(cm)
2.2 第一次CUMS后大鼠出现抑郁样行为 4周CUMS后,与对照组(组1﹑组3)比较,实验组(组2﹑组4)大鼠的糖水偏好度﹑活动能力均显著下降(P<0.01),表明抑郁样大鼠模型构建成功(表2)。
表2 CUMS后各组大鼠糖水偏好度﹑活动能力的比较(±s, n=6)Tab.2 Comparison of sucrose preference and locomotor activity among 4 groups of rats after CUMS(±s, n=6)

表2 CUMS后各组大鼠糖水偏好度﹑活动能力的比较(±s, n=6)Tab.2 Comparison of sucrose preference and locomotor activity among 4 groups of rats after CUMS(±s, n=6)
(1)P<0.01 compared with group 1; (2)P<0.01 compared with group 3
Group Sucrose preference(%)Distance moved (cm)Immobility time (s)1 75.2±13.7 1721.8±260.1 89.1±32.9 2 18.3±13.1(1) 331.7±140.2(1) 240.4±43.9(1)3 74.6±12.4 1815.8±153.4 79.9±27.5 4 35.5±10.6(2) 195.2±289.9(2) 254.9±51.5(2)
2.3 治疗后大鼠抑郁样行为恢复正常 组4(实验组)抑郁样大鼠经21d氟西汀治疗和7d药物洗脱后,糖水偏好度(83.1%±3.67%)﹑活动路程(1807.4±626.2cm)及不动时间(90.4±34.3s)与组3(对照组)大鼠的糖水偏好度(78.2%±18.0%)﹑活动路程(1941.3±938.3cm)及不动时间(83.4±37.7s)相比无明显差异(P>0.05)。
2.4 再次CUMS诱导抑郁样行为的复发 药物治疗后的组4(实验组)大鼠二次接触4周CUMS后,行为再次发生明显变化,其糖水偏好度(41.3%±9.9%)﹑活动路程(1021.9±225.0cm)及不动时间(137.5±18.3s)与组3(对照组)大鼠(分别为77.7%±6.0%﹑1661.4±410.8cm﹑90.4±41.3)比较差异均有统计学意义(P<0.01或P<0.05)。再次接触CUMS刺激使大鼠的糖水偏好度﹑活动路程均明显减少,不动时间增加,出现抑郁症复发的症状。
2.5 首发和复发抑郁样大鼠血清GPX-3浓度测定结果 首次CUMS后组2(抑郁样组)大鼠血清GPX-3水平(20.5±2.5pmol/ml)明显高于组1(对照组)GPX-3水平(14.1±2.2pmol/ml),再次CUMS后组4(抑郁样组)大鼠血清GPX-3水平(33.2±3.2pmol/ml)也显著高于组3(对照组)大鼠(21.5±2.5pmol/ml),差异均有统计学意义(P<0.01)。
3 讨 论
CUMS抑郁动物模型是被广泛认可的一种模型,具有很好的表面效应(症状表现)﹑预测效应(药理学特征)及结构效应(理论基础)[9-10]。Katz等[11]首次对动物展开慢性应激研究,随后Willner等[12]在Katz研究的基础上加以改进,选用比较温和的应激刺激,形成了目前广泛使用的CUMS抑郁动物模型,并以快感/兴趣缺失(1%蔗糖水消耗量比例)作为衡量建模是否成功的关键。本实验采用CUMS刺激方法建立首发和复发CUMS抑郁大鼠模型,模拟抑郁症的发作及其复发,并使用糖水消耗实验和旷野实验[13]进行抑郁模型动物的行为学评价。在糖水消耗实验中,与对照组相比,首次和再次CUMS处理的大鼠糖水偏好度均显著下降(P<0.01),表明首次和再次CUMS刺激后的大鼠均表现出兴趣缺失,提示其出现抑郁样症状。同时在实验中发现首次CUMS诱导的抑郁大鼠经3周氟西汀治疗后,糖水偏好度恢复到对照组水平,该结果与国内外文献报道一致,即氟西汀治疗可以使抑郁模型大鼠的兴趣缺失逆转[14-16]。在旷野实验中,首次CUMS刺激后,实验大鼠活动能力明显降低(P<0.01);药物治疗后,实验大鼠的活动路程和不动时间与对照组相比无明显差异;再次接触4周CUMS后,实验大鼠总活动路程减少,不动时间增多(P<0.05)。综上可知,行为学测试结果表明CUMS可诱导大鼠产生与抑郁症患者的兴趣缺失﹑精神活动迟滞类似的症状,提示首发和复发CUMS抑郁动物模型构建成功,可用于下一步实验研究。
GPX-3是已知GPX家族成员中唯一的细胞外亚型,是体内重要的抗氧化酶之一[17]。它能消除机体内的过氧化氢和脂质过氧化物,阻断活性氧自由基对机体的损害,是生物体内重要的活性氧自由基清除剂。研究发现,多种因素可导致GPX-3表达变化并参与了多种疾病的发生发展机制,如在膀胱癌﹑乳腺癌﹑胃癌及前列腺癌中均检测到GPX-3表达下调[18]。但目前抑郁症患者及抑郁动物模型血清中GPX-3蛋白含量变化仍未见报道。本研究采用酶联免疫吸附实验(ELISA)检测了抑郁模型大鼠血清GPX-3蛋白水平的变化,发现首发和复发CUMS抑郁大鼠血清GPX-3蛋白水平显著升高(P<0.01)。已有研究显示炎症性肠道疾病患者血浆﹑结肠炎模型小鼠血浆及糖尿病模型大鼠心脏中存在氧化应激,并且增多的氧自由基引起GPX-3表达水平升高[19-21]。此外,研究证明CUMS导致大鼠脑内氧化应激水平升高,即氧自由基显著增多,并且增多的自由基进一步产生脂质过氧化[7]。Eren等[6]在慢性轻度应激抑郁模型大鼠脑皮质和血浆中均检测到脂质过氧化水平显著升高。Jindal等[22]在CUMS抑郁模型小鼠脑中也检测到脂质过氧化水平显著升高。根据本研究结果和既往报道,推测首发和复发CUMS抑郁大鼠血清中升高的GPX-3可能在降低抑郁样大鼠体内氧化应激水平方面发挥作用,从而对大鼠机体起到一定保护作用。
综上所述,本研究显示CUMS可诱导大鼠抑郁样行为,并且经氟西汀治疗恢复后再次接触慢性应激能再次产生抑郁样症状,表明首发和复发抑郁样动物模型造模成功。大鼠血清中升高的GPX-3可能在降低抑郁样大鼠体内氧化应激水平方面发挥作用,从而减轻活性氧自由基对大鼠机体的损害,对大鼠机体起到一定的保护作用。GPX-3和氧化应激之间的具体关系以及它们在首发和复发抑郁症中的病理生理作用仍需进一步研究。
[1] Liang SY, Li XP. Assessment of scales on coronary heart disease complicated with depression and anxiety disorder[J]. Chin J Pract Intern Med, 2011, 31(2): 135-138.[ 梁思宇, 李向平. 冠心病合并抑郁焦虑障碍常用量表评价[J]. 中国实用内科杂志, 2011, 31(2): 135-138.]
[2] Du QY, Yang CB. Progress on the pathogenesis of depression post-stroke[J]. Acta Acad Med CPAF, 2010, 19(2):166-168.[杜其勇, 杨朝斌. 卒中后抑郁发病机制研究进展[J]. 武警医学院学报, 2010, 19(2):166-168.]
[3] Grown WH, Finkelstein S, Berndt ER, et al. The impact of treatment-resistant depression on health care utilization and costs[J]. Clin Psychiat, 2002, 6(11): 963-971.
[4] Zhou JM, Yu EY, Ren AH, et al. Relationship between depression and the factors related to senile patients with hypertension[J].Med J Chin PLA, 2011, 36(4): 395-396.[周建妹, 于恩彦, 任爱华, 等. 抑郁与高龄高血压相关因素的关系研究[J]. 解放军医学杂志, 2011, 36(4): 395-396.]
[5] Sarandol A, Sarandol E, Eker SS, et al. Major depressive disorder is accompanied with oxidative stress: short-term antidepressant treatment does not alter oxidative-antioxidative systems[J].Hum Psychopharmacol, 2007, 22 (2): 67-73.
[6] Eren I, Naziroğlu M, Demirdaş A, et al. Protective effects of lamotrigine, aripiprazole and escitalopram on depressioninduced oxidative stress in rat brain[J]. Neurochem Res, 2007,32(7): 1188-1195.
[7] Lucca G, Comim CM, Valvassori SS, et al. Effects of chronic mild stress on the oxidative parameters in the rat brain[J].Neurochem Int, 2009, 54(5/6): 358-362.
[8] Stefanescu C, Ciobica A. The relevance of oxidative stress status in first episode and recurrent depression[J]. J Affect Disord,2012, 143(1/2/3): 34-38.
[9] Henn FA, Vollmayr B. Stress models of depression: forming genetically vulnerable strains[J]. Neurosci Biobehav Rev, 2005,29 (4/5): 799-804.
[10] Li ZC, Li DQ. Effects of Wuling capsule on learning and memory disorder induced by post-stroke depression in rats[J]. Med J Chin PLA, 2011, 36(6): 629-632. [李中春, 李德强. 乌灵胶囊对卒中后抑郁大鼠学习记忆障碍的影响[J]. 解放军医学杂志, 2011, 36(6): 629-632.]
[11] Katz RJ, Roth KA, Carroll BJ, et al. Acute and chronic stress effects on open field activity in the rat: Implications for a model of depression[J]. Neurosci Biobehav Rev, 1981, 5(2): 247-251.
[12] Willner P, Towell A, Sampson D, et al. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant[J]. Psychopharmacology(Berl), 1987, 93(3): 358-364.
[13] Jiang L, Ran H, Duan W, et al. Regulatory effects of adenosine A2A receptors on psychomotor ability and mood behavior of mice[J]. Med J Chin PLA, 2011, 36(7): 706-710.[姜莉, 冉鸿,段炜, 等. 腺苷A2A受体对小鼠精神运动和情绪行为的调控作用[J]. 解放军医学杂志, 2011, 36(7): 706-710.]
[14] Duman RS, Malberg J, Thome J, et al. Neural plasticity to stress and antidepressant treatment[J]. Biol Psychiatry, 1999, 46(9):1181-1191.
[15] Grippo AJ, Beltz TG, Weiss RM, et al. The effects of chronic fluoxetine treatment on chronic mild stress-induced cardiovascular changes and anhedonic[J]. Biol Psychiatry, 2006,59(4): 309-316.
[16] Yang C, Wang G, Wang H, et al. Cytoskeletal alterations in rat hippocampus following chronic unpredictable mild stress and re-exposure to acute and chronic unpredictable mild stress[J].Behav Brain Res, 2009, 205(2): 518-524.
[17] Takahashi K, Avissar N, Whitin J, et al. Purification and charaterization of human plasma glutathione peroxidase: A selenoglycoprotien distinct from the known cellurar enzyme[J].Arch Biochem Biophys, 1987, 256(2): 677- 686.
[18] Zhang X, Yang JJ, Kim YS, et al. An 8-gene signature, including methylated and down-regulated glutathione peroxidase-3, of gastric cancer[J]. Int J Oncol, 2010, 36(2): 405-414.
[19] Tham DM, Whitin JC, Cohen HJ. Increased expression of extracellular glutathione peroxidase in mice with dextran sodium sulfate-induced experimental colitis[J]. Pediatr Res, 2002,51(5): 641-646.
[20] Hoffenberg EJ, Deutsch J, Smith S, et al. Circulating antioxidant concentrations in children with inflammatory bowel disease[J].Am J Clin Nutr, 1997, 65(5): 1482-1488.
[21] Iwata K, Nishinaka T, Matsuno K, et al. Increased gene expression of glutathione peroxidase-3 in diabetic mouse heart[J]. Biol Pharm Bull, 2006, 29(5): 1042-1045.
[22] Jindal A, Mahesh R, Bhatt S. Etazolate, a phosphodiesterase 4 inhibitor reverses chronic unpredictable mild stress-induced depression-like behavior and brain oxidative damage[J].Pharmacol Biochem Behav, 2013, 105: 63-70.
