Pravastatin抑制心肌成纤维细胞胶原基因表达及其机制研究
2013-08-24郑舒展李家富
郑舒展,冯 健,余 琴,李家富
(泸州医学院附属医院心内科,四川 泸州 646000)
心肌纤维化(myocardial fibrosis,MF)系心肌细胞外基质中胶原纤维过量积聚、胶原含量显著升高或胶原成分发生改变的病理过程,是心肌重构的一个重要特征,可导致充血性心力衰竭、恶性心律失常和猝死,因此研究MF的发生机制及寻求防治MF的有效措施具有重要的临床意义。血管紧张素Ⅱ(angiotensionⅡ,AngⅡ)是目前研究表明最重要的致心肌肥厚因子,可直接通过1型受体介导刺激心肌成纤维细胞(cardiac fibroblasts,CF)增殖,胶原合成[1-2]。他汀类降脂药物为3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,近年研究表明该类药物可延缓心肌重构,但其具体机制有待进一步阐明。本研究拟观察pravastatin对AngⅡ诱导的CF增殖及胶原合成的影响及其作用机制。
1 材料与方法
1.1 实验动物和试剂 1~3日龄的 Wistar大鼠(清洁动物)20只,雌雄不限,由泸州医学院实验动物中心提供。总RNA提取试剂Trizol购自Invitrogen公司;RT-PCR试剂盒购自TaKaRa公司;AngⅡ、Pravastatin、MTT、甲羟戊酸(Mevalonic acid,MVA)、焦磷酸法呢酯(farnesy-PP,FPP)、焦磷酸牛龙牛儿基牛龙牛儿酯(geranylgeranyl-PP,GGPP)均为Sigma公司产品。
1.2 方法
1.2.1 细胞培养 无菌条件下取 Wistar大鼠心室,剪碎,0.125%胰蛋白酶消化分离细胞,所得全部细胞置于含10%小牛血清的DMEM培养基中,在5%CO2、37℃、孵箱中培养60~90min,差速贴壁法除去心肌细胞,剩下的细胞即为CF。细胞生长至汇合状态采用0.25%胰蛋白酶消化传代,2~4代细胞用于实验,经倒置显微镜、免疫组化纤维黏连蛋白染色阳性鉴定为CF。将培养的CF分为:(1)空白对照组(A组):不加干预药物。(2)AngⅡ组(B组):AngⅡ10-6mol/L。(3)Prav+AngⅡ 组:Prav 10-6mol/L + AngⅡ10-6mol/L (C组),Prav 10-5mol/L +AngⅡ10-6mol/L(D 组),Prav 10-4mol/L+ AngⅡ10-6mol/L(E组)。(4)Prav10-4mol/L+AngⅡ10-6mol/L+MVA10-4mol/L 组(F组)。(5)Prav 10-4mol/L +AngⅡ10-6mol/L+GGPP10-5mol/L 组 (G 组)。(6)Prav 10-4mol/L+AngⅡ10-6mol/L+FPP 10-5mol/L组(H 组)。每组重复4孔。
1.2.2 MTT比色法检测细胞增殖 取对数生长期CF接种于96孔板,37℃、5%CO2及饱和湿度下培养24h后,换1%血清DMEM培养液培养24h使细胞进入生长静止期,药物干预48h,各组于药物刺激结束前4h加入MTT 20μL,4h后终止培养,吸弃孔内培养上清液,加入150μL二甲基亚砜,振荡10 min使使结晶充分溶解,在酶联免疫检测仪上490nm处测定吸光度值(A)。
1.2.3 细胞总RNA提取及RT-PCR 总RNA提取及RTPCR按说明书进行,取1μL总RNA按逆转录试剂盒说明书方法先逆转录合成第1条cDNA,Random 9mers作引物,逆转录酶为AMV,逆转录反应体系总体积为10μL,反应条件为:30℃10min,50℃20min,99℃5min,5℃5min,1个循环。以cDNA为模板用引物经PCR方法进行扩增。引物采用primer primer 5软件设计并由大连宝生物公司合成,引物序列为PICP:上游 5′-TGC CGT GAC CTC AAG ATG TG-3′,下游5′-CAC AAG CGT GCT GTA GGT GA-3′。PCⅢ:上游5′-CCA CCC TGA ACT CAA GAG C-3′,下游 5′-TGA ACT GAA AGC CAC CAT T-3′ 。GAPDH:上 游 5′-ACC ACA GTC CAT GCC ATC AC-3′,下 游 5′-TCC ACC ACC CTG TTG CTG TA-3′。PⅠCP,GAPDH 的扩增条件为:94 ℃ 3 min,94℃30s,60℃30s,72℃2min,共30个循环。PⅠCP扩增片段大小为462bp,GAPDH片段大小452bp。PCⅢ的扩增条件为:94℃3min,94℃30s,54℃30s,72℃2min,共30个循环,产物片段大小为212bp。每组RT-PCR重复3次。PCR产物上样于2%的琼脂糖凝胶(含0.5μg/mL溴化乙锭),0.5×TBE作为电泳缓冲液,以5V/cm电压电泳时间45 min。应用凝胶成像系统分析,以目的基因片段/GAPDH片段的条带光密度值比值来表示其相对量。
1.3 统计学处理 采用SPSS13.0软件进行统计学分析;计量资料组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 Prav对AngⅡ刺激下CF增殖的影响 图1显示,AngⅡ明显促进 CF的增殖,与 A 组比较(P<0.01)。Prav(10-6mol/L、10-5mol/L、10-4mol/L)呈浓度依赖性的抑制 AngⅡ刺激下的CF增殖。加入MVA、GGPP后F、G组可完全阻断Prav的抑制作用,与E组比较有统计学意义(P<0.01)。H组对Prav的作用无影响,与E组比较差异无统计学意义(P>0.05)。
2.2 Prav对AngⅡ刺激下成纤维细胞PⅠCP、PCⅢmRNA表达的影响 AngⅡ明显刺激Ⅰ、Ⅲ型前胶原基因的表达,与A组比较差异有统计学意义(P<0.01)。Prav各浓度组C、D、E组与B组比较差异有统计学意义(P<0.01),抑制作用具有浓度依赖性。加入 MVA,GGPP后F、G组可完全阻断Prav的抑制作用,与E组比较差异有统计学意义(P<0.01)。H组对Prav的作用无影响,与E组比较差异无统计学意义(P>0.05),见图2、3。
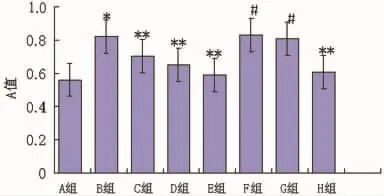
图1 Prav对AngⅡ刺激下CF增殖影响各组的比较
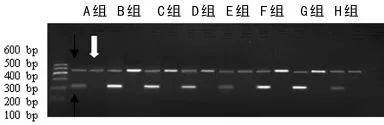
图2 RT-PCR电泳图
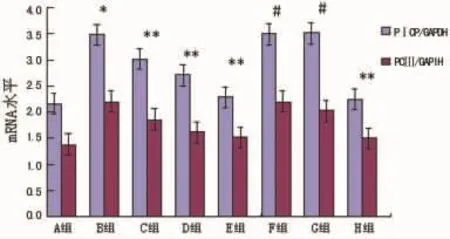
图3 Prav对AngⅡ作用下PICP、PCⅢmRNA表达的影响
3 讨 论
心肌成纤维细胞过度增殖导致心肌纤维化发生发展,肾素-血管紧张素-醛固酮系统(RAAS)的激活是心肌纤维化的重要调控因素,其中AngⅡ是重要的促细胞生长因子。本研究显示AngⅡ直接作用于CF,明显刺激新生大鼠的心脏CF增殖和胶原基因的表达。胶原是心肌细胞外间质的主要成分,其中Ⅰ型胶原最多,Ⅲ型次之,胶原网在维护心脏结构和功能完整性上起重要作用,心肌胶原的组成及含量与心脏的收缩和舒张功能密切相关[3]。
已有研究表明,他汀类药物具有减轻心肌重构的作用[4-5],最近一项对随机临床试验的Meta分析显示:除了抑制心肌重构的作用之外,他汀类药物还可以增加慢性心力衰竭患者的左室射血分数,改善心脏功能[6]。他汀类药物的非降脂作用主要在于其抗炎症、抗氧化,抑制细胞增殖[7],抑制生长因子的表达[8]等作用。辛伐他汀可抑制脂多糖诱导的CF血管紧张素1型受体的蛋白表达,从而拮抗AngⅡ的作用[9]。普伐他汀发挥抗炎效应能减少心梗大鼠梗死区域的胶原含量从而改善心肌重构[10]。本研究观察Prav直接作用于体外培养的CF,显示Prav呈浓度依赖性的逆转AngⅡ的刺激增殖作用,抑制CF的PICP、PCⅢmRNA表达,表明Prav从转录水平调节胶原的合成,拮抗AngⅡ诱导的心肌纤维化。
他汀类药物的主要作用机制是通过竞争性抑制HMGCoA还原酶,在肝脏抑制胆固醇的合成,同时也阻断甲羟戊酸和这一通路上其他重要的类异戊二烯中间体的生成,如MVA、FPP、GGPP等[11]。GGPP和FPP是小 GTP蛋白转录后修饰的重要脂质附属物,提供异戊二烯基团使小GTP蛋白活化从而促进细胞增殖和分化。小GTP蛋白属于Ras超家族,包括Ras、Rho和Rac等,由于Rho家族是龙牛儿基化作用的主要目标,所以抑制Rho的信号转导活性及其与下游效应分子Rho激酶的结合可能是介导他汀类药物对血管壁细胞及心脏细胞的某些非调脂效应的机制[12-13]。他汀类药物抑制HMG-CoA还原酶后,抑制了由MVA代谢产生的GGPP、FPP的合成,从而阻止小GTP蛋白的活化。FPP主要提供法尼酯基团,与Ras的活化有关;Rho蛋白活化依赖于GGPP提供的二牛龙牛儿基团,AngⅡ可诱导新生SD大鼠CFBs的Rho激酶mRNA转录并活化Rho激酶,抑制Rho激酶活化对AngⅡ刺激的CFBs增殖与胶原合成具有明显的抑制作用[14]。Porter KE等研究显示通过抑制Rho的龙牛儿基化或者抑制Rho激酶的活性,可以达到同使用辛伐他汀后人心房肌成纤维细胞的增殖受抑制一样的效果[15]。本实验表明GGPP逆转Prav的作用而FPP则不能,说明Prav主要通过抑制甲羟戊酸途径,其中可能抑制Rho蛋白减少成纤维细胞增殖和胶原基因的表达,从而减缓心肌纤维化过程。
[1] Vivar R,Soto C,Copaja M,et al.Phospholipase C/protein kinase C pathway mediates angiotensin Ⅱ-dependent apoptosis in neonatal rat cardiac fibroblasts expressing AT1 receptor[J].J Cardiovasc Pharmacol,2008,52(2):184-190.
[2] 周有华,王杨,董战玲,等.NO参与AngⅡ诱导心肌成纤维细胞胶原含量的变化[J].海南医学院学报,2009,15(10):1193-1197.
[3] McCurdy S,Baicu CF,Heymans S,et al.Cardiac extracellular matrix remodeling:fibrillar collagens and secreted protein acidic and rich in cysteine(SPARC)[J].J Mol Cell Cardiol,2010,48(3):544-549.
[4] Chang SA,Kim YJ,Lee HW,et al.Effect of rosuvastatin on cardiac remodeling,function,and progression to heart failure in hypertensive heart with established left ventricular hypertrophy[J].Hypertension,2009,54(3):591-597.
[5] Zhao XY,Li L,Zhang JY,et al.Atorvastatin prevents left ventricular remodeling in spontaneously hypertensive rats[J].Int Heart J,2010,51(6):426-431.
[6] Zhang L,Zhang S,Jiang H,et al.Effects of statin treatment on cardiac function in patients with chronic heart failure:a meta-analysis of randomized controlled trials[J].Clin Cardiol,2011,34(2):117-123.
[7] 张宇,欧阳平,罗烨,等.普伐他汀对肿瘤坏死因子-α诱导的大鼠血管平滑肌细胞syndecan-4蛋白表达的影响[J].南方医科大学学报,2010,30(5):998-1001.
[8] Dai QM,Lu J,Liu NF.Fluvastatin attenuates myocardial interstitial fibrosis and cardiac dysfunction in diabetic rats by inhibiting over-expression of connective tissue growth factor[J].Chin Med J,2011,124(1):89-94.
[9] 刘少伟,赵连友,郑强荪,等.脂多糖对心肌成纤维细胞血管紧张素Ⅱ2型受体蛋白表达的影响及辛伐他汀的干预效应[J].中华高血压杂志,2007,15(5):415-418.
[10]Li TS,Takahashi M,Suzuki R,et al.Pravastatin improves remodeling and cardiac function after myocardial infarction by an anti-inflammatory mechanism rather than by the induction of angiogenesis[J].Ann Thorac Surg,2006,81(6):2217-2225.
[11]Hernandez-PO,Perez SD,Navarro AJ,et al.Effects of the 3hydroxy 3methylglutaryl-CoA reductase inhibitors,atorvastatin and simvastatin,on the expression of endothelin-1and endothelial nitric oxide synthase in vascular endothelial cells[J].J Clin Invest,1998,101(12):2711-2719.
[12]Takemoto M,Liao JK.Pleiotropic effects of 3-hydroxy-3-methyl glutaryl coenzyme A reductase inhibitors[J].Arterioscler Thromb Vasc Biol,2001,21(11):1712-1719.
[13]Copaja M,Venegas D,Aránguiz P,et al.Simvastatin induces apoptosis by a Rho-dependent mechanism in cultured cardiac fibroblasts and myofibroblasts[J].Toxicol Appl Pharmacol,2011,255(1):57-64.
[14]汪祥海,伍卫,杨军,等.Rho激酶在血管紧张素Ⅱ刺激大鼠心肌成纤维细胞增殖和胶原合成中的作用[J].中国病理生理杂志,2007,23(6):1098-1101.
[15]Porter KE,Turner NA,O′Regan DJ,et al.Simvastatin reduces human atrial myofibroblast proliferation independently of cholesterol lowering via inhibition of RhoA[J].Cardiovasc Res,2004,61(4):745-755.
