6-巯基嘌呤在HPMCAS包覆介孔分子筛SBA-15药物系统中的缓释行为研究*
2013-08-24吴都督何仰芬陈文芳
陈 稚,吴都督,何仰芬,陈文芳
(广东医学院:1.分析中心;2.药学院,广东 东莞 523808)
6-巯基嘌呤(6-MP)是常用的抗癌药物。但在传统口服给药方式中,药物在到达肠道以前大部分就被胃吸收或者被胃中的酶所破坏,这样不仅降低了药物到达肠道后的有效浓度,而且药物对造血系统的毒副反应容易使胃、肝等正常器官受到伤害[1-2]。最近,纳米技术的发展激发了广大研究者使用新开发的纳米材料作为医药载体的兴趣。而硅基介孔分子筛因具有分布均匀且连续可调的纳米孔径、高比表面积和良好的生物相容性等优点,已成为一种新型药物载体[3-9]。另外,考虑到胃和肠道各自环境中pH的差异,如能设计一种pH控制的药物释放载体应用于肠道药物控释应该是一个切合实际的研究方向。然而,到目前为止,基于介孔分子筛这种新型载体的肠道药物控释研究却只有很少的报道。部分学者利用羧基官能化SBA-15表面的COOH和聚电解质PDDA之间的静电相互作用,研究开发了一种pH敏感药物释放载体,但该释控系统对酸过于敏感,对6-MP应用于肠道给药价值不大[10]。因此,如果能设计出一种pH控制肠道药物释控系统,它能够很明显地延缓6-MP在胃液中的释放速度,而且又不限制6-MP在肠液中的释放,那么所得到的应是一个好的肠道靶向药物释放系统。而且该释控系统还可阻止毒副反应对胃、肝等器官的损害,对肠癌的治疗应具有广阔的前景。醋酸羟丙基甲基纤维素琥珀酸酯(HPMCAS)是以羟丙基甲基纤维素与醋酐、琥珀酸酐酯化得到的一种性能优良的pH敏感的包覆材料,它因具有安全无毒、溶解性好、在体内不易被酶破坏等特点,是一种理想的介孔分子筛的包覆材料[11]。本文以pH敏感的HPMCAS作为包衣材料,通过简单的提拉方法,将其包覆于介孔分子筛SBA-15表面,制备pH敏感的HPMCAS/SBA-15药物控释载体,同时以6-MP为模型药物,将其负载于控释载体中,并考察其在模拟胃液(SGF)和模拟肠液(SIF)中的缓释行为,以验证HPMCAS/SBA-15载体的pH敏感性能。
1 材料与方法
1.1 材料与试剂 6-巯基嘌呤分析纯由Sigma公司提供;醋酸羟丙基甲基纤维素琥珀酸酯分析纯由湖州四风生物科技有限公司提供;P123分析纯由Aldrich公司提供;正硅酸乙酯分析纯由天津市化学试剂一厂提供;磷酸二氢钾、磷酸氢钾分析纯由天津科密欧化学试剂公司提供;无水乙醇、盐酸分析纯由广东番禺化学试剂厂提供。
1.2 方法
1.2.1 介孔分子筛SBA-15的合成 在磁力搅拌下,将6.0g表面活性剂P123加入到80mL 1.5mol/L的HCl溶液中,恒定温度在40℃,搅拌至P123完全溶解后,加入8.0mL的正硅酸乙酯。反应混合物在40℃下恒温搅拌24h后转移至100mL的晶化釜中,于100℃下晶化36h。所得产物过滤后,用去离子水和无水乙醇反复冲洗直至滤液的pH为7.0,然后样品在80℃下干燥,最后将样品在索氏抽提器中用无水乙醇萃取48h,80℃下烘干即得纯硅基介孔SBA-15。
1.2.2 药物吸附 分别取1.0g SBA-15粉末和1.5g 6-巯基嘌呤,加入到250mL的去离子水和甲醇的等体积混合溶剂中。室温下搅拌12h后过滤,所得固体在80℃烘箱中干燥。取2.0mL滤液稀释到25.0mL,用 WFZ-26A型紫外可见分光光谱仪(天津拓普仪器有限公司)测定溶液中的6-MP的浓度,并按以下公式确定载药量。载药量=[(投入药物质量-游离药物质量)/载体质量]×100% 。
1.2.3 HMPCP/SBA-15的制备和药物缓释 取0.20g负载了药物的SBA-15粉末,在5.0MPa的轴向压力下制得13mm×3mm的药片。然后将4.0g的HPMCAS加入到甲醇和去离子水的混合溶剂中(甲醇和水的体积比=1∶1),搅拌至HPMCAS全部溶解。接着以提拉的方式在SBA-15药片上包覆HPMCAS聚合物,提拉的速度控制在20cm/min。每个药片的HPMCAS包覆过程分重复5次。最后,将包覆有HPMCAS聚合物膜的药片置烘箱中干燥1h,备用。然后,在100r/min的搅速下,将以上所得药片分别在模拟胃液(pH =1.2,HCl水溶液)和模拟肠液(pH=7.4,磷酸氢钾和磷酸二氢钾的缓冲溶液)中研究药物缓释行为,实验温度控制在37℃。用WFZ-26A型紫外可见分光光谱仪测定溶液中释放出来的6-巯基嘌呤的浓度,并按以下公式确定药物释放率。药物释放率=(释放过程中游离的药物质量/负载的药物质量)×100%。
1.2.4 材料表征 透射电镜(TEM)测试于日立H 600透射电镜仪进行,具体操作:首先把少量样品放入称量瓶内,乙醇作分散剂,超声振荡20min后,用洁净的滴管取一滴于铜网上,干燥后进行观察,操作电压为200kV。
红外光谱在FTS175C-UMA500型傅利叶红外光谱仪(美国Bio-Rad公司)上测得,光谱分辨率为4cm-1,扫描累加128次。采用KBr压片法进行测定。
X-射线衍射(XRD)测试于日本理学(Rigaku)D/max-γA型X射线衍射仪进行,使用CuKα辐射(λ=0.154 2nm),金属Ni滤波,石墨单色器,电压40kV,电流30mA,闪烁记数器记录强度。
N2吸附脱附和孔分布在美国Tristar 3000自动物理吸附仪上进行。样品在80℃和10-6mm Hg下脱气12h后,在-196℃下进行测定,并由Brunauer-Emmett-Teller(BET)方程计算样品的比表面积,用Barrett-Joyner-Halenda(BJH)方法和N2吸附-脱附曲线中的脱附分支计算材料的孔分布。
2 结 果
2.1 SBA-15介孔分子筛的材料表征与其负载6-MP前后的XRD图 图1是SBA-15介孔分子筛透射电镜图。由图可见,本文所合成的SBA-15长度约为10~20m。图2是负载6-MP前后的SBA-15介孔分子筛的XRD图,由图可见,SBA-15在负载6-MP前后均在2θ=1.0°左右存在一个六方晶系d100衍射主峰。

图1 SBA-15介孔分子筛的透射电镜图
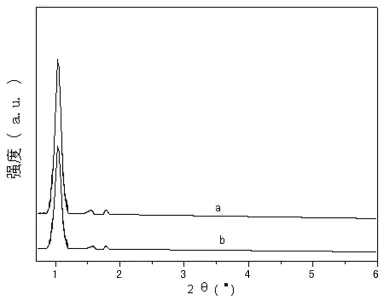
图2 SBA-15介孔分子筛的XRD图
2.2 SBA-15介孔分子筛的主要红外吸收峰变化与织构参数和药物负载量 表1列举了SBA-15介孔分子筛在吸附6-MP前后的主要红外特征吸收峰的变化。由表1可见,纯SBA-15介孔分子筛在3 462.0、1 648.0、1 089.0、971.1和801.8cm-1出现特征吸收峰。其中,3 462.0cm-1属于分子筛表面吸附水的O-H伸缩振动,1 648.0cm-1属于吸附水的O-H弯曲振动,1 089.0cm-1属于 Si-O 的不对称伸缩振动,971.1cm-1和801.8cm-1属于SiO-H 的弯曲振动[10]。当SBA-15介孔分子筛吸附6-MP后,其表面除了依然有上述硅骨架的特征峰外,还在2 590.0cm-1和1 588.0cm-1出现了新的特征峰。其中,2 590.0cm-1属于6-MP的S-H伸缩振动,1 588.0cm-1属于-C=N-的伸缩振动[12]。根据UV/Vis所测得的浓度,计算出6-MP在SBA-15介孔分子筛上的药物负载量为10.4%。表2列举了SBA-15介孔分子筛在吸附6-MP前后的主要织构参数的变化。药物负载后,分子筛的比表面由429.4m2/g降为401.8 m2/g,孔容由0.847cm3/g降为0.802cm3/g,孔径由6.8nm降为6.4nm。
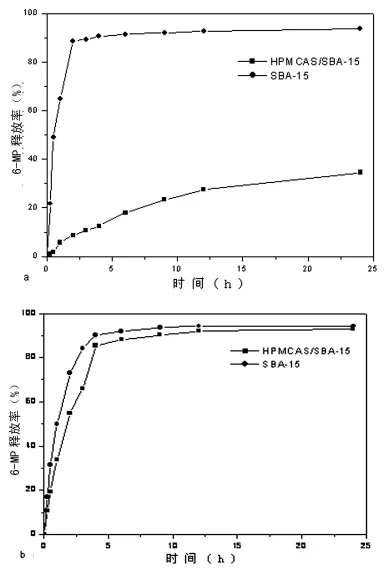
图3 6-MP在纯SBA-15和 HPMCAS/SBA-15中的释放曲线
2.3 两种载药粒在模拟胃液、肠液中的缓释和膜的干燥温度对药物释放的影响 SBA-15载药粒和 HPMCAS/SBA-15载药粒在模拟胃液和模拟肠液中的缓释行为见图3。膜的干燥温度对药物释放行为的影响见图4。
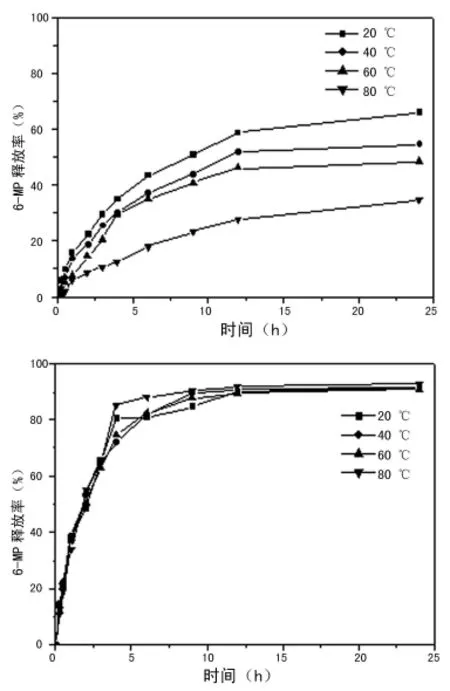
图4 膜的不同干燥温度对6-MP在HPMCAS/SBA-15中的释放影响
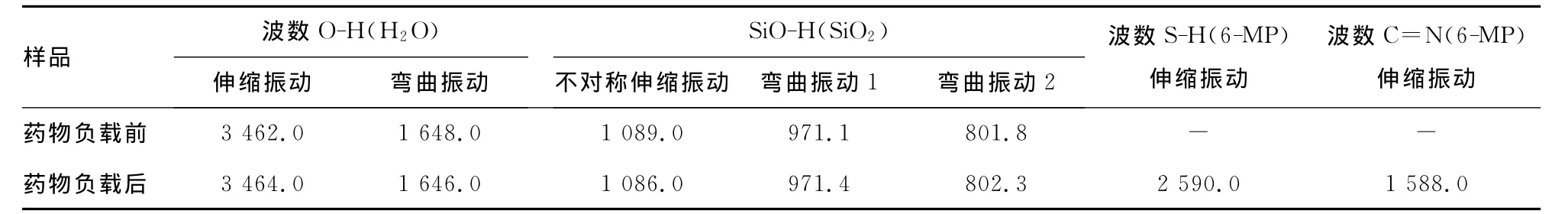
表1 SBA-15介孔分子筛的主要红外吸收峰(cm-1)
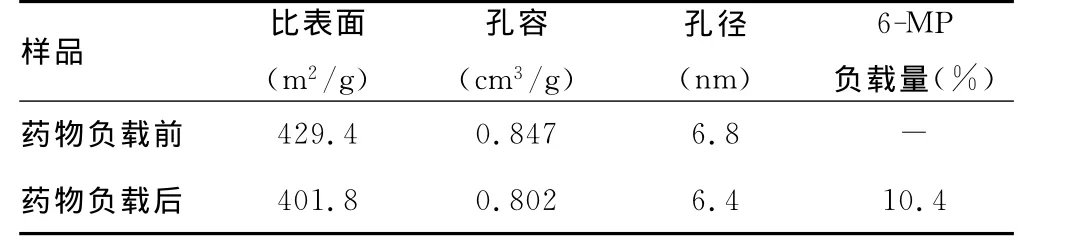
表2 SBA-15介孔分子筛的结构参数和药物负载量
3 讨 论
图1表明本文合成的介孔分子筛具有直径均一的棒状结构。图2中SBA-15出现的d100衍射峰,表明样品长程有序的六方孔道结构已经形成,且与文献报道一致[13]。另外,SBA-15在负载6-MP后,其XRD图基本不变,表明6-MP在SBA-15负载并不会改变分子筛的有序结构。
表1中归属于6-MP的特征峰的出现,意味着6-MP已成功地负载到介孔SBA-15的表面。在表2中,分子筛在吸附药物后,其比表面、孔径和孔容都有不同程度的减小,这可能是由于药物6-MP分子负载到介孔SBA-15的孔道内的缘故。另外,根据UV/Vis所测得的浓度,计算出6-MP在SBA-15介孔分子筛上的药物负载量为10.4%。
从图3a中可以看到,未包覆HPMCAS的SBA-15载药粒在模拟胃液中释放6-MP的速度很快,而 HPMCAS包覆的SBA-15载药粒在模拟胃液中释放6-MP的速度较慢。这表示HPMCAS/SBA-15可以很好的延缓6-MP在模拟胃液中的释放速度。另外,本研究发现,在模拟肠液中,药物缓释过程基本不受所包覆的HPMCAS膜层的影响,包覆前后的药物缓释曲线变化不大,6-MP在模拟肠液中均可快速释放(图3b)。由此可见,该药物缓释系统,不仅可以明显延缓6-MP在胃液中的释放速度,而且又不影响6-MP在肠液中的释放,因而是一种理想的pH敏感载体。
另外,本研究考察了膜的干燥温度对药物释放行为的影响[14]。从图4a可见,样品干燥温度越高,6-MP的释放速度越慢。而在模拟肠液中,本研究发现制样时的干燥温度对6-MP的释放速度基本没有影响,6-MP在短时间内均可快速释放(图4b),这主要是因为HPMCAS在模拟肠液中,其表面的静电斥力起主导作用,可使其快速溶解的缘故[15]。
综上所述,本文通过简单的提拉镀膜的方法,将HPMCAS成功包覆于负载有6-MP的SBA-15药片的表面,制备了pH敏感型药物缓释材料HPMCAS/SBA-15,并且考察了其在模拟胃液和模拟肠液中的缓释行为。研究结果发现,HPMCAS/SBA-15能够有效地延缓抗癌药物6-MP在模拟胃液中的释放速度,且不影响药物在模拟肠液中的释放速度,是一种良好的pH敏感型药物缓释材料,有望在肠道肿瘤治疗的主动靶向和控制释药方面取得应用。
[1] 张波,徐小薇,曾学军,等.巯嘌呤甲基转移酶活性对硫唑嘌呤中间代谢物6-巯基嘌呤药动学的影响[J].中国药学杂志,2006,41(14):1093-1096.
[2] 冶保献,木合塔尔·吐尔洪,曲松.抗癌药物6-巯基嘌呤与DNA相互作用的电化学研究[J].分析科学学报,2004,20(4):364-366.
[3] Angelos S,Johansson E,Stoddart JF,et al.Meslostructured silica supports for functional materials and molecular machines[J].Adv Funct Mater,2007,17(14):2261-2271.
[4] Vallet-Regi M,Rámila A,Del Real RP,et al.A new property of MCM-41:Drug delivery system[J].Chem Mater,2001,13(2):308-311.
[5] Radu DR.,Lai CY,Jeftinija K,et al.A polyamidoamine dendrimer-capped mesoporous silica nanosphere-based gene transfection reagent[J].J Am Chem Soc,2004,126(41):13216-13217.
[6] Song SW,Hidajat K,Kawi S.Functionalized SBA-15materials as carriers for controlled drug delivery:Influence of surface properties on matrix-drug interactions[J].Langmuir,2005,21(21):9568-9575.
[7] Horcajada P,Ramila A,Gerard F,et al.Influence of superficial organic modification of MCM-41matrices on drug delivery rate[J].Solid State Sci,2006,8(10):1243-1249.
[8] 董贝贝,李彩霞,李永,等.介孔分子筛SBA-15的研究进展 [J].化学研究,2012,23(4):97-100.
[9] 陈如大,任非,李国锋,等.紫杉醇聚氰基丙烯酸正丁酯纳米粒制备研究 [J].南方医科大学学报,2010,30(4):763-766,770.
[10]Yang Q,Wang S,Fan P,et al.pH-Responsive Carrier System Based on Carboxylic Acid Modified Mesoporous Silica and Polyelectrolyte for Drug Delivery [J].Chem Mater,2005,17(24):5999-6003.
[11]邵自强,郑一平,李永红,等.醋酸羟丙基甲基纤维素琥珀酸酯的性能表征 [J].中国药学杂志,2005,40(11):846-849.
[12]Zhao DY,Feng JL,Huo QS,et al.Triblock copolymer syntheses of mesoporous silica with heriodic 50to 300 angstrom pores[J].Science,1998,279(5350):548-552.
[13]任宏江,王雄斌,王渭娜.2,6-二巯基嘌呤异构体红外光谱的量子化学理论研究 [J].西安文理学院学报:自然科学版,2008,11(1):72-76.
[14]徐武军,高强,徐耀,等.基于 HPMCP包覆介孔SBA-15的pH 敏感药物缓释系统[J].化学学报,2008,66(14):1658-1662.
[15]Qiu Y,Park K.Environment-sensitive hydrogels for drug delivery[J].Adv Drug Deliv Rev,2001,53(3):321-339.
