麻黄水提物雾化吸入对哮喘小鼠气道炎症的影响*
2013-08-24王宋平
王 娇,熊 瑛,熊 彬,王宋平△
(1.四川省崇州市人民医院呼吸内科 611230;2.泸州医学院附属医院呼吸内科,四川 泸州 646000)
支气管哮喘(简称哮喘)是由多种细胞和细胞组份参与的气道慢性炎症性疾病,糖皮质激素是目前治疗哮喘的主要方法,可以多途径抑制哮喘气道炎症,但无法治愈,长期使用可产生不良反应,寻求更安全、有效的哮喘防治方法是当前亟待解决的重要课题。麻黄作为治疗咳喘病之要药,具有发汗解表、宣肺平喘、利尿消肿之功效[1],但有关麻黄水提物雾化吸入对哮喘气道炎症的影响尚缺乏深入研究。本课题以哮喘小鼠模型为研究对象,观察麻黄水提物雾化吸入对哮喘小鼠气道炎症和白细胞介素-13(IL-13)与嗜酸性粒细胞趋化因子(Eotaxin)表达的影响,为临床拓宽麻黄治疗哮喘的新途径提供实验和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 24只5~6周龄健康雌性BALB/c小鼠,体质量16~20g(购自重庆医科大学实验动物中心),在泸州医学院附属医院中心实验室动物房饲养。
1.1.2 主要试剂与仪器 卵清清蛋白(OVA)购自美国Sigma公司,免疫组化试剂盒、DAB显色试剂购自武汉博士德生物工程有限公司,小鼠IL-13、Eotaxin ELISA试剂盒购自北京天根生化科技有限公司,兔抗小鼠IL-13、Eotaxin多克隆抗体购自上海天呈科技有限公司。超声雾化器:广东汕头光电医疗器械厂产品,电子天平:上海民桥精密科学仪器有限公司,酶标仪:美国Thermo产品,低温高速离心机:上海安亭科学仪器厂产品,电热恒温鼓风干燥箱:上海精宏实验设备有限公司产品,倒置相差显微镜:日本Olympus产品。
1.2 方法
1.2.1 麻黄水提物的制备 参照文献[2]将麻黄50g(购于泸州圣杰药房)加入500mL纯净水浸泡30min后,煎制1h,浓缩成浓度相当于含生药1g/mL的水煎剂,贮存于4℃冰箱备用。
1.2.2 动物分组及建立哮喘模型 按照随机数字表法将小鼠随机分为3组:正常对照组、哮喘模型组、麻黄雾化吸入组(麻黄组),每组8只。哮喘模型的建立参考文献方法[3-4]:除正常对照组外,哮喘模型组和麻黄组小鼠在第0、7天腹腔注射卵蛋白抗原液0.2mL(含100μg卵蛋白和1mg氢氧化铝)致敏,致敏后第14天经鼻吸入2%卵蛋白生理盐水溶液激发,每次30min,1次/天,连续7d。正常对照组用等量生理盐水代替卵蛋白抗原液进行腹腔注射和经鼻吸入致敏和激发。
1.2.3 给药方法 麻黄组小鼠在每次经鼻吸入卵蛋白抗原液激发前1h予以麻黄水提液雾化吸入30min,2次/天,连续7 d。正常对照组和哮喘模型组小鼠用等量生理盐水代替麻黄水提液雾化吸入,吸入方法和时间同麻黄组。
1.2.4 支气管肺泡灌洗液(BALF)细胞计数 各组小鼠末次给药结束后24h内用戊巴比妥腹腔注射麻醉小鼠后,常规消毒固定,暴露气管行气管插管,用PBS缓冲液0.8mL灌洗双肺,反复抽吸3次,回收灌洗液,回收率大于或等于80%为合格标本。BALF经4℃1 500r/min离心10min后,取细胞沉淀用PBS液重悬,细胞悬液注入计数池,在显微镜下计数细胞数,再换算成每升BALF的白细胞(WBC)总数;另取细胞悬液涂于载玻片上,经姬姆莎染液染色后计数嗜酸性粒细胞(EOS)。
1.2.5 支气管肺组织病理切片及HE染色 取左肺组织于4%多聚甲醛溶液固定,常规组织脱水、透明、浸蜡、包埋、切片,厚度5μm、HE染色,光镜下观察支气管及其周围组织的病理改变。
1.2.6 免疫组化法检测支气管肺组织IL-13、Eotaxin的表达 支气管肺组织切片采用链霉菌抗生物素蛋白-过氧化物酶连结(SP)法行免疫组织化学染色,操作步骤按试剂盒说明书进行,主要步骤如下:石蜡切片常规二甲苯脱蜡,梯度酒精脱水,3%H2O237℃孵育10min灭活内源性过氧化物酶,置0.01mol/L枸橼酸缓冲液(pH 6.0)中煮沸修复抗原,正常羊血清工作液封闭,37℃孵育10min,滴加1∶100兔抗鼠多克隆抗体(一抗)4℃孵育过夜(用PBS液代替一抗作阴性对照),PBS冲洗3次,每次5min,滴加生物素标记羊抗兔血清(二抗),37℃孵育30min,PBS冲洗3次,每次5min,滴加辣根过氧化物酶标记链霉素卵白素工作液,37℃孵育30min,PBS冲洗3次,每次5min,二氨基联苯胺(DAB)染色,自来水冲洗苏木素复染,常规脱水、透明、干燥、封片。染色结果判断标准参考文献[5]:在光镜下观察出现棕黄色或黄褐色染色的细胞判定为阳性细胞,每张切片随机选取5个高倍视野(×400)进行平均光密度测定,取其平均值作为该片代表值,采用Image-pro plus 6.0图像分析系统计算平均光密度值(AOD)。
1.2.7 酶联免疫吸附试验(ELISA)法测定IL-13、Eotaxin的浓度 取右侧支气管肺组织100mg加入1mL PBS液研磨匀浆后,3 000r/min离心20min后,取上清液,采用ELISA法测定上清液中IL-13、Eotaxin蛋白的浓度。操作步骤按试剂盒说明书进行,在450nm波长测量各孔样品的吸光度(OD)值,根据OD值计算出各样品中IL-13、Eotaxin蛋白的浓度。
1.3 统计学处理 采用SPSS17.0软件进行统计学分析,计量资料采用表示。组间均数比较采用单因素方差分析(方差不齐采用Games Howell法,方差齐同采用LSD法进行两两比较),两变量的相关分析采用Bivariate过程的等级Pearson相关法。以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠一般状况 哮喘模型组和麻黄组小鼠激发后可见其烦躁不安,呼吸急促,抓鼻,打喷嚏,行动迟缓或俯卧不动,但麻黄组症状较轻,正常对照组无上述表现。
2.2 BALF中 WBC和EOS计数 哮喘模型组和麻黄组BALF中WBC、EOS计数明显高于正常对照组,差异有统计学意义(P<0.01);但麻黄组BALF中 WBC、EOS计数均低于哮喘模型组,差异有统计学意义(P<0.01),见表1。
表1 3组小鼠BALF中WBC及EOS计数比较

表1 3组小鼠BALF中WBC及EOS计数比较
▲:P<0.01,与正常对照组比较;★:P<0.01,与哮喘模型组比较。
组别WBC EOS正常对照组3.75±0.43 0.03±0.01哮喘模型组 17.74±0.79▲ 1.81±0.05▲麻黄组 8.57±0.51▲★ 0.52±0.03▲★
2.3 支气管肺组织病理形态学改变 正常对照组见气道上皮完整,支气管、细支气管壁平滑肌层较薄,管腔规则,无明显分泌物贮留,黏膜皱襞矮平,肺泡间隔正常,周围无明显炎症细胞浸润;哮喘模型组支气管上皮有脱落不完整,气道上皮细胞增生肥大,管腔有明显狭窄,平滑肌增厚,支气管周围大量炎症细胞浸润,肺泡间隔增厚,管腔内可见黏液栓;麻黄组支气管周围及肺泡区炎症细胞浸润及管腔黏液栓均较哮喘模型组减少,支气管壁肺泡间隔增厚及管腔狭窄均较哮喘模型组减轻,见图1。
2.4 支气管肺组织IL-13、Eotaxin免疫组化染色结果 IL-13、Eotaxin阳性表达产物主要位于支气管上皮细胞及间质中炎症细胞的细胞膜或细胞质,呈棕黄色或黄褐色颗粒样分布。正常对照组可见气道黏膜、黏膜下层有少量呈棕黄色的阳性细胞;哮喘模型组可见气道黏膜、黏膜下层、血管周围、肺泡区有大量呈棕黄色的阳性细胞,以气道黏膜上皮细胞、血管内皮细胞、平滑肌细胞、炎症细胞表达明显。通过分析比较AOD,哮喘组表达均明显高于正常对照组(P<0.01);麻黄组表达相对于哮喘模型组均有减轻,差异有统计学意义(P<0.01),见图2、3,表2。
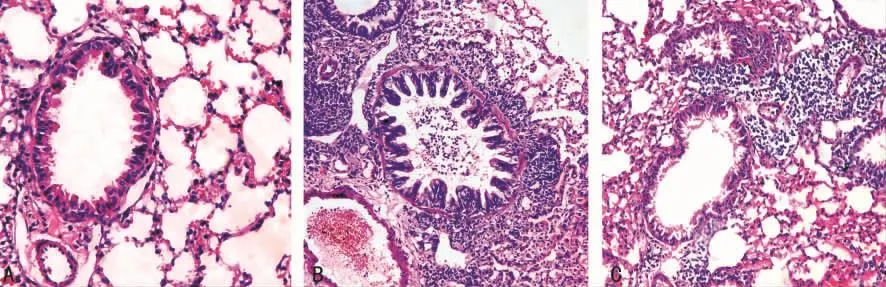
图1 3组支气管肺组织病理形态学改变(HE×200)

图2 3组支气管肺组织IL-13蛋白表达(SP×200)
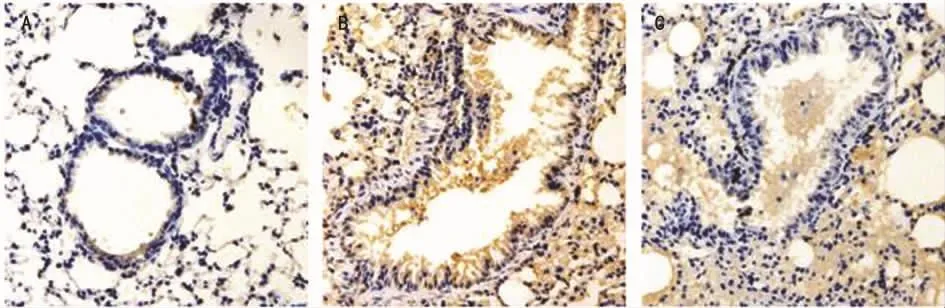
图3 3组支气管肺组织Eotaxin蛋白表达(SP×200)
表2 3组支气管肺组织IL-13、Eotaxin蛋白表达比较
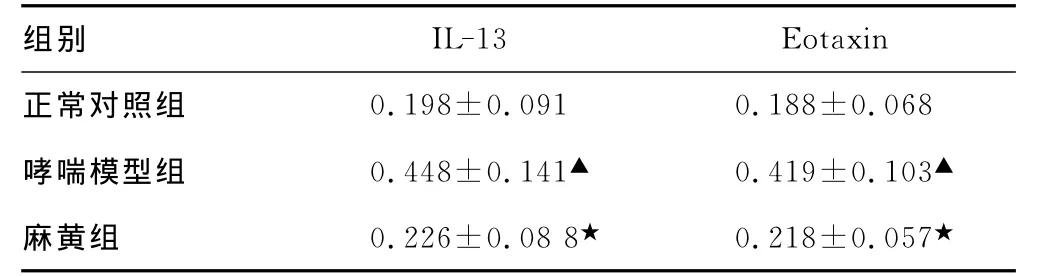
表2 3组支气管肺组织IL-13、Eotaxin蛋白表达比较
▲:P<0.01,与正常对照组比较;★:P<0.01,与哮喘模型组比较。
组别IL-13 Eotaxin正常对照组0.198±0.091 0.188±0.068哮喘模型组 0.448±0.141▲ 0.419±0.103▲麻黄组 0.226±0.08 8★ 0.218±0.057★
2.5 ELISA法测定IL-13、Eotaxin浓度结果比较 哮喘模型组和麻黄组支气管肺组织匀浆上清液中IL-13、Eotaxin浓度明显高于正常对照组(P<0.01),但麻黄组上清液中IL-13、Eotaxin的浓度低于哮喘模型组,差异有统计学意义(P<0.01),见表3。
表3 3组支气管肺组织匀浆上清液中IL-13、Eotaxin浓度比较

表3 3组支气管肺组织匀浆上清液中IL-13、Eotaxin浓度比较
▲:P<0.01,与正常对照组比较;★:P<0.01,与哮喘模型组比较。
组别IL-13 Eotaxin正常对照组1 145.993±134.669 717.355±60.491哮喘模型组 3 489.909±235.925▲ 1 262.709±114.516▲麻黄组 2 470.610±138.882▲★ 918.608±58.127▲★
2.6 相关性分析 直线相关分析显示,哮喘模型组EOS计数与IL-13、Eotaxin表达呈正相关(r=0.746、0.712,P=0.033、0.048);麻黄组 EOS计数与IL-13、Eotaxin表达也呈正相关(r=0.729、0.734,P=0.040、0.038);IL-13与 Eotaxin在哮 喘组(r=0.803,P=0.028)或麻黄组(r=0.761,P=0.016)的表达均呈正相关。
3 讨 论
哮喘是由多种细胞参与的气道炎症和气道高反应性为特征的慢性炎症性疾病[6]。EOS是参与气道炎症的主要细胞,EOS合成、释放的各种炎症介质导致支气管平滑肌收缩,微血管渗漏和黏液分泌增加[7-8]。Eotaxin可趋化EOS聚集到气道上皮并活化、释放各种炎症介质导致气道上皮损伤[9-10]。IL-13是与哮喘发病直接相关的Th2细胞因子,与气道黏液高分泌和气道高反应性密切相关[11-12],IL-13与 Eotaxin相互作用,共同调节EOS在气道的募集、活化,使气道炎症的持续时间延长[13-14]。
麻黄具有发汗解表、宣肺平喘、利尿消肿之功效。麻黄碱是其平喘的主要成分,可直接兴奋支气管平滑肌细胞的β受体,舒张支气管平滑肌。我们先前的研究结果表明,给予麻黄水提物灌胃预处理哮喘豚鼠,气道上皮损伤、脱落及炎症细胞浸润明显减轻,提示麻黄灌胃具有抑制哮喘豚鼠气道炎症的作用[14],但麻黄口服给药虽对支气管平滑肌有舒张作用,但同时对横纹肌也有兴奋作用,使心率加快,外周血管收缩,血压升高,剂量过大可导致失眠,心烦不安和颤抖[15]。吸入疗法是治疗呼吸系统疾病的常用方法,与口服给药相比,雾化吸入给药具有局部药物浓度高、起效迅速、所需剂量小、全身不良反应少等优点[16]。
本研究中观察到哮喘小鼠BALF中WBC、EOS计数较正常对照组明显增高,气道上皮细胞增生肥大,大量炎症细胞浸润,管腔内可见黏液栓,支气管肺组织中IL-13、Eotaxin的表达量明显高于正常对照组(P<0.01),与文献报道一致[17]。给予麻黄水提物雾化吸入干预后,结果显示BALF中 WBC、EOS计数较哮喘模型组小鼠明显减少(P<0.01),气道上皮炎症程度减轻,支气管及周围炎症细胞浸润减少,支气管肺组织中IL-13、Eotaxin蛋白表达减弱,其表达量明显低于哮喘模型组小鼠(P<0.01),相关性分析显示,BALF中EOS计数与支气管肺组织中IL-13、Eotaxin的表达量呈正相关。本研究结果表明,哮喘小鼠支气管肺组织中存在IL-13、Eotaxin蛋白表达上调,麻黄水提取物经雾化吸入途径给药可抑制哮喘小鼠的气道炎症和EOS浸润,抑制IL-13与Eotaxin蛋白的表达,这可能是其治疗支气管哮喘的作用机制之一。
[1] 马勇,徐暾海,徐海燕,等.麻黄研究进展[J].吉林中医药,2008,28(10):777-779.
[2] 魏凤环,罗佳波,沈群,等.麻黄汤及单味麻黄中麻黄碱与伪麻黄碱在小鼠组织中的药动学研究[J].中草药,2004,35(7):781-784.
[3] 李睿,刘恩梅,杨锡强,等.不同饲养环境、种属、佐剂及激发方法对小鼠哮喘炎症的影响[J].重庆医学,2006,35(1):43-44.
[4] 沈璐,赖克方,姜华,等.不同激发方式对小鼠过敏性支气管哮喘模型的影响[J].中华哮喘杂志:电子版,2009,3(6):5-8.
[5] 黄英,张雷,刘国祥.地塞米松对支气管哮喘大鼠模型肺内EOTAXIN表达的影响[J].重庆医学,2004,33(10):1506-1507.
[6] Bateman ED,Hurd SS,Barnes PJ,et al.Global strategy for asthma management and prevention:GINA executive summary[J].Eur Respir J,2008,31(1):143-178.
[7] Nakagome K,Nagata M.Pathogenesis of airway inflammation in bronchial asthma[J].Auris Nasus Larynx,2011,38(5):555-563.
[8] Calderon C,Rivera L,Hutchinson P,et al.T-cell cytokine profiles are altered in childhood asthma exacerbation[J].Respirology,2009,14(2):264-269.
[9] Zietkowski Z,Skiepko R,Tomasiak-Lozowska MM,et al.Eotaxin in exhaled breath condensate of allergic asthma patients with exercise-induced bronchoconstriction[J].Respiration,2011,82(2):169-176.
[10]Zietkowski Z,Skiepko R,Tomasiak-Lozowska MM,et al.Airway inflammation and eotaxin in exhaled breath condensate of patients with severe persistent allergic asthma during omalizumab therapy[J].Adv Med Sci,2011,56(2):318-322.
[11]Woodruff PG,Modrek B,Choy DF,et al.T-helper type 2-driven inflammation defines major subphenotypes of asthma[J].Am J Respir Crit Care Med,2009,180(5):388-395.
[12]Mitchell J,Dimov V,Townley RG.IL-13and the IL-13 receptor as therapeutic targets for asthma and allergic disease[J].Curr Opin Investig Drugs,2010,11(5):527-534.
[13]Nguyen TH,Casale TB.Immune modulation for treatment of allergic disease[J].Immunol Rev,2011,242(1):258-271.
[14]熊瑛,熊彬,王宋平,等.麻黄水提物对哮喘豚鼠气道炎症和气道上皮细胞STAT1信号传导影响[J].西部医学,2008,20(5):913-916.
[15]Lee MR.The history of Ephedra(ma-huang)[J].J R Coll Physicians Edinb,2011,41(1):78-84.
[16]苏远力,郑劲平,高怡.我国医院使用雾化吸入治疗状况的问卷调查和分析[J].中华结核和呼吸杂志,2010,33(2):140-141.
[17]Yuk JE,Lee MY,Kwon OK,et al.Effects of astilbic acid on airway hyperresponsiveness and inflammation in a mouse model of allergic asthma[J].Int Immunopharmacol,2011,11(2):266-273.
