降钙素原评估呼吸机相关肺炎患者预后的作用
2013-08-24廖雪莲邓一芸金晓东张中伟
廖雪莲,康 焰,邓一芸,金晓东,张中伟,周 琰
(四川大学华西医院重症医学科,成都 610041)
呼 吸 机 相 关 性 肺 炎 (ventilator-associated pneumonia,VAP)是指机械通气(MV)超过48h后发生的新的感染性肺实质炎症。VAP患者的病死率为24%~50%,其住院日明显延长、医疗费用急剧增加[1-2]。目前对VAP患者预后以及治疗反应的评估主要依赖于临床症状、影像学、病原学结果的综合考虑。近年,有研究发现降钙素原(PCT)在早期识别感染,判断病情严重程度方面比其他的生物学标记有着更好的一致性[3-5]。因此,使用PCT的动态监测来评估VAP患者的预后,有可能尽早识别高危患者,提醒临床医生及时调整治疗。本研究通过对确诊为VAP的患者进行PCT的早期动态监测,使用某一天的绝对值或者动态变化值,来评估PCT在VAP患者预后中的作用,并与各种临床评分[急性生理和慢性健康评分(APATCHEⅡ)、全身感染性相关器官功能衰竭评分(SOFA)和临床肺部感染评分(CPIS)评分]以及C反应蛋白(CRP)进行比较,寻找预测VAP患者预后的最佳指标。
1 资料与方法
1.1 一般资料 以2009年6月1日至10月1日收入四川大学华西医院重症医学科,年龄大于或等于18岁,ICU住院时间大于或等于72h,诊断为VAP的患者作为研究对象。排除入ICU时有明确医源性肺部感染以及肺癌晚期患者。VAP诊断标准[1]:疑诊为VAP的患者必须满足以下1、2两条标准,确诊患者以下3条标准都应满足。(1)胸片或胸部CT有持续或新出现浸润性阴影。(2)以下至少两条,①体温(T)≥38.0℃,或T≤36.0℃;②白细胞超过10 000或小于4 000。(3)脓性痰,加上以下任意一条,①支气管吸引物培养结果大于106cfu/L;②血培养出可能的致病菌。
1.2 方法 研究期间,由1名专科的ICU医生对符合纳入标准的患者进行每日临床评估,一旦有患者疑诊为VAP,当天(D1)立即作支气管吸引物培养、血培养、胸片、PCT、CRP等检查,并分别于第4天(D4)、第7天(D7)重复上述测量。同时计算上述时间点的CPIS、APACHEⅡ、SOFA评分。PCT检测方法采用法国生物梅里埃公司提供的全自动免疫分析法(VIDAS BRAHMS PCT)。可测量范围0.05~200ng/mL,精确度0.09ng/mL。抽取的血标本均于30min内送入本院微生物室进行检查。记录VAP患者入ICU时以及D1、D4、D7的生命体征、APACHEⅡ、SOFA、CPIS评分、PCT、CRP等指标以及28d内的临床结局。
1.3 统计学处理 采用SPSS15.0软件进行统计学分析。连续变量使用或者中位数(四分位间距)表示。两组之间的可比性分析,对于分类变量使用χ2检验或者Fisher′s检验,连续变量使用非参数Mann-Whitney U检验或者成组t检验。使用单因素分析来识别VAP死亡相关的危险因素。对于两组有统计学意义的指标分别作ROC曲线计算最佳的截断值,并计算曲线下面积(AUC)、预测VAP死亡的敏感性、特异性等指标。把单因素分析中有统计学意义的指标纳入到多因素Logistic回归模型,识别VAP死亡的独立危险因素。以P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的特点 在372例机械通气(mechanical ventilation,MV)≥48h的患者中,确诊为VAP的患者有42例,其中有1例患者因中途家属放弃治疗失访,1例在VAP治愈(已经停止MV和抗生素治疗)后因为心脏原因猝死而没有纳入到最终的统计分析中去。纳入分析的40例患者主要诊断分别为术后呼吸衰竭14例,脑血管意外5例,颅脑创伤4例,神经肌肉疾病3例,多发创伤5例,重症急性胰腺炎5例,肝硬化1例,肠系膜血栓形成1例。死亡组与生存组患者在进入研究时的年龄为[(53.18±13.761)岁与(51.86±14.169)岁]、性别(男女比例9∶2与21∶8)、SOFA 评分[(10.45±4.677)分与8.52±2.681)分]、CPIS评分[(1.82±1.079)分与(1.72±1.162)分]、PCT[1.00(0.48,3.68)mg/mL 与 0.30(0.10,3.90)ng/mL]、CRP[(117.40±67.522)与(138.50±76.877)mg/L],差异均无统计学意义(P>0.05),死亡组的 APACHEⅡ评分高于生存组[(23.45±6.817)与(18.52±5.131)分,P=0.046)]。VAP患者的致病菌以革兰阴性菌(32例)为主,其中铜绿假单孢菌(14株)和鲍曼不动杆菌(12株)最常见。革兰阳性菌感染患者2例[均为耐甲氧西林金黄色葡萄球菌(MRSA)],有6例患者为混合细菌感染。
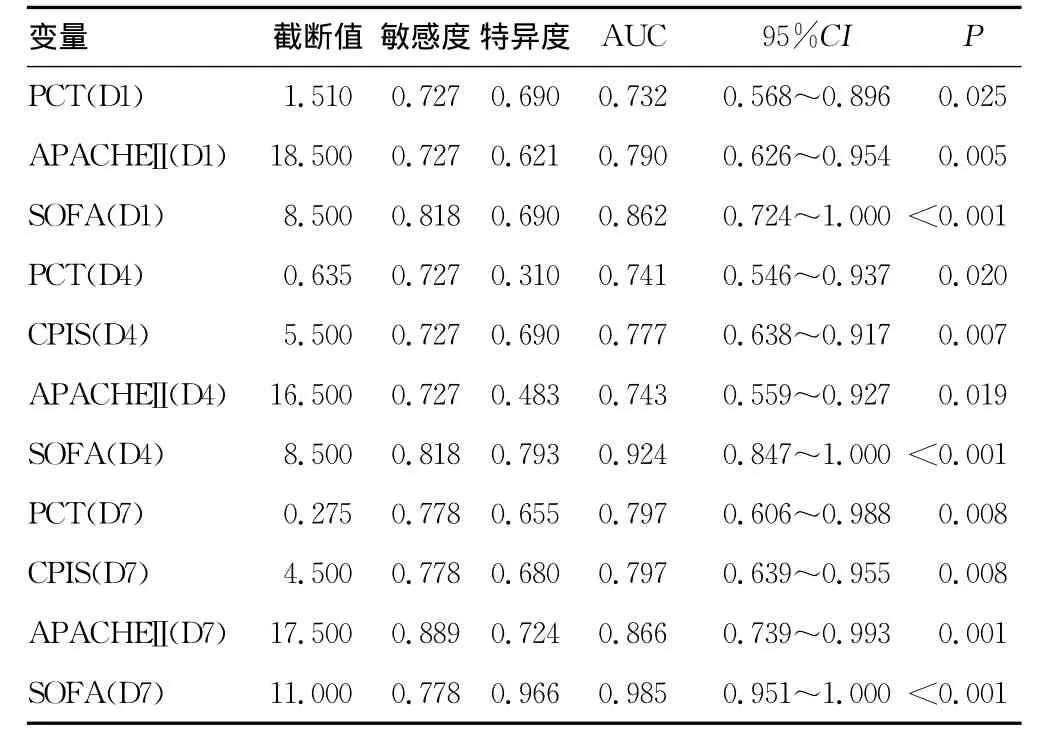
表1 PCT和其指标预测VAP患者28d死亡准确性
2.2 PCT和其他指标的绝对值在预测VAP患者死亡中的作用 在VAP确诊当天(D1),PCT、APACHEⅡ、SOFA在两组患者之间差异有统计学意义(P<0.05),CPIS评分在D4和D7时差异有统计学意义(P<0.05),而CRP在以上各个时间点比较差异无统计学意义(P>0.05),见图1。框中黑线为中位数,方框为四分位数间距,上下两个细线之间是1.5倍四分位数间距,之外的数据点位离群值或极值,其中离方框上/下界距离超过四分位数间距1.5倍为离群值,以○表示,超过3倍的为极值,用*表示。把以上组间有差异的指标分别绘制了ROC曲线,计算其在预测VAP死亡中的准确性。结果发现,PCT D1、D4、D7的 AUC值分别为0.732(95%CI:0.568~0.896),0.741(95%CI:0.546~0.937),0.797(95%CI:0.606~0.988),其准确性不如SOFA评分和 APACHEⅡ评分,与CPIS的准确性类似,见表1。
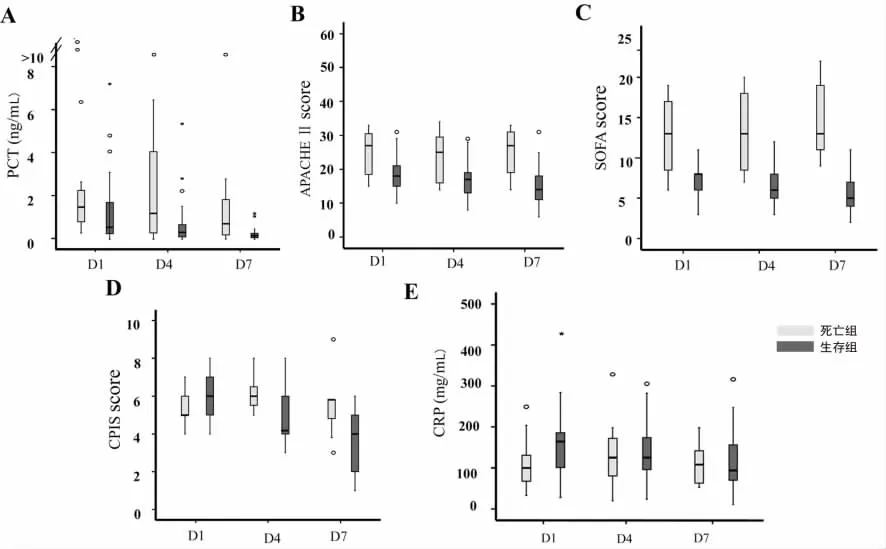
图1 PCT和其他指标的绝对值在两组患者中的动态变化
2.3 PCT和其他指标的动态变化在预测VAP患者死亡中的作用 在动态变化值中,死亡组与生存组的△PCT(D4-D1)、△PCT(D7-D1)、△PCT(D7-D4),分别为(-2.68±16.189与-0.68±1.339)、(-5.64±16.319与-1.14±1.673)、(-2.96±10.484与-0.46±1.107),差异无统计学意义(P>0.05)。两组患者△APACHEⅡ(D7-D4)、△SOFA(D4-D1)、△SOFA(D7-D1)、△SOFA(D7-D4)、△CPIS(D4-D1)、△CPIS(D7-D1)、△CRP(D4-D1)比较,差异有统计学意义(P<0.05)。把单因素分析中有统计学意义的指标放入多因素Logistic回归模型中,只有SOFA(D7)[OR=6.381(95%CI:2.690~15.141)]和 APACHEⅡ(D4)[OR=1.853(95%CI:1.210~1.781)]是预测 VAP患者死亡的独立危险因素。
3 讨 论
本研究发现,虽然PCT D1、D4、D7在VAP死亡组和生存组之间比较差异有统计学意义(P<0.05)。在预测VAP患者死亡准确性的比较中,PCT只有中等程度的准确性(AUC值均小于0.8),其预测作用不如传统的SOFA和APACHEⅡ评分。PCT的动态变化值在两组患者之间差异无统计学意义(P>0.05)。多因素Logistic回归分析中,只有SOFA D7和APACHEⅡD4是预测VAP患者死亡的独立危险因素。这提示在预测VAP患者预后时,使用单一的PCT有局限。
Luyt等[6]的研究发现PCT D1、D3、D7是预测 VAP患者结局不良(定义为:28d内死亡、VAP复发以及继发了肺外感染)的很强的独立危险因素。而Hillas等[7]的研究认为PCT预测患者的结局仅有中等程度的准确性,且PCT D1、D4、D7均不能作为预测VAP预后的独立危险因素。这跟本研究结果类似。Seligman等[8]的研究发现△PCT(D4-D1)[OR=4.43(95%CI:1.08~18.18)]、△CRP(D4-D1)[OR=7.40(95%CI:1.58~34.73)]下降是预测 VAP患者28d生存的独立因素,而本研究并未得出同样的结果。由于研究的人群、VAP诊断标准、PCT测量方法等因素均存在差异,所以导致各个研究得出不一致的结论。
本研究有一定的局限性。(1)样本量比较小,有可能因为没有足够的统计学效能,使某些本来可能有意义的重要指标被忽略掉。(2)纳入的患者,有超过一半以上(21例)的患者在整个研究期间伴发其他部位的感染,PCT可能因此受到影响,但两组患者伴有其他部位感染的发生率类似。(3)确诊VAP的病原学诊断标准没有选择指南推荐的支气管肺泡灌洗液培养或者保护性毛刷取样,但这并不会影响整个研究的结果,因为已经有大样本的研究证明,支气管吸引物培养与侵入性的诊断方法相比较,对VAP患者预后的影响类似[9-10]。
虽然,目前已经有研究根据PCT值来指导VAP患者抗生素使用的随机对照研究[11],根据PCT的低值(<0.5ng/mL)或者下降(较72h前下降大于或等于80%)来减少抗生素的使用,但该研究的干预组(PCT指导组)并不是单纯依靠PCT来调整抗生素,抗生素调整的最终决定权还是根据临床医生的综合判断。所以,PCT的应用仍然需与其他临床指标结合才有可能更好的预测VAP患者的预后以及进行病程监测。
[1] American Thoracic Society,Infectious Disease Society of America.Guidelines for the management of adults with hospital-acquired,ventilator-associated,and healthcare-associated pneumonia[J].Am J Respir Crit Care Med,2005,171(4):388-416.
[2] Lisboa T,Rello J.Diagnosis of ventilator-associated pneumonia:is there a gold standard and a simple approach?[J].Curr Opin Infect Dis,2008,21(2):174-178.
[3] Combes A,Luyt C,Fagon J,et al.Early predictors for infection recurrence and death in patients with ventilator-associated pneumonia[J].Crit Care Med,2007,35(1):146-154.
[4] Povoa P,Coelho L,Almeida E,et al.C-reactive protein as a marker of ventilator-associated pneumonia resolution:a pilot study[J].Eur Respir J,2005,25(5):804-812.
[5] Uzzan B,Cohen R,Nicolas P,et al.Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma:A systematic review and meta-analysis[J].Crit Care Med,2006,34(7):1996-2003.
[6] Luyt CE,Guerin V,Combes A,et al.Procalcitonin kinetics as a prognostic marker of ventilator-associated pneumonia[J].Am J Respir Crit Care Med,2005,171(1):48-53.
[7] Hillas G,Vassilakopoulos T,Plantza P,et al.C-reactive protein and procalcitonin as predictors of survival and septic shock in ventilator-associated pneumonia[J].Eur Respir J,2010,35(4):805-811.
[8] Seligman R,Meisner M,Lisboa TC,et al.Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia[J].Critical Care,2006,10(5):R125.
[9] Ramlrez P,Garcia MA,Ferrer M,et al.Sequential measurements of procalcitonin levels in diagnosing ventilatorassociated pneumonia[J].Eur Respir J,2008,31(2):356-362.
[10]The Canadian Critical Care Trials Group.A randomized trial of invasive diagnostic techniques and for suspected ventilator-associated pneumonia[J].N England J Med,2006,355(25):2619-2630.
[11]Stolz D,Smyrnios N,Eggimann P,et al.Procalcitonin for reduced antibiotic exposure in ventilator associated pneumonia-A randomized study[J].Eur Respir J,2009,34(6):1364-1375.
