携带人金属蛋白酶组织抑制剂1重组腺病毒的构建及在人脐静脉内皮细胞中的表达*
2013-08-24毛用敏赵莉莉崔让庄王佩显
李 汇,毛用敏,赵莉莉,崔让庄,王佩显
(1.天津医科大学 300070;2.天津市胸科医院 300051)
基质金属蛋白酶(matrix metalloproteinase,MMPs)是降解细胞外基质(extracellular matrix,ECM)成分的主要酶系[1],金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMPs)是MMPs的内源性特异性抑制剂[2]。近年研究发现,MMPs/TIMPs的比例失衡与动脉粥样硬化、冠状动脉介入术后再狭窄以及心脏重塑等病理过程密切相关[3]。以腺病毒(adenovirus,AdV)为载体介导TIMP1到靶细胞,调节ECM的生成和降解,从而调节粥样斑块的稳定性可能成为冠心病基因治疗的新方法[4]。本研究构建携带人基质金属蛋白酶组织抑制剂因子1(human tissue inhibitor of matrix melall oprolease-1,hTIMP1)基因片段的重组腺病毒 Ad-hTIMP1[5],并成功感染体外培养的人脐静脉内皮细胞CRL-1730,从而为进一步的在体实验提供平台,为基因治疗动脉粥样硬化,稳定粥样斑块提供靶基因的线索。
1 材料与方法
1.1 材料 AdEasy复制缺陷型腺病毒载体系统(穿梭质粒pAd-Track-CMV和骨架质粒pAdEasy-1)以及包装细胞系人胚肾细胞(human embryonic kidney 293T,HEK293T)购自北京大学实验室;pUCm-T载体质粒,BJ 5183菌株、JM109菌株和DH5α菌株均为本实验室保存。TaqDNA聚合酶为本实验室提取保存,限制性内切酶BglⅡ、NotⅠ和DNA marker购自TakaRa生物工程(大连)有限公司,PacI购自NEB公司;T4 DNA连接酶、高纯度质粒柱式提取试剂盒和脂质体购自Invitrogen公司,胎牛血清(fetal bovine serum,FBS)和 DMEM高糖培养液购自美国Gibco公司;PCR引物由上海生工公司合成。DNA测序由北京三博远志生物工程公司完成。
1.2 腺病毒重组质粒的构建
1.2.1 pUC-hTIMP1重组质粒的构建 Genebank中搜索人TIMP1序列,设计上游引物为:5′-AGA ACC CAC CAT GGC CCC CT-3′;下游引物为:5′-GAT TCA GGC TAT CTG GGA CCG-3′。从人心肌细胞中提取总RNA,反转录PCR(reverse transcription-PCR,RT-PCR)得到人 TIMP1的基因片段,连接到pUCm-T载体质粒中,转化入感受态JM109细胞,NcoI酶切鉴定正确后行二次转化入JM109进行扩增,测序正确后提质粒pUC-hTIMP1。
1.2.2 穿梭质粒 pAdTrack-CMV-hTIMP1的构建 分别用BglⅡ和NotⅠ双酶切pUC-hTIMP1和穿梭质粒pAdTrack-CMV并凝胶回收hTIMP1片段和开环质粒pAdTrack-CMV,连接后转化JM109感受态细胞,酶切鉴定正确后二次转化JM109扩增,PmeⅠ酶切使之线性化,命名为重组质粒pAdTrack-CMV-hTIMP1。
1.2.3 同 源 重 组 构 建 重 组 腺 病 毒 质 粒 pAdEasy-GFP-hTIMP1 电穿孔法(2 500V,5ms)将PemⅠ酶切线性化的pAdTrack-CMV-hTIMP1重组质粒和 pAdTrack-CMV(空载体阴性对照)分别转化到含有pAdEasy-1的电感受态BJ5183中,筛选后BamHI和PacⅠ酶切鉴定。选取重组正确的质粒(pAd-hTIMP1和pAd-Track)在DH5α菌中大量扩增,高纯度质粒柱式提取试剂盒提取质粒,PacⅠ酶切线性化后凝胶回收较大片段。
1.3 重组腺病毒在293T细胞中包装和扩增
1.3.1 阳离子脂质体法将重组腺病毒转染293T细胞进行包装 转染前1d,将2个60mm培养皿中HEK293T细胞调整为0.6×106个细胞/皿,转染当天应用脂质体lipofectamine 2000及Plus reagent将pAd-hTIMP1和pAd-Track转染到两皿中,24h后荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)表达,倒置相差显微镜下观察细胞病变效应(cytopathogenic effect,CPE)。于转染后第9天收集细胞,反复冻融法得到重组腺病毒Ad-hTIMP1和Ad-Track上清液。
1.3.2 包装好的重组腺病毒感染293T细胞进行扩增 取病毒上清液的1/3感染293T细胞,感染后第3天反复冻融法收集重组腺病毒上清液,反复感染4次于293T细胞中扩增病毒到所需滴度。
1.3.3 重组腺病毒的纯化和观察 CsCl密度梯度离心法纯化重组腺病毒颗粒,采用OD260法测定腺病毒的滴度。并用透射电镜观察腺病毒形态。
1.4 腺病毒介导TIMP1在内皮细胞中的表达
1.4.1 分组 体外培养人脐静脉内皮细胞CRL-1730,将之分到6孔板中(2.4×105细胞/孔)。分为空白对照组、Track对照组和TIMP1实验组,每组4个复孔。Ad-Track感染Track对照组,Ad-hTIMP1感染TIMP1实验组。48h后观察并收集细胞。
1.4.2 RT-PCR法扩增细胞TIMP1基因片段,以GAPDH为内参照 采用UNIQ-10柱总RNA抽提试剂盒提取各组人脐静脉内皮细胞CRL-1730中的总RNA,反转录得到cDNA,PCR扩增TIMP1基因片段。2%琼脂糖凝胶电泳检测PCR扩增产物。以电泳条带的灰度代表mRNA含量,目的基因与内参电泳条带灰度比值反应目的基因的相对值。采用Gelpro3.1凝胶成像系统对结果进行分析。
1.5 统计学处理 应用SPSS17.0软件进行统计学数据分析,计量资料以表示。组间比较采用单因素方差分析和LSD检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 pAdEasy-GFP-hTIMP1重组质粒 PacⅠ酶切鉴定 RTPCR法从人心肌细胞中扩增hTIMP1,可以得到637bp的特异带。在pAd-Track-CMV上有2个PacⅠ的酶切位点,将重组子切为一个大片段和一个约4.5kb的小片段(图1)。
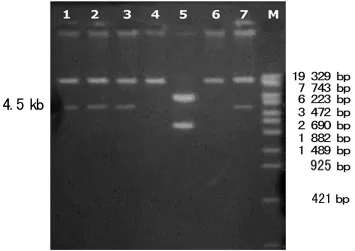
图1 PacⅠ 酶切pAd-hTIMP1和pAd-Track重组质粒
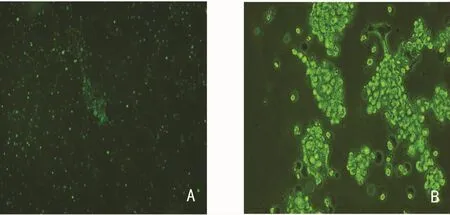
图2 转染Ad-hTIMP1重组腺病毒
2.2 293T细胞中包装并扩增腺病毒 重组腺病毒转染293T细胞后,第4~5天荧光显微镜下可观察到GFP呈“彗星状”改变,感染293T细胞后第3天可以观察到典型的CPE(图2),纯化后OD260法测得重组腺病毒 Ad-hTIMP1的滴度为1.9×1012v.p/mL,对照重组腺病毒pAd-Track的滴度为0.6×1012v.p/mL。透射电镜下见病毒颗粒直径约90nm,呈多面体形状,绝大多数病毒颗粒完整(图3)。腺病毒裂解液TIMP1 PCR,2%琼脂糖凝胶电泳图(图4)。TIMP1实验组内皮细胞TIMP1mRNA的表达(1.062±0.083)明显高于空白对照组(0.449±0.128)和Track对照组(0.365±0.164),P<0.05,见图5。重组腺病毒感染体外培养的人脐静脉内皮细胞人脐静脉内皮细胞CRL-1730(图6)。
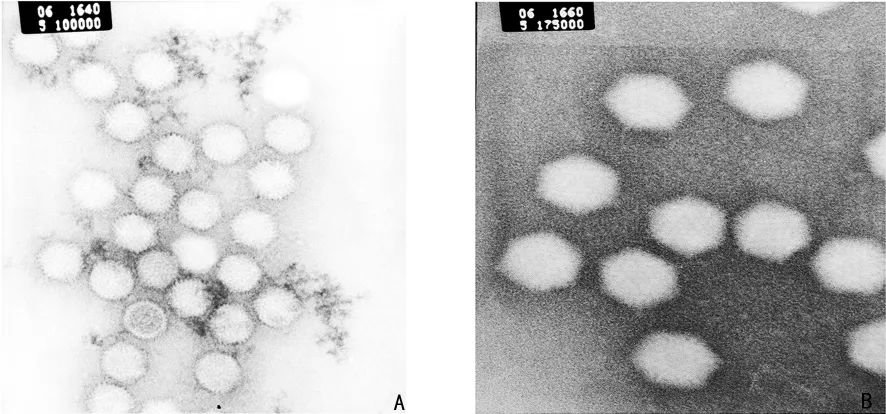
图3 Ad-hTIMP1病毒颗粒透射电镜图
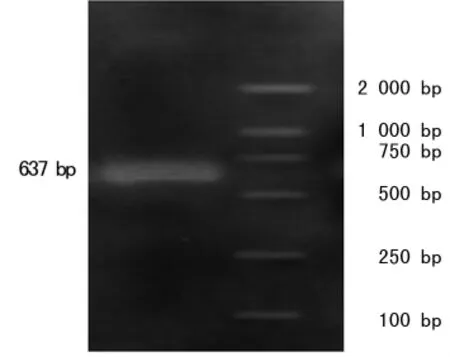
图4 腺病毒裂解液TIMP1PCR扩增片段(可见637bp的特异条带)
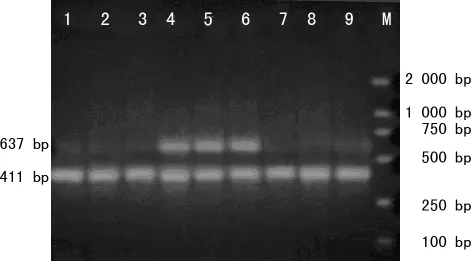
图5 3组TIMP1 2%琼脂糖凝胶水平电泳图
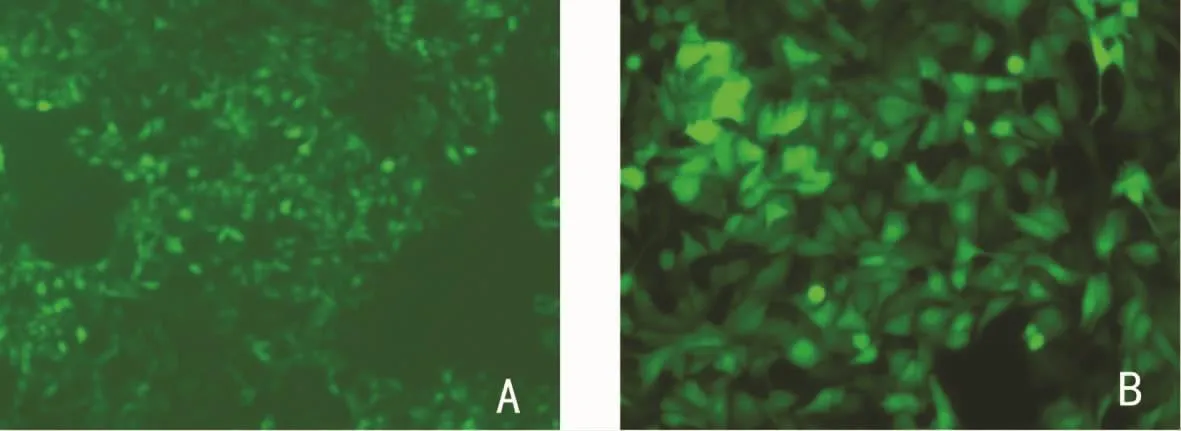
图6 重组腺病毒感染体外培养的人脐静脉内皮细胞人脐静脉内皮细胞CRL-1730荧光表达情况(倒置荧光显微镜)
3 讨 论
MMPs是一类以Zn2+为辅助因子的蛋白水解酶家族,在体内主要降解ECM。既往研究表明,AS斑块损伤部位MMPs表达升高,包括属于间质胶原酶的 MMP1、属于明胶酶的MMP2和MMP9,以及属于基质降解酶的 MMP3,而TIMP1和 TIMP2等表达减少[6-7]。Galis等[8]在冠状 AS中检测到MMPs与TIMPs的比例失调,认为调节两者之间的比例可起到治疗AS的作用。
Rouis等[9]报道腺病毒介导TIMP1过表达可以减轻ApoE-/-小鼠的颈动脉粥样硬化损伤程度,并推测此作用是由于TIMP1抑制MMPs活性保护了细胞外基质,进而抑制了平滑肌细胞的移行所致。该研究中,小鼠喂食6周高胆固醇饮食后注射携带TIMP1的重组腺病毒,4周后加以评估。发现动脉粥样硬化斑块的损伤面积明显减小。这与之前研究小鼠转基因过表达人TIMP1抑制 MMPs表达的结果相一致[10-11]。另外,转染携带TIMP1的重组腺病毒(Ad.TIMP1)使猪主动脉内皮细胞过表达TIMP1,可以减少细胞移行及对细胞外基质的侵袭[12]。随着分子生物学技术的进步,利用分子生物学技术使局部TIMP1过表达,为人们治疗AS带来希望[13]。
本研究采用He等[5]于1998年建立的技术方案,成功地进行了携带人TIMP1的重组腺病毒的构建,并采用Zeng等[14]报道的两步转化法,即将pAdEsay-1质粒先转化入BJ5183大肠埃希菌,并制备其电转化感受态细胞,再利用电转化仪将pAd-Track-CMV转入该菌,进而与细胞内的pAdEsay-1进行同源重组。这种方法与一步转化法相比,可以大大提高同源重组的效率,缩短实验时间[15]。
本研究发现,重组Ad-hTIMP1可以成功感染内皮细胞使实验组细胞内TIMP1过表达。为TIMP1作为靶基因用于稳定动脉粥样斑块的基因治疗奠定了基础。
[1] Watanabe N,Ikeda U.Matrix metalloproteinases and atherosclerosis[J].Curr Atheroscler Rep,2004,6(2):112-120.
[2] Reis ST,Pontes-Junior J,Antunes AA,et al.MMP-9overexpression due to TIMP-1and RECK under-expression is associated with prognosis in prostate cancer[J].Int J Biol Markers,2011,26(4):255-261.
[3] Liu P,Sun M,Sader S.Matrix metalloproteinases in cardiovascular disease[J].Can J Cardiol,2006,22(Suppl B):25B-30B.
[4] Gaffney MM,Hynes SO,Barry F,et al.Cardiovascular gene therapy:current status and therapeutic potential[J].Br J Pharmacol,2007,152(2):175-188.
[5] He TC,Zhou S,Costada LT,et al.A simplified system for generation recombinant adenoviruses[J].Proc Natl Acad Sci USA,1998,95(5):2509-2514.
[6] Wågsäter D,Zhu C,Björkegren J,et al.MMP-2and MMP-9are prominent matrix metalloproteinases during atherosclerosis development in the Ldlr(-/-)Apob(100/100)mouse[J].Int J Mol Med,2011,28(2):247-253.
[7] Heo SH,Cho CH,Kim HO,et al.Plaque rupture is a determinant of vascular events in carotid artery atherosclerotic disease:involvement of matrix metalloproteinases 2 and 9[J].J Clin Neurol,2011,7(2):69-76.
[8] Galis ZS,Sukhova GK,Lark MW.Increased expression of matrix metalloproteinases and matrix degrading activity in vulnerable regions of human atherosclerotic plaques[J].J Clin Invest,1994,94(6):2493-2503.
[9] Rouis M,Adamy C,Duverger N,et al.Adenovirus-mediated overexpression of tissue inhibitor of metalloproteinase-1reduces atherosclerotic lesions in apolipo protein E-deficient mice[J].Circulation,1999,100(5):533-540.
[10]Watanabe M,Yakahashi Y,Ohta T,et al.Inhibition of metastasis in human gastric cancer cells transfected with tissue inhibitor of metalloproteinase-1gene in nude mice[J].Cancer,1996,77(8Suppl):1676-1680.
[11]Alexander CM,Howard EW,Bissel M,et al.Rescue of mammary epithelial cell apoptosis and entactin degradation by a tissue inhibitor of metalloproteinases-1transgene[J].J Cell Biol,1996,135(6):1669-1677.
[12]Fernandez HA,Kallenbach K,Seghezzi G,et al.Inhibition of endothelial cell migration by gene transfer of tissue inhibitor of metalloproteinases-1[J].J Surg Res,1999,82(2):156-162.
[13]Beaudeux JL,Giral P,Bruckert E,et al.Matrix metalloproteinases and atherosclerosis.Therapeutic aspects[J].Ann Biol Clin,2003,61(2):147-158.
[14]Zeng M,Smith SK,Siegel F,et al.AdEasy system made easier by selecting the viral backbone plasmid preceding homologous recombination[J].Biorechniques,2001,31(2):260-262.
[15]尹冰楠,李冬田,李秋香.一种简易、廉价、高效构建重组腺病毒载体的方法[J].天津医科大学学报,2005,11(2):171-174.
