p53基因与PTEN基因共转染对膀胱癌T24细胞凋亡的影响
2013-08-24于立春盛玉文曲更庆王庆军孙世宝
于立春,盛玉文,曲更庆,王庆军,孙世宝
辽宁医学院附属第一医院 泌尿外科,辽宁锦州 121001
近年研究发现,在多形性神经胶质母细胞瘤、神经胶质瘤、原发性前列腺癌、子宫内膜癌、卵巢癌等人类肿瘤中,张力蛋白同源物(phosphatase and tension homologue deleted on chromosome 10,PTEN)发生了不同程度的缺失和突变[1]。在各型白血病细胞中也发现PTEN有不同程度的突变和缺失[2]。目前人类最重要的抑癌基因是p53,在人类一半以上的肿瘤组织中发现了p53基因的突变[3]。p53介导的细胞信号转导途径与细胞内其他信号转导通路间的联系十分复杂,近年研究发现,p53和PTEN在前列腺癌、子宫内膜癌存在相互关联的作用[4]。本研究旨在探讨共转染野生型p53基因和PTEN基因对膀胱癌T24细胞凋亡的影响。
材料和方法
1 细胞和试剂 人膀胱肿瘤T24细胞株(中国科学院上海分院);小牛血清(Hyclone公司);抗生素潮霉素B(hygro-mycin B)、LipofectAMINETM2000、携带野生型p53基因、PTEN基因、重组质粒pVITR02-hp53、pVITR02-h PTEN和pVITR02-hp53-hPTEN的大肠埃希菌(Takara公司);RNA提取试剂盒、TRIzol溶液以及RPMI 1640培养液(美国Gibco公司);质粒抽提试剂盒(德国Qiagen公司);反转录试剂盒(美国Promega公司);鼠抗人PTEN、鼠抗人p53单克隆抗体(SANTA CRUZ公司)。引物合成和DNA测序由武汉英骐生物技术有限公司完成。
2 细胞培养和基因转染 T24细胞用含10%胎牛血清、RPMI 1640培养液(加双抗),置于培养箱中培养(37 ℃、CO2体积分数为5%),每2~3 d换液1次,待细胞长满培养瓶底部80%左右时进行传代,待传至5~6代,取对数生长期细胞进行实验。按产品说明书操作方法进行细胞转染:将携带有重组质粒的大肠埃希菌进行扩增和培养,并提取质粒;实验分空白质粒(pVITR02)转染组(A组)、携带p53基因质粒(pVITR02-hp53)转染组(B组)、携带PTEN基因质粒(pVITR02-hPTEN)转染组(C组)、联合携带p53-PTEN基因质粒(pVITR02-hp53-hPTEN)转染组(D组),每实验组各取4 μg质粒,分别放入10 μl的LipofectAMINETM 2000中充分混匀,待静置20 min分别加入1×106个T24细胞中,于6孔板中培养,待24 h后可按1∶10进行传代,待36 h后加入浓度为200 μg/ml潮霉素B进行筛选,筛选后继续培养扩增[5]。
3 RT-PCR法检测目的基因的表达 抽提总的RNA:经过筛选获得的转染细胞用0.25%胰酶消化后,收集细胞,洗涤细胞(用PBS液)2次,加入TRIzol溶液1 ml,吹打、振荡10 min,最后加入氯仿0.2 ml,在2~8 ℃条件下离心5 min(12 000×g),收集上清,加入异丙醇沉淀RNA 0.5 ml,最后溶于双蒸水中(用焦碳酸二乙酯处理后)。取总RNA 1 μg,溶于20 μl反应体系中,加入随机引物500 ng,RNAsin 20 U和Mo-MLV反转录酶200 U,70 ℃条件下反应10 min,40 ℃条件下静置2 h,在-20 ℃保存cDNA产物以备用。用参考文献[6]提供的方法进行p53基因引物设计,5'-CAGCCAAGTCTGTGACTTG CCG-TAC-3'为上游引物,5'-CTATGTCGAAAAGT GTITCTGTCATC-3'为下游引物。扩增条件:94 ℃(预变性)3 min, 94 ℃(变性)30 s、 56 ℃(退火)30 s、72 ℃(延伸)30 s,共30个循环。参照GenBank提供的PTEN基因序列,5'-CAGCCAAGTCTGTGACTT GCCG-TAC-3'为上游引物,5'-CCGCTCGAGCAGT CGCTGCAACCATCCA-3'为下游引物,扩增条件:94 ℃(预变性)5 min,94 ℃(变性)30 s,60 ℃(退火)30 s,72 ℃(延伸)1 min,循环30次。待目的片段的扩增体系达到总体积为25 μl时,加入Taq酶1.0 U、引物82.5 ng和cDNA 2 μl。取10μl扩增产物行琼脂糖凝胶电泳鉴定,在溴化乙锭(ethidium bromide,EB)染色后,观察电泳结果(在紫外灯下),摄片记录。在荧光显微镜下观察各组(空载体组、p53基因转染组、PTEN基因转染组和p53基因联合PTEN基因共转染组)绿色荧光蛋白在细胞内的表达情况。
4 细胞集落形成实验 将处于对数生长期的4组T24细胞(转染后)即A组、B组、C组和D组,接种于24孔板中(按照每孔300个/ml的细胞密度),每组设5个平行孔。培养7 d(在37 ℃、CO2体积分数为5%的饱和湿度环境),弃去上清液,洗涤细胞2次(用PBS),加入甲醇溶液5 ml固定15 min后,再加入吉姆萨染色液200 μl染色细胞20 min,用流水冲洗去除染色液,待干燥后,计数>1 mm视野的集落数目(在光学显微镜下进行)。
5 Western blotting检测p53、PTEN蛋白表达 分别收集4组细胞,提取每组细胞的蛋白,以牛血清蛋白为标准品,测定四组及标准品的蛋白含量。用质量分数10%聚丙烯酰胺凝胶电泳进行蛋白分离, 然后转至硝酸纤维膜(或PVDF膜)上,用5%脱脂奶粉封闭1 h,并洗膜,加入按1∶500倍稀释的鼠抗人PTEN单克隆抗体,在4 ℃条件下过夜。洗膜后加入二抗(用辣根过氧化物酶标记),作用1 h(室温),洗膜后用ECL显色,并在暗室曝光,用显影定影后扫描分析,用蛋白表达强度表示其结果。
6 Annexin V-FITC V/PI双染法检测细胞凋亡率分别取4组处于对数生长期的T24细胞,分别进行消化、离心,并收集制成细胞悬液,调整细胞密度为1×106/ml,取细胞悬液100 μl,分别加入用FITC标记的Annexin V 5 ml和碘化丙啶(propidium iodide,PI)5 ml,及时用流式细胞仪检测细胞凋亡率。
7 统计学处理 采用SPSS13.0统计软件进行统计学分析。计量资料用-x±s表示,采用单因素方差分析法,两两比较用q检验,方差不齐用Dunnett-t检验。以P<0.05为差异有统计学意义。
结 果
1 基因转染后p53和PTEN mRNA的表达 RTPCR检测结果显示,B组和C组中分别有p53和PTEN mRNA的表达,D组中p53和PTEN mRNA同时存在。见图1。
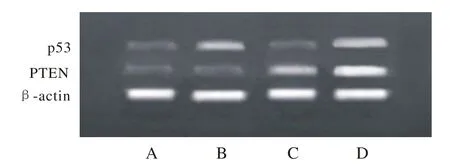
图 l RT-PCR检测p53和PTEN mRNA在T24细胞中的表达A: 实验分空白质粒(pVITR02)转染组; B: 携带p53基因质粒(pVITR02-hp53)转染组; C:携带PTEN基因质粒(pVITR02-hPTEN)转染组; D: 联合携带p53-PTEN基因质粒(pVITR02-hp53-hPTEN)转染组
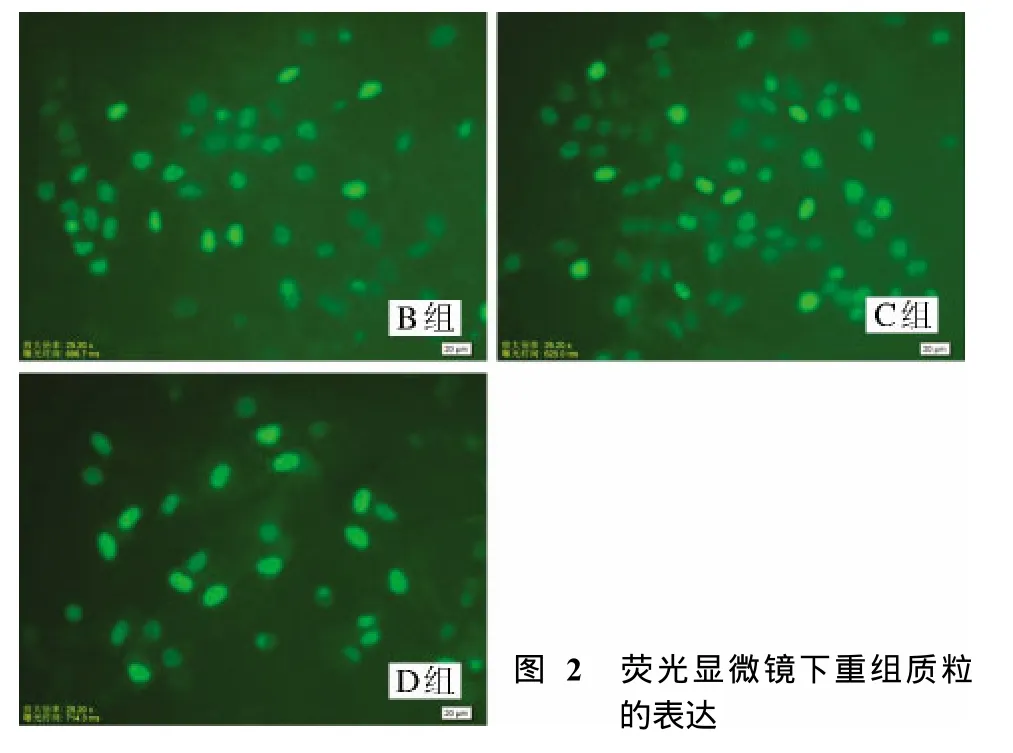
2 荧光显微镜下重组质粒的表达 在荧光显微镜下观察转染后的B、C、D组细胞(在转染后48 h效果最好),可见绿色荧光主要集中在细胞质中,即绿色荧光蛋白表达成功(图2)。A组未见荧光蛋白表达,B、C、D组细胞的荧光蛋白表达无明显差别。见图2。
3 细胞集落形成实验 p53和(或)PTEN经过B组、C组以及D组共转染后,集落数在各组T24细胞中均有减少,B组、C组和D组与A组相比差异有统计学意义(P<0.05)。见表1。
4 T24细胞中p53、PTEN蛋白的表达 Western blotting检测发现图3中p53蛋白表达提示B、D组与C、A组相比明显增加(图3) (P<0.05),且D组高于B组(P<0.05)。PTEN蛋白的表达,C、D组与B、A组相比明显增加(图4) (P<0.05),且D组高于C组(P<0.05)。见表2。
5 Annexin V-FITC V/PI双染法检测细胞凋亡率Annexin V-FITC V/PI双染法检测结果显示:B组、C组和D组明显高于A组(P<0.05),且D组明显高于B组和C组(P<0.05)见图5、表3。
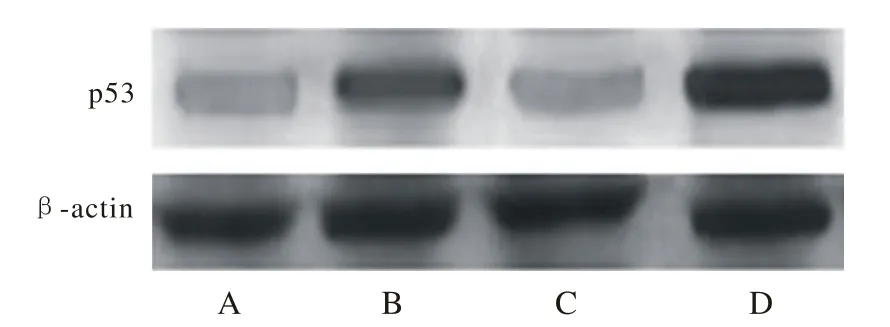
图 3 Western blotting检测p53基因蛋白表达情况
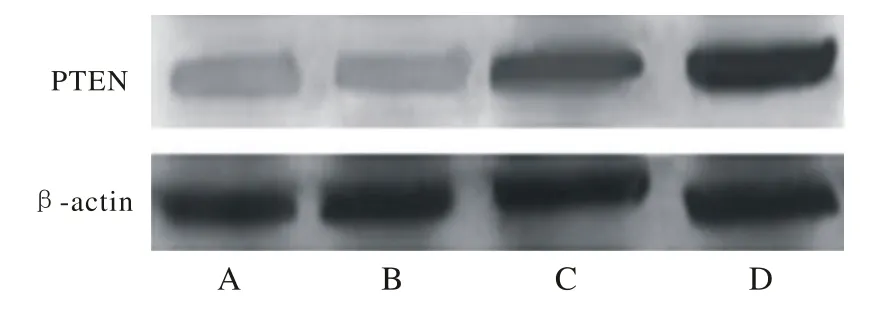
图 4 Western blotting检测PTEN基因蛋白表达情况

表l p53和PTEN基因转染对T24细胞集落形成数的影响(-x±s,n=5)

表2 不同组别中p53、PTEN蛋白的表达(-x±s,n=5)

表3 p53和PTEN基因转染对T24细胞凋亡率(-x±s,n=5)
讨 论
基因治疗已经成为肿瘤治疗的新探索。其中抑癌基因治疗是肿瘤基因治疗的方法之一,在正常细胞中抑癌基因失活、突变和(或)癌基因的过度激活等都有可能引起肿瘤的发生,基于这一点将正常功能的野生型抑癌基因转染到肿瘤细胞中,并在肿瘤细胞表达,恢复细胞正常的生长表型,从而达到抑制肿瘤的作用。人类p53基因是由11个外显子和10个内含子组成,位于17p13.1,长度约20 kb,是目前研究最广泛和最深入的一种抑癌基因,具有多种生物学功能:能够阻滞细胞有丝分裂的周期;其蛋白的表达能够抑制肿瘤血管的形成;能够促进细胞的凋亡[7-9]。PTEN基因有9个外显子和8个内含子,位于10q23.3,由200 kb组成,是到目前为止发现的第一个具有磷酸酶活性的抑癌基因[10]。PTEN编码的是一种多功能蛋白质,同时具有蛋白磷酸酶活性和脂质磷酸酶活性,通过干扰PI3K/AKT的信号传导,使细胞在细胞周期G期受到阻滞[11]。其生物学功能主要是:使细胞迁移、铺展、局部黏附和增殖受到抑制;当其等位基因丢失时会引起皮肤、胃肠道、前列腺的肿瘤,这与PTEN基因参与胚胎的正常发育有关,最近研究发现PTEN基因的异常表达可能会导致白血病的发生;PTEN蛋白表达能抑制肿瘤血管形成[12]。在人类自发肿瘤和遗传病中,p53与PTEN有较高的突变率,但两种基因同时发生突变的发生率较小[13-15]。在制作鼠的前列腺癌实验中得出这样的结论:p53与PTEN在抑制肿瘤发生发展方面存在互补作用,这种相互作用具有深刻的分子机制[16]。
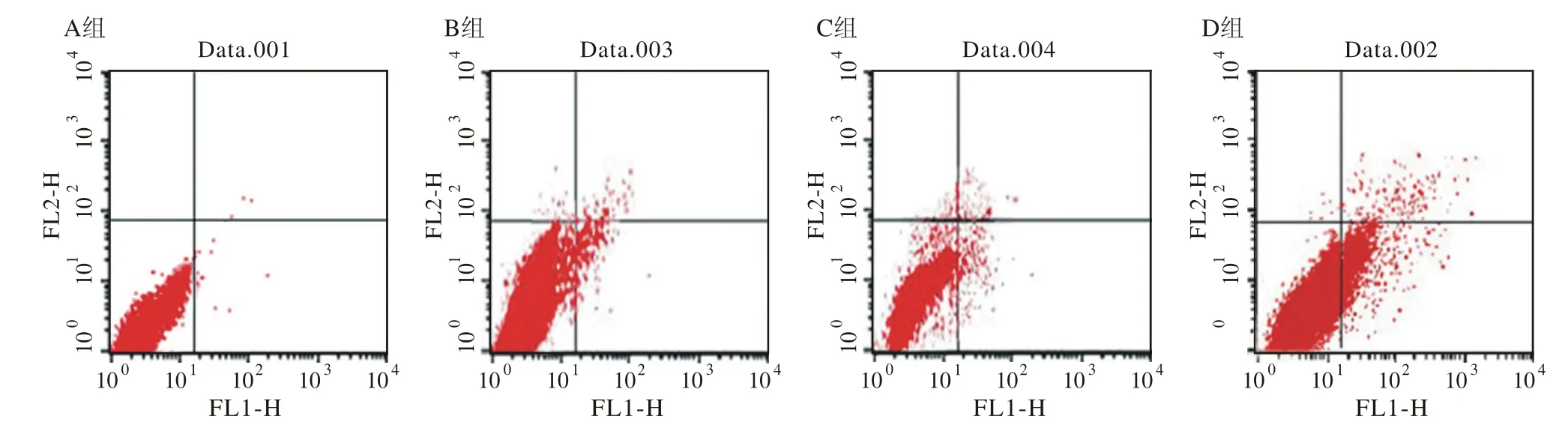
图 5 p53和PTEN基因转染对T24细胞凋亡率的影响
Ogawara等[17]研究发现,PTEN使AKT的活化受到抑制,从而MDM2蛋白Serl66不能被磷酸化活化,随后在细胞质中被降解,抑制肿瘤的发生。Chang等[18]研究发现,PTEN通过作用于启动子MDM2从而导致MDM2基因转录被抑制,MDM2活性受到抑制,增强了抑瘤功能。在我们检测细胞凋亡率时也发现:p53基因联合PTEN基因共转染组细胞的凋亡率明显高于空染体组和两个单染组。
Tang和Eng[19]研究发现,PTEN和p53形成的复合物可以增强p53转录及其蛋白的稳定性[19-22]。这和Freeman等[20]研究发现类似,当PTEN和p53结合后,从而稳定了P53蛋白;也使p53的DNA结合能力增强,相应的p53的转录活性也增强。本实验的Western blotting检测发现共转染组(pVITR02-hp53-hPTEN转染组)蛋白表达强度明显增强于单转组(pVITR02-hp53、pVITR02-hPTEN)和空转染组,这与两者的相互作用和维持正常细胞基因组的稳定性、凋亡功能和正常细胞周期有关。Wang等[23]研究发现,当敲除p53基因时,磷酸化PTEN蛋白表达水平明显降低,p53可以激活PTEN转录,通过直接结合PTEN上游序列,抑制了细胞PI3KAkt信号传导。这点我们用Western blotting检测可以得到证实,即共转染组蛋白表达显著高于单用PTEN组。
本研究结果显示,p53和PTEN基因均可诱导膀胱癌细胞T24的凋亡,共转染组较单基因转染组可更显著地诱导细胞凋亡。说明这2种基因在膀胱癌细胞T24细胞凋亡方面具有协同增强作用,其作用机制可能与2种基因在细胞周期监控和细胞凋亡上相互调节相互协同等方面有着重要作用。这种相互作用对细胞周期和凋亡产生较大影响。
1 O'Hara AJ, Bell DW. The genomics and genetics of endometrial cancer[J]. Adv Genomics Genet, 2012, 2012(2):33-47.
2 Magee JA, Ikenoue T, Nakada D, et al. Temporal changes in PTEN and mTORC2 regulation of hematopoietic stem cell self-renewal and leukemia suppression[J]. Cell Stem Cell, 2012, 11(3): 415-428.
3 Ishikawa T, Shimizu D, Yamada A, et al. Impacts and predictors of cytotoxic anticancer agents in different breast Cancer subtypes[J].Oncol Res, 2012, 20(2-3): 71-79.
4 Ghiţă C, Vîlcea ID, Dumitrescu M, et al. The prognostic value of the immunohistochemical aspects of tumor suppressor genes p53, bcl-2,PTEN and nuclear proliferative antigen Ki-67 in resected colorectal carcinoma[J]. Rom J Morphol Embryol, 2012, 53(3): 549-556.
5 Yang JY, Li X, Gao L, et al. Co-transfection of dendritic cells with AFP and IL-2 genes enhances the induction of tumor antigen-specific antitumor immunity[J]. Exp Ther Med, 2012, 4(4): 655-660.
6 Baronio R, Danziger SA, Hall LV, et al. All-codon scanning identifies p53 Cancer rescue mutations[J]. Nucleic Acids Res,2010, 38(20): 7079-7088.
7 Ogata DC, Marcondes CA, Tuon FF, et al. Superficial papillary urothelial neoplasms of the bladder (PTA E PT1): correlation of expression of P53, KI-67 and CK20 with histologic grade, recurrence and tumor progression[J]. Rev Col Bras Cir, 2012, 39(5): 394-400.
8 Saxena A, Shukla SK, Prasad KN, et al. Analysis of p53, K-ras gene mutation & Helicobacter pylori infection in patients with gastric Cancer & peptic ulcer disease at a tertiary care hospital in North India[J]. Indian J Med Res, 2012, 136(4): 664-670.
9 Sosin AM, Burger AM, Siddiqi A, et al. HDM2 antagonist MI-219(spiro-oxindole), but not Nutlin-3 (cis-imidazoline), regulates p53 through enhanced HDM2 autoubiquitination and degradation in human malignant B-cell lymphomas[J]. J Hematol Oncol, 2012,5:57.
10 Yoshimoto M, Ding K, Sweet JM, et al. PTEN losses exhibit heterogeneity in multifocal prostatic adenocarcinoma and are associated with higher Gleason grade[J]. Mod Pathol, 2013, 26(3):435-447.
11 Slomovitz BM, Coleman RL. The PI3K/AKT/mTOR pathway as a therapeutic target in endometrial Cancer[J]. Clin Cancer Res,2012, 18(21): 5856-5864.
12 Okumura N, Yoshida H, Kitagishi Y, et al. PI3K/AKT/PTEN Signaling as a Molecular Target in Leukemia Angiogenesis[J]. Adv Hematol, 2012:843085.
13 Napoli E, Ross-Inta C, Wong S, et al. Mitochondrial dysfunction in Pten haplo-insufficient mice with social deficits and repetitive behavior: interplay between Pten and p53[J]. PLoS One, 2012, 7(8):e42504.
14 Habib SL, Yadav A, Mahimainathan L, et al. Regulation of PI 3-K,PTEN, p53, and mTOR in malignant and benign tumors deficient in tuberin[J]. Genes Cancer, 2011, 2(11): 1051-1060.
15 Fornari F, Milazzo M, Chieco P, et al. In hepatocellular carcinoma miR-519d is up-regulated by p53 and DNA hypomethylation and targets CDKN1A/p21, PTEN, AKT3 and TIMP2[J]. J Pathol,2012, 227(3): 275-285.
16 Antico Arciuch VG, Russo MA, Dima M, et al. Thyrocyte-specific inactivation of p53 and Pten results in anaplastic thyroid carcinomas faithfully recapitulating human tumors[J]. Oncotarget, 2011, 2(12):1109-1126.
17 Ogawara Y, Kishishita S, Obata T, et al. Akt enhances Mdm2-mediated ubiquitination and degradation of p53[J]. J Biol Chem,2002, 277(24):21843-21850.
18 Chang CJ, Freeman DJ, Wu H. PTEN regulates Mdm2 expression through the P1 promoter[J]. J Biol Chem, 2004, 279(28):29841-29848.
19 Tang Y, Eng C. PTEN autoregulates its expression by stabilization of p53 in a phosphatase-independent manner[J]. Cancer Res, 2006,66(2):736-742.
20 Freeman DJ, Li AG, Wei G, et al. PTEN tumor suppressor regulates p53 protein levels and activity through phosphatase-dependent and-independent mechanisms[J]. Cancer Cell, 2003, 3(2): 117-130.
21 Ming M, He YY. PTEN in DNA damage repair[J]. Cancer Lett,2012, 319(2): 125-129.
22 Wysham WZ, Mhawech-Fauceglia P, Li H, et al. BRCAness profile of sporadic ovarian cancer predicts disease recurrence[J]. PLoS One, 2012, 7(1):e30042.
23 Wang J, Ouyang W, Li J, et al. Loss of tumor suppressor p53 decreases PTEN expression and enhances signaling pathways leading to activation of activator protein 1 and nuclear factor kappaB induced by UV radiation[J]. Cancer Res, 2005, 65(15): 6601-6611.
