PEDV、TGEV、PARV多重 RT-PCR检测方法的建立及其应用
2013-08-23郭容利何孔旺倪艳秀茅爱华温立斌王小敏俞正玉
郭容利, 何孔旺, 倪艳秀, 茅爱华, 温立斌, 李 彬, 王小敏, 俞正玉
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,江苏 南京 210014)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis of pigs virus,TGEV)和猪A群轮状病毒(Porcine group A rotavirus,PARV)是引起仔猪腹泻的主要肠道病毒[1]。三者有类似的传染途径和临床症状,感染猪均表现为水样腹泻、呕吐、脱水及新生仔猪的高死亡率,三者流行病学和病理剖检也极其相似,但三种病原没有共同的抗原性,不能交互免疫,而又有混合感染,也易继发其他细菌性感染,导致仔猪死亡率升高或生长缓慢,尤其是近几年,在中国病毒性腹泻暴发严重,仔猪的死亡率上升[2-4],给养猪业带来巨大经济损失。PEDV、TGEV和PARV传统的诊断方法主要有:病毒分离、组织培养及用免疫学方法诊断抗原[5-7]。常规的RT-PCR也广泛应用于这三种病毒的检测[8-10],而且RT-PCR因能快速检测出微量核酸而更具优越性。本试验旨在建立一种多重RT-PCR法,可快速直接地检测临床样品,同时区分鉴别诊断PEDV、TGEV和PARV三种腹泻病毒,为进行猪病毒性腹泻的流行病学调查和防控奠定一定的基础。
1 材料与方法
1.1 病毒与病料
猪流行性腹泻病毒(PEDV)CV777毒株、猪传染性胃肠炎(TGEV)JSXB2010毒株、猪A群轮状病毒(PARV)Nan86毒株、猪瘟病毒(HCV)、猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)均由本实验室保存。
病料来自2011年10月~2013年2月江苏省及周边地区猪场的疑患病毒性腹泻仔猪的粪便或小肠组织共154份。
1.2 主要试剂
Trizol LS Reagent为美国Invitrogen公司产品;反转录试剂盒为美国Promega公司产品;AxyPrep TM plasmid miniprep kit、Agarose gel DNA purification kit购自Axygen公司;pMD18-T载体克隆试剂盒、各限制性内切酶、DNA marker DL 2000等均购自TaKaRa公司;2×HSTMmix购自东盛公司;大肠杆菌DH5α由本实验室保存;氯仿、异丙醇、无水乙醇购自上海化学试剂有限公司。
1.3 引物设计合成
根据GenBank上公布的PEDV核蛋白N基因序列、TGEV糖膜蛋白M基因序列、PARV内衣壳蛋白VP6基因序列,分别在其保守区设计1对特异性引物(表1),由上海英骏技术有限公司合成。

表1 引物序列Table 1 Sequences of the primers
1.4 RNA 的提取
在被检样品 200 μl上清中加入 TRIzol 800 μl,振荡混匀后,室温放置5 min;加入氯仿200 μl,剧烈振荡后,室温放置10 min;4℃ 12 000 r/min离心10 min,取上清,加入等量异丙醇,混匀,-20℃放置2 h以上;4℃ 12 000 r/min离心15 min,去上清,沉淀用1 ml 75%的无RNA酶的乙醇洗涤;4℃ 7 500 r/min离心5 min去上清,室温干燥RNA沉淀20 min,加入DEPC水20 μl,充分溶解,-20℃冻存备用。
1.5 单项RT-PCR扩增
参照Promega反转录试剂盒说明书。反应体系:样品RNA 模板2.0 μl,10×RT buffe反转录缓冲液 2.0 μl,dNTP(10 mmol/L)2.0 μl ,MgCl2(25 mmol/L)3.0 μl,RNasin 0.5 μl,AMV 反转录酶 0.5 μl,随机引物 1.0 μl,加 ddH2O 至终体积 20.0 μl。反转录程序:25℃反应15 min,42℃孵育60 min,95℃ 5 min,同时设立阴性、阳性对照。cDNA产物于-20℃保存备用。
单项PCR扩增cDNA PCR反应总体系为25.00 μl:2 ×HSTMMix 12.50 μl,上游引物和下游引物(20 pmol/μl)各 0.25 μl,cDNA 2.00 μl,加 ddH2O 至终体积25.00 μl。反应参数:95℃预变性4 min;94℃变性30 s,53℃退火30 s,72℃ 延伸30 s,共35个循环;最后72℃延伸7 min。反应结束后,用1%琼脂糖凝胶电泳观察。
1.6 单项PCR最佳退火温度范围的确定
将退火温度设定为50.8℃、52.4℃、54.1℃、55.8℃、57.5℃、59.2℃ 6个梯度,上下游引物均取0.25 μl,采用不同的退火温度进行PCR扩增,根据试验结果,大致确定单项PCR最佳退火温度的范围。
1.7 PEDV、TGEV和PARV多重RT-PCR退火温度和引物浓度的确定
根据方法1.6,在确定的退火温度范围内,改变3对引物(上游引物和下游引物浓度均为 20 pmol/μl)的体积(表2),在其他条件不变的情况下进行PCR扩增。
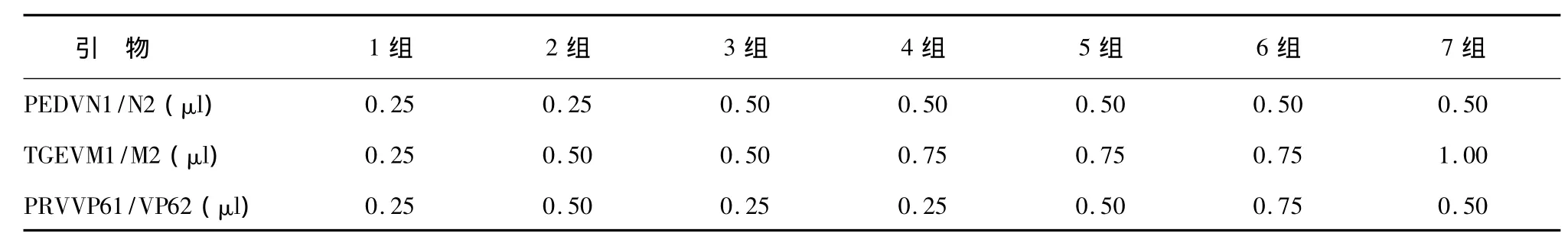
表2 RT-PCR引物体积分组Table 2 The grouping of the RT-PCR primer volume
1.8 多重RT-PCR的特异性试验
分别取 PEDV、TGEV和 PARV混合 cDNA模板,PEDV,TGEV,PARV,HCV,PRRSV,VERO、ST、Marck145三种细胞混合物 cDNA模板,PCV2,PRV DNA模板,以H2O作为阴性对照,在方法1.7确定的退火温度和引物浓度下进行PCR扩增。
1.9 多重RT-PCR的敏感性试验
将3种病毒等量(各病毒含量107TCID50/ml)混合后提取的RNA全部反转录所得cDNA按10倍倍比(100~108)稀释,各稀释度样品在确定的退火温度和3对引物浓度的情况下,其他条件不变进行PCR扩增。
1.10 多重RT-PCR检测方法的临床应用
利用所建立的多重RT-PCR方法检测来自2011年10月~2013年2月江苏省及周边地区猪场的疑患病毒性腹泻仔猪的粪便或小肠组织共154份病料。
1.11 多重RT-PCR产物测序及序列比对
将4份PEDV、1份TGEV和1份PARV多重RT-PCR临床检验的阳性产物回收、克隆、酶切鉴定后送上海英骏生物技术有限公司测序,利用NCBI中的BLAST软件对测序结果进行序列比对。
2 结果
2.1 单项PCR退火温度的确定
采用不同的退火温度进行PCR扩增(图1),退火温度在52.4至55.8℃之间试验效果相对较好。
2.2 PEDV、TGEV和PARV多重项RT-PCR退火温度和引物浓度范围的确定
在52.4℃、54.1℃、55.8℃ 3种退火温度下,改变3对引物的浓度,在其他条件不变的情况下进行PCR扩增。根据扩增结果(图2),确定PEDV、TGEV和PARV多重RT-PCR最佳的条件为:退火温度54.1℃,引物体积组合为第3组(PEDVN1/N2:0.5 μl/0.5 μl;TGEVM1/M2:0.5 μl/0.5 μl;PARVVP61/VP62:0.25 μl/0.25 μl)。
2.3 多重RT-PCR的特异性
用建立的多重 RT-PCR对 PEDV、TGEV和PARV 混合 cDNA 模板,PEDV,TGEV,PARV,HCV,PRRSV,Vero、ST、Marck145 混合细胞 cDNA 模板,PCV2、PRV DNA模板,ddH2O空白对照进行扩增(图3),只有PEDV、TGEV和 PARV混合 cDNA模板及PEDV、TGEV和PARV cDNA模板扩增出与目的片段大小一致的条带。说明本试验建立的多重RT-PCR具有很好的特异性。
2.4 多重RT-PCR的敏感性
将三种病毒混合后提取的RNA全部反转录所得cDNA按10倍倍比稀释,在确定的退火温度以及引物浓度下,其他条件不变,进行PCR扩增(图4)。假定所提取的RNA无降解,全部反转录,此多重RT-PCR可检测到约50 TCID50的混合病毒量。
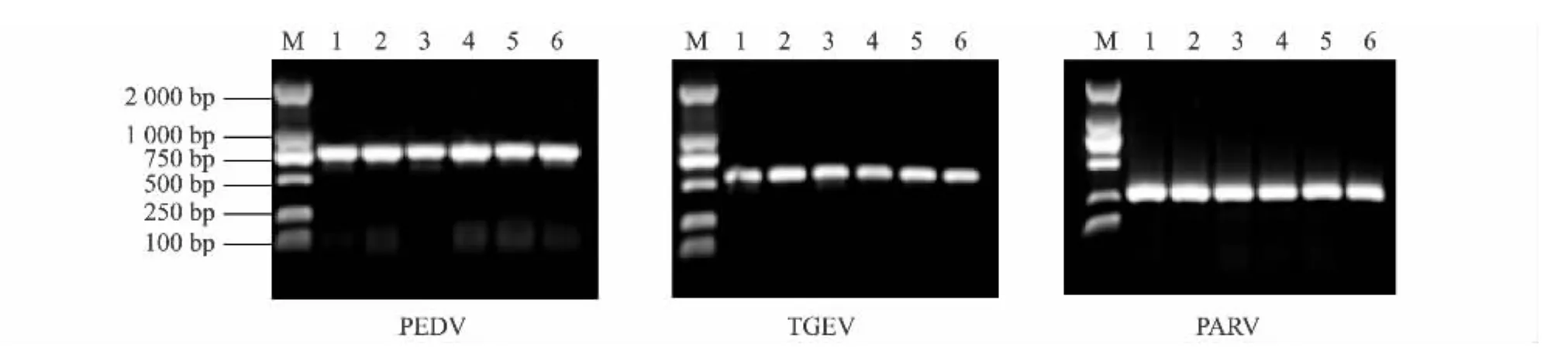
图1 PEDV、TGEV和PARV单项RT-PCR退火温度范围Fig.1 Annealing temperature of RT-PCR for PEDV,TGEV and PARV detection,respectively

图2 多重RT-PCR引物浓度与退火温度Fig.2 Primer concentration and annealing temperature of multiplex RT-PCR
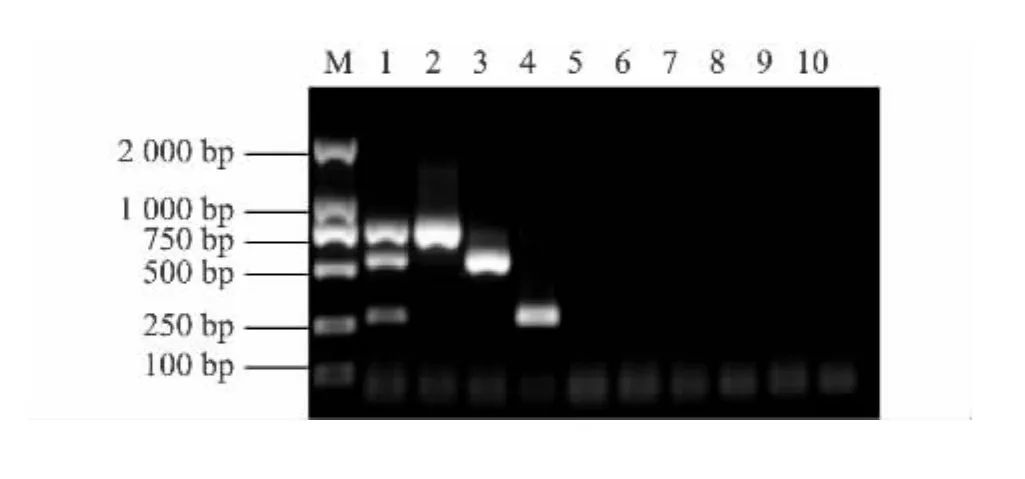
图3 多重RT-PCR的特异性Fig.3 Specificity of the multiplex RT-PCR assay
2.5 多重RT-PCR的临床应用
利用多重RT-PCR检测了仔猪腹泻的粪便或小肠组织共154份病料。PEDV、TGEV和PARV的阳性率分别为 53.2%,8.4% 和 5.2%。PEDV、TGEV共感染的概率为5.2%,PEDV与PARV共感染的概率为 4.5%。

图4 多重RT-PCR的敏感性Fig.4 Sensitivity of the mutiplex RT-PCR assay
2.6 多重RT-PCR产物的序列比对
将4株PEDV、1株TGEV、1株PARV阳性病料PCR产物回收克隆测序,利用NCBI中BLAST软件对所测序列进行比对。结果显示:4株PEDV的N基因序列与参考的CV777毒株(AF353511)同源性为分别为95.3%、97.6%、96%、95.7%;1株TGEV的M基因序列与参考的WH-1毒株(HQ462571.1)同源性为99%;1株PARV与Porcine rotavirus A strain CMP34/00(EU372782)VP6序列的同源性为95%。测序结果进一步证明了建立的多重RT-PCR检测方法具有良好的特异性。
3 讨论
常规的病毒诊断方法有病毒分离、荧光抗体检测和免疫组织化学法等,但都有一些缺陷。目前,病毒分离相当困难,荧光抗体检测和免疫组织化学法有非特异性,PCR方法因其具有快速、特异、灵敏、准确等优点现己经广泛应用于畜禽传染病的快速诊断,但是,目前单一的RT-PCR方法用于多种病毒感染的临床鉴别诊断,不能一次达到目的。而多重RT-PCR方法与上述检测方法相比,存在显著优势:能一次确诊单一感染或混合感染,达到诊断和鉴别的双重目的;比传统检测方法更方便快速。
本试验通过设计分别针对 PEDV、TGEV和PARV的3对特异性引物,将 PEDV、TGEV、PARV做阳性对照,对多重RT-PCR反应条件进行了优化,并对其特异性与敏感性进行了试验。试验结果证明该方法的特异性强、敏感性高,PCR产物测序结果进一步证明了建立的多重RT-PCR检测方法具有良好的特异性,可应用于临床鉴别诊断。本试验建立的多重RT-PCR检测方法采用商品化的反转录试剂盒,保障了试剂的标准化,运用其中的随机引物可一次性反转录多种RNA病毒,减少操作步骤,更有利于标准化临床检测,具有较高的实用价值。此方法的建立为这3种病毒性腹泻的流行病学调查奠定了基础。
在中国,近几年来,猪群中由病毒感染引起的仔猪腹泻非常严重,而PEDV感染尤其严重,其感染率明显高于另外的2个猪病毒性腹泻病原,即猪传染性胃肠炎(TGEV)和猪A群轮状病毒(PARV)[9,11-13]。在本研究中,应用建立的多重 RTPCR方法对来自2011年10月~2013年2月江苏省及周边地区猪场的疑患病毒性腹泻仔猪的粪便或小肠组织共154份病料进行了检测,结果表明,猪群中猪流行性腹泻病毒感染率仍然较高,达到了53.2%,而TGEV、PARV的阳性率相对较低,分别是8.4%、5.2%,从检测的结果来分析,猪群中也存在几种病毒共感染的现象。当这三种病毒有混合感染时,发病猪的症状较严重,致使仔猪死亡率上升。因此,为了预防病毒性腹泻的发生,加强饲养管理和有效的疫苗接种是很有必要的。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:681-690.
[2]JIANFEI CHEN,XIAOZHEN LIU,DA SHI,et al.Complete genome sequence of a porcine epidemic diarrhea virus variant[J].J Virol,2012,86(6):3408.
[3]YONGWEN LUO,JIE ZHANG,XIANBO DENG,et al.Complete genome sequence of a highly prevalent isolate of porcine epidemic diarrhea virus in South China.[J].J Virol,2012,86(17):9551.
[4]JING BI,SONGLIN ZENG,SHAOBO XIAO,et al.Complete genome sequence of porcine epidemic diarrhea virus strain AJ1102 isolated from a suckling piglet with acute diarrhea in China[J].J Virol,2012,86(19):10910-10911.
[5]CARVAJAL A,LANZA I,DIEGO R.Evaluation of a blocking ELISA using monoclonal an tibodies for the detection of porcine epidemic diarrhea virus and its antibodies[J].J Vet Diagn Invest,1995,7:60-64.
[6]RODAK L,SMID B,NEV0RANKOVA Z.Verification of sensitivity and specificity of group A rotavirus detection in piglets faeces with monoclonal blocking ELISA methods[J].J Vet Med B,2004,51:160-165.
[7]R0DAK L,VAI ICEK L,SMID B,An ELISA optimized for porcine epidemic diarrhoea virus detection in faeces[J].Vet Microbiol,2005,105:9-17.
[8]ELSCHNER M,PRUDLO J,H0TZEL H.Nested reverse transcriptase polymerase chain reaction for the detection of group A rotavirus[J].J Vet M ed,2002,49:77-81.
[9]杨 群,何孔旺,陆承平.应用多重RT-PCR方法检测158例猪粪样中的两种冠状病毒[J].中国预防兽医学报,2006,28(4):431-435.
[10]倪艳秀,何孔旺,俞正玉,等.检测猪流行性腹泻病毒的RTPCR 方法的建立[J].畜牧与兽医,2004,36(1):10-12.
[11]陈建飞,冯 力,时洪艳,等.猪流行性腹泻病毒CH/S株N蛋白基因的遗传变异及其原核表达[J].中国预防兽医学报,2007,29(11):856-860.
[12]田小艳,孙 华,邓雨修,等.3种致猪腹泻病毒的多重RT-PCR检测[J].动物医学进展,2009,30(9):54-57.
[13]张 坤,何启盖.猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1001-1005.
