肾茶对阿霉素肾病大鼠血清 NF-KB、IL-8水平的干预研究
2013-08-23王丽敏徐海波张颖杰
王丽敏,王 蕾,徐海波,张颖杰,张 岩
(佳木斯大学附属第一医院儿科,黑龙江 佳木斯 154003)
肾病综合征(nephrotic syndrome,N S)是指由多种病因引起的,以大量蛋白尿(24h尿蛋白> 0.05g/kg)、低白蛋白血症(血浆白蛋白 <30g/L)、高度水肿、高脂血症[1]为主要临床表现的一组综合征,是儿科临床常见病、多发病,微小病变型肾病是儿童肾病综合征最常见的类型,其病理生理改变为肾小球基膜通透性增加伴肾小球滤过率降低。现有治疗方案以激素为主,存在疗程长、副作用多、易复发、患者依从性差等缺点,严重威胁患儿的健康。NS的发病机制与多种因子有关,NF-KB是参与基因转录的蛋白质分子之一,广泛存在于机体各种组织细胞中[2],且当细胞受到外界因素刺激时,胞质内 NF-KB与抑制蛋白(IK-BS)分离并活化,进入细胞核内与 DN A结合启动基因转录,调节包括细胞因子和炎症介质 (如 IL-8、 IL-2、 IL-2a、1L-6、V CAM、ICAM、 E-selectin、IFN-B、 MCP-1、RAN TES等 )在内的众多蛋白质表达。IL-8与靶细胞上特异受体结合,引起肾小球基底膜硫酸乙酰肝素蛋白聚糖(分布于细胞膜与细胞外基质中)分解代谢增加,合成代谢减少,导致肾小球静电屏障破坏,从而使大量带负电荷血浆清蛋白从肾小球基底膜漏出,产生蛋白尿[3]。肾茶又名猫须草,目前已从中分离出熊果酸、迷迭香酸等多种成分。刘勇等[4]研究表示,熊果酸能剂量依赖性的抑制 CD3、CD28单抗促发的 N F-KB P65细胞核转位,下调 T细胞的作用。本研究拟建立阿霉素致 NS大鼠模型,检测大鼠外周血中 N F-KB和 IL-8的变化 ,并观察大鼠尿蛋白的变化及探讨肾茶治疗 NS的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验对象:雄性 Wistar大鼠40只,体重为(120±20)g,两次尿蛋白定性阴性,由大连医科大学实验动物中心提供。
1.1.2 药物及试剂:盐酸阿霉素(浙江省海正药业有限股份公司);肾茶(泉州市医药公司);IL-8试剂盒、核蛋白提取试剂盒、NF-KB试剂盒 (美国 Activemotif公司)。
1.1.3 仪器:代谢笼、DNX-9620电脑洗板机、DNM-9602酶标分析仪、电热恒温水温箱、-80℃超低温冰箱、自动旋转振荡仪、离心机等均由佳木斯大学实验中心提供。
1.2 方法
1.2.1 模型制备:大鼠在佳木斯大学动物室适应性饲养一周。随机分为两组:正常组 (n=10)注射生理盐水 0.5mL,肾病组(n=30)参照王峥等[5]方法尾静脉单次注射阿霉素5mg/kg(用生理盐水溶解至0.5mL)制备 NS模型,注射后第7天检测所有大鼠24h蛋白尿,尿蛋白> 30mg/24h者为 NS模型成功。期间死亡6只,不合格者4只予以剔除。剩余肾病组再随机分为两组:肾病组(n=10)、肾茶组(n=10)。
1.2.2 给药方法:肾茶组在造模成功后第7天开始灌胃给药5mL/kg,正常组和肾病组给予等量生理盐水灌胃。
1.2.3 各组大鼠24h尿蛋白的测定:在阿霉素注射后第6、20、41天收集24h尿液,用免疫比浊法检测24h尿蛋白。
1.2.4 各组大鼠 NF-KB、 IL-8的测定:第 7、 21、42天大鼠清晨空腹采静脉抗凝血2mL,用淋巴细胞分离液分离出单个核细胞,PBS制成 2× 106/mL细胞悬液,用酶联免疫吸附法检测外周血单个核细胞提取物 NF-KB;同时采集非抗凝血1mL,分离血清置于-80℃冰箱保存备用,取其上清液用酶联免疫吸附双抗体夹心法检测 IL-8。以上步骤严格按照说明书进行操作。
1.3 统计学分析
应用 SPSS17.0统计分析软件,实验结果用均数±标准差±s)表示。三组均数间比较用随机区组方差分析;两组均数间差别用 t检验;相关分析采用 Pearson直线相关析。P<0.05有统计学意义。
2 结果
2.1 各组大鼠尿蛋白比较
见表 1。
表1 各组大鼠尿蛋白定量 (±s,mg/24h,n=10)
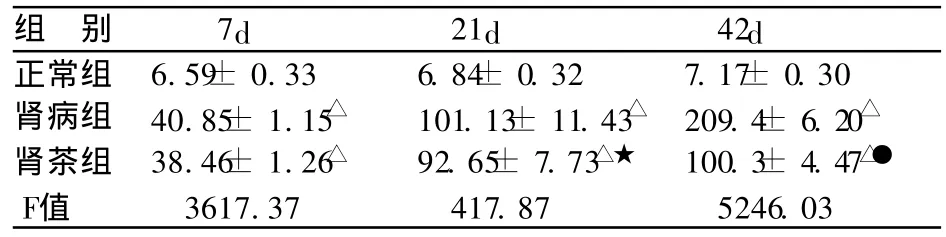
表1 各组大鼠尿蛋白定量 (±s,mg/24h,n=10)
注:△与正常组比较 P <0.01;★与肾病组比较 P> 0.05;●与肾病组比较 P<0.01。
组 别 7d 21d 42d正常组 6.59± 0.33 6.84± 0.32 7.17± 0.30肾病组 40.85± 1.15△ 101.13± 11.43△ 209.4± 6.20△肾茶组 38.46± 1.26△ 92.65± 7.73△★ 100.3± 4.47△●F值 3617.37 417.87 5246.03
肾病组及肾茶组在第7天尿蛋白均高于正常组(P <0.01);肾病组的尿蛋白在第21~42天持续升高;第21天肾茶组尿蛋白低于同期肾病组,无统计学差异(t= 0.07,P> 0.05);第42天肾茶组尿蛋白低于同期肾病组,有显著性差异 (t=5.71,P<0.01)。
2.2 各组大鼠 NF-KB活性比较
见表2。
表2 各组大鼠 NF-KB活性 (± s,OD值,n=10)
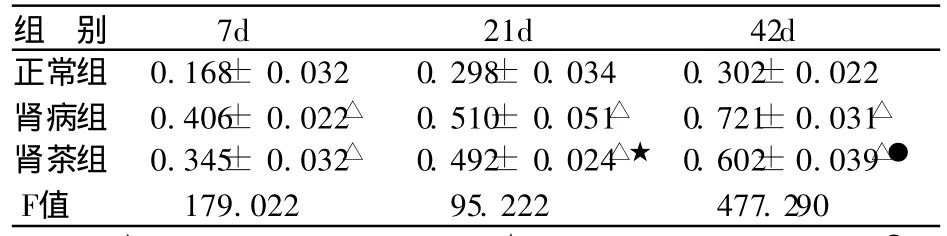
表2 各组大鼠 NF-KB活性 (± s,OD值,n=10)
注:△与正常组比较 P<0.01;★ 与肾病组比较 P> 0.05;● 与肾病组比较 P<0.01。
组 别 7d 21d 42d正常组 0.168± 0.032 0.298± 0.034 0.302±0.022肾病组 0.406± 0.022△ 0.510± 0.051△ 0.721±0.031△肾茶组 0.345± 0.032△ 0.492± 0.024△★ 0.602±0.039△●F值 179.022 95.222 477.290
肾病组及肾茶组在第 7天 N F-KB均高于正常组(P <0.01);肾病组的 NF-KB在第21~42天持续升高;第21天肾茶组 N F-KB低于同期肾病组,无统计学差异(t= 0.32,P> 0.05);第42天肾茶组 NF-KB低于同期肾病组,有显著性差异 (t=6.54,P<0.01)。
3.3 各组大鼠 IL-8浓度比较
见表3。
表3 各组大鼠 IL-8浓度 (±s,pg/mL,n=10)
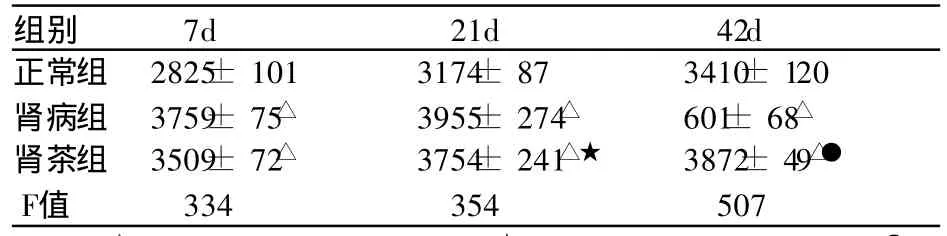
表3 各组大鼠 IL-8浓度 (±s,pg/mL,n=10)
注:△与正常组比较 P<0.01;★ 与肾病组比较 P> 0.05;● 与肾病组比较 P<0.01。
组别 7d 21d 42d正常组 2825± 101 3174± 87 3410± 120肾病组 3759± 75△ 3955± 274△ 601± 68△肾茶组 3509± 72△ 3754± 241△★ 3872± 49△●F值 334 354 507
肾病组及肾茶组在第 7天 IL-8均高于正常组(P <0.01);肾病组的 IL-8在第21天至 42天持续升高;第21天肾茶组 IL- 8低于同期肾病组,无统计学差异(t= 0.08,P> 0.05);第42天肾茶组 IL-8低于同期肾病组,有显著性差异 (t= 3.42,P<0.01)。
3.4 尿蛋白、NF-KB和 IL-8之间的相关分析
肾病组和肾茶组各组的 N F-KB与 IL-8具有相关关系 (r= 0.969,0.870,P均 <0.01);正常组 NF-KB与 IL-8不具有相关关系 (r= 0.160,P> 0.05)。肾病组和肾茶组各组的尿蛋白与 IL-8具有相关关系 (r=0.972,0.874,P均 <0.01);正常组尿蛋白与 IL-8不具有相关关系(r= 0.062,P > 0.05)。
4 讨论
微小病变型肾病以肾小球基膜通透性增加伴肾小球滤过率降低为主要病理改变,大量蛋白尿为主要临床表现。长期大量蛋白尿可加重肾脏的损害,故减少尿蛋白对治疗肾病综合征至关重要。以往研究表明,IL-8与靶细胞上特异受体结合后可破坏肾小球基底膜电荷屏障,导致大量蛋白尿的产生。这与本实验研究相一致,肾病组尿蛋白与正常组和肾茶组有显著性差异 (P<0.01),且肾病组的 IL-8与尿蛋白具有相关性 (P<0.01)。另有国外研究报道[6],肾病综合征患儿外周血单个核细胞(PBMCs)中 N F-KB活性与血浆 IL-8浓度呈正相关趋势。这与本实验结果相一致,说明在 N S病理状态下 NF-KB活性水平与 IL-8含量呈直线相关关系 (P<0.01)。钟桴等[7]研究发现,肾病患儿 NF- KB活性高于正常儿童,提示原发性肾病综合征 NF- KB信号途径过度活化。NF-KB的激活是许多病理状态的决定因素,参与调节细胞凋亡、免疫应答、炎症反应等[8],且 NF-KB活性的增加可引起其下游因子之一 IL-8的浓度增加,故通过抑制 NF-KB活性水平逐渐成为相关疾病的治疗靶点,预期可阻断疾病的发生和发展[9]。
本研究发现,肾病大鼠 NF-KB及其下游因子之一 IL-8明显增高,尿蛋白与正常组大鼠也有显著性差异,三者之间具有直线相关关系,提示通过抑制 N F-KB活性可降低肾病大鼠的尿蛋白,从而为治疗 NS提供新的途径,这与钟桴等[7]研究相一致。大量文献报道[10],肾茶具有利尿,抗炎 ,抗菌,免疫调节等作用。本实验以肾茶为治疗组,结果显示肾茶组的 NF-KB比肾病组明显减少,差异具有统计学意义,这与刘勇[4]等研究结果相一致,且肾茶组大鼠尿蛋白明显低于肾病组,故肾茶可为治疗 NS提供新的途径。
综上所述,本实验通过肾茶抑制 N F-KB而抑制其下游因子之一 IL-8,从而减少尿蛋白的产生,治疗肾病综合症。肾茶为单味中药,且对呼吸系统、神经系统无明显影响 ,循环系统[11]研究中,仅对麻醉犬的血压有暂时的降低作用,副作用小,故肾茶可为治疗 N S提供新的治疗途径。但由于本实验周期短,检测指标及实验动物例数有限,且 NS发病机制复杂,影响疾病发展的因素众多,不易干预治疗,故本实验仅为初步研究阶段。且 NF-KB在体内执行生理功能方面具有重要作用,也是机体正常防御和修复的重要机制。因此 ,寻求合理的给药间隔、方式、剂量,是否联合应用激素能更有效、适当抑制 NF-KB,减少尿蛋白从而治疗肾病综合征等一系列问题,将有待于以后的继续研究。
[1]王丽敏,亚瑟尔.IL-18BP联合泼尼松治疗阿霉素肾病大鼠的实验研究 [J].黑龙江医药科学,2012,35(3):1-3
[2]Bao Song Z.Blocking N F-KB nuclear transocation leads to p53-related autophagy activation and cell apoptosis[J]. World J Gastroenterol,2011,17(4):478-487
[3]Garin EH,Blan chard DK,Matsushim aK,et al.IL-8production by peripheral blood mononuclear cells in nephritic patients[J].Kidney Int,1994,45:1311-1317
[4]刘勇.核因子-κ B抑制剂熊果酸延长小鼠心脏移植物存活时间[J].武汉大学学报(医学版),2011,32(1):20-23
[5]王峥,王增贵,刘震,等.阿霉素诱发大鼠肾病模型的实验研究[J].华西医科大学学报,1990,21(4):430-432
[6]McKay LI,Cidlowski JA.Cross-talk between nuclear factorkappa KB and the steroid hormone receptors: mechanisms of mutual antagonism[J].Mol Endocrinol,1998,12(1):45-56
[7]钟桴,董军,高岩,等.核因子-KB对原发性肾病综合征患儿 IL-8调控及黄芪的干预作用 [J].中国临床药理学杂志,2009,121:434-437
[8]冯春燕,黄秀容.蜕皮甾酮对 H2O2诱导氧化损伤的人晶状体上皮细胞核因子-KBP65表达的影响 [J].中国中西医结合杂志,2012,32(1):76-79
[9]Gilmore TD.In troduction to N F-kappaB: Players,pathw ays,perspectiv es[J].Oncogene,2006,25(51):6680-6684
[10]Sahib H,Aisha A,Yam M E.Anti- Angiogenic and Anti Oxidant Properties of Orthosiphon stamineus Benth.Methanolic Leav es Ex tract[J].International Journal of Pharmacology,2009,5(2):162-167
[11]宋伟杰,王立强,孟萍萍,等.肾茶提取物对实验动物循环系统药理作用的研究 [J].中国医药科学,2011,1(7):47-53
