医疗器械生产企业微生物实验室设计与监管实例
2013-08-23焦彦超北京市药品监督管理局密云分局北京101500
焦彦超 北京市药品监督管理局密云分局 (北京 101500)
随着医疗器械生产质量管理规范的实施,对无菌和植入类医疗器械的微生物实验室已做出相应要求,其中《医疗器械生产质量管理规范无菌医疗器械实施细则》和《医疗器械生产质量管理规范植入性医疗器械实施细则》中第八章监视和测量规定:生产企业应当建立符合要求并与生产产品相适应的无菌检验室。但实际还包括阳性对照室、微生物限度检查室等,总体称之为微生物实验室更加符合实际。目前医疗器械微生物实验室法规要求起步晚,依据不够细化,加之产品的复杂性,因此微生物实验室的规范化设计并不成熟,本文对微生物实验室的设计和布局进行初步探讨。
1.微生物实验室功能
医疗器械的检验通常分为物理性能、化学性能、生物性能检验。理化检验需要设置理化检验室或在相应工位设检验装置;生物性能检验,对其中的生物学评价检验,企业一般不设检验室,而是委托检测机构进行检测,而微生物检测按法规要求需自行建立微生物检验室。
微生物实验室应实现以下功能:
(1)按照该产品的标准要求(引用GB/T 14233.2方法或药典方法),对产品进行无菌检验;
(2)对洁净环境(空气、水、工艺用气、台面、手)进行微生物检验;
(3)对原材料、半成品、成品的初始污染菌检测;
(4)部分含药的医疗器械还需满足药品检验需要(无菌、微生物限度、抗生素效价的微生物检定),如含药敷料、含有庆大霉素的骨水泥、药物涂层产品等;
此外,部分产品标准规定需要进行细菌内毒素检查(如注射器、输液器等一次性使用无菌医疗器械产品,氧合器、血液透析器、冠脉支架系统等部分人工器官和植入物产品)该类检查虽不是微生物检查,但对检查环境有较高的要求的,操作间应设有紫外线灯,并有控制温度、湿度的设备。应有书面操作规程,并有防止污染的措施。
2.微生物实验室设计要求
微生物实验室设计包括以下几个方面:人员,培养基,菌种,设备,实验室的布局和运行,器具及工作服洗涤、存放要求,更衣流程。
2.1 人员
从事微生物实验工作的人员应具备微生物学或相近专业知识的教育背景。检验人员数量和素质应能满足检验工作的需要。检验人员必须熟悉相关检测方法、程序、检测目的和结果评价。保证人员在上岗前接受胜任工作所必须的设备操作、微生物检验技术和实验室生物安全等方面的培训,经考核合格后方可上岗。
2.2 培养基
培养基质量稳定可靠,有良好的促菌生长能力,具备适宜的灭菌方式,在规定的条件和环境下贮藏,通过不同菌种的接种试验并观察生长状态,进行灵敏度试验。
2.3 菌种
标准菌株的复活和传代应当满足药典要求。试验过程中,生物样本是最敏感的,它们的活性依赖于合适的试验操作和存储条件。实验室菌种的处理和保藏的程序应标准化,尽可能减少菌种污染和生长特性的改变。工作菌株的传代次数应当严格控制,不得超过5代(从菌种保藏机构获得的标准菌株为第0代),防止过度的传代增加菌种变异的风险。
2.4 设备
完成相应的检定、校准、验证、确认其性能。对于一些容易造成微生物污染的仪器设备如水浴锅、培养箱、冰箱和生物安全柜等应定期清洁和消毒。
2.5 无菌检查室
如果企业标准引用药典要求,企业应当按照2010版药典中(附录Ⅺ H )无菌检查法要求设置洁净间,无菌检查应在洁净度10000级下的局部洁净度100级的单向流空区域内或隔离系统中进行,其全部过程应当严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品微生物的检出。单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
如企业标准中引用的GB/T 14233.2的无菌试验方法,还应满足以下要求:无菌室操作台或超净工作台局部应符合洁净度 100 级单向流空气区域要求。无菌室在消毒处理完毕后,应检查空气中的菌落数,方法如下 :取直径约90mm培养皿,无菌操作注入融化的营养琼脂培养基约 20 mL,在30˚C~35˚C培养48h证明无菌后,取3只培养皿在无菌室操作台或超净工作台平均位置打开上盖,暴露 30 min 后盖好置30˚C~35˚C培养48h后取出检查。3只培养皿上生长的菌落数平均应不超过 1 个。
2.6 微生物限度检查室
微生物限度检查法(附录Ⅺ J)应在洁净度10000级下的局部洁净度100级的单向流空气区域内进行。检验室单向流空气区域、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
2.7 阳性对照(接种)室
微生物检验需要对标准菌种、检测菌种进行各种操作。如用于培养基的灵敏度检查、无菌检查和微生物限度检查方法的验证、阳性对照、抗生素效价的微生物检定时需要的菌种及菌悬液制备、传代转接种。这些操作要处理微生物菌种,部分菌种为条件致病菌,特殊情况要用到病原菌。如培养基灵敏度检查和无菌检查方法验证试验用到菌种为:金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌、白色念珠菌、黑曲霉。无抑菌作用供试品阳性对照试验菌种为金黄色葡萄球菌,有抑菌作用供试品对照试验菌种为大肠埃希菌、生孢梭菌、白色念珠菌。(其实验室安全级别见表1)
虽然医疗器械阳性对照(接种)室设计没有专门的国家或行业标准,但参考上述卫生部文件要求,并根据《实验室生物安全通用要求》GB 19489–2008规定,危害等级为Ⅱ定义为能引起人或动物发病,但一般情况下对健康工作者、群体、家畜或环境不会引起严重危害的病原体,实验室感染不导致严重疾病,具备有效治疗和预防措施,并且传播风险有限[5]。对应危害等级Ⅱ应采用BSL—2实验室,并配备生物安全柜。
一般情况(对应大部分医疗器械品种):鉴于常规阳性对照(接种),部分种类菌种在人体抵抗力低下(非健康状态)时有致病性,微生物实验室有一定的生物安全风险,建议有条件的企业尽可能使用生物安全柜,避免对操作者造成危害。
特殊情况(对应少部分医疗器械品种):属于如下情况时应遵循不低于BSL–2实验室设置,须有相应级别生物安全柜:
(1)某些含药类医疗器械,尤其是具有抗菌、抑菌功能的,其阳性对照(试验)操作可能产生耐药性菌种的;
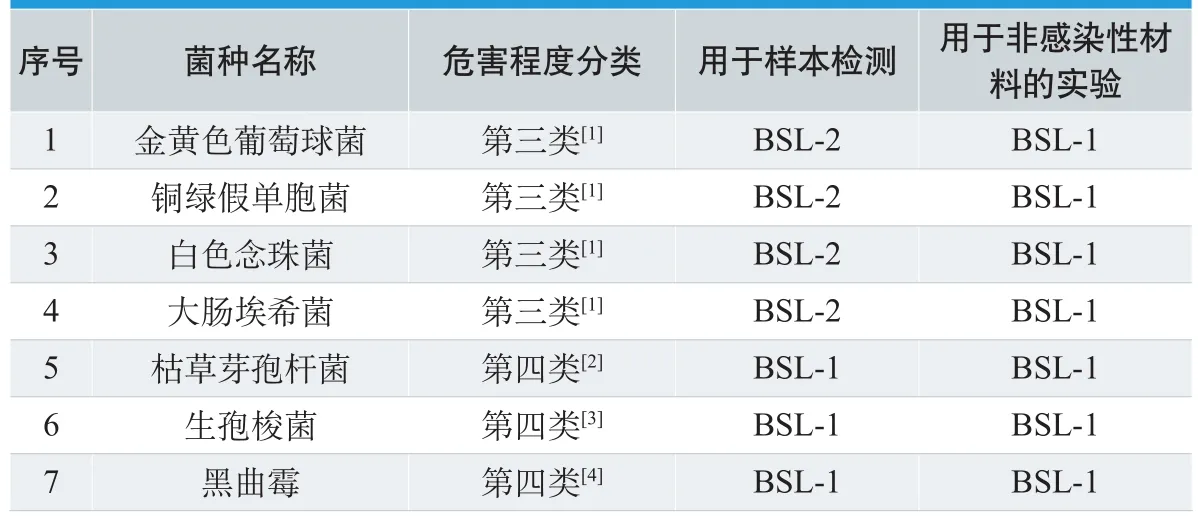
表1.
(2)对含药(尤其是抗生素)类医疗器械灭菌能力进行效能验证需致病性、感染性菌株的;
(3)阳性对照(试验)菌种操作中有喷洒、溢出、甩溅可能的。容易产生气溶胶的行为(对液体或半流体进行摇动、倾注或搅拌操作时,将液体滴加到固体表面上或另一种液体中时,在对琼脂板划线接种、用吸管接种细胞培养瓶)。
对阳性对照(试验)室环境背景,药典未作具体规定。参考《生物安全实验室建筑规范》,二级生物安全实验室可不设空调净化系统,也可根据需要设置带循环回风的空调净化系统。但为了保护实验环境,延长生物安全柜的使用寿命,建议采用机械通风,并加装过滤装置[6]。排风应经过处理后直排。阳性对照室应保持相对负压,这里需要强调的是“相对”二字,如阳性间相对临室为负压,但对大气可能实为正压或负压。在正压的情况下,与非洁净区或室外大气间的静压差不宜过大,以避免阳性间密闭性意外遭破坏时污染物迅速扩散。
2.8 培养室
用于放置微生物生长的细菌培养箱、真菌培养箱和菌种保存的冰箱。室内应保持清洁,不得堆放杂物。大多数企业将其设置为一般环境,但应保持洁净,注意避免使用强效、挥发性、喷雾型的消毒剂,防止影响微生物的生长。
2.9 准备室
准备室即试液及培养基配制、灭菌区域,阳性对照室器皿洗涤、烘干、灭菌、实验室用品准备等没有特殊要求的功能间,可为一般清洁环境。
2.10 细菌内毒素检查室
适用于一次性使用无菌医疗器械及产品标准中要求进行热原检查的产品(一次性使用注射器、输液器、输液泵等)。利用鲎试剂与细菌内毒素产生凝集反应的机理,以判定供试品中细菌内毒素限量是否符合规定。由于此种方法不能检定材料致热,对于非革兰阴性菌不敏感,故热原试验的仲裁法应为家兔法。
进行细菌内毒素含量测定实验所需的器皿需经处理,去除可能存在的外源性干扰,耐热器皿常用干热灭菌法(250˚C、30分钟以上)去除,也可采用其他确认不干扰细菌内毒素检查的适宜方法。若使用塑料器械,应选用标明无内毒素并且对试验无干扰的器械。试验过程应能防止微生物和内毒素污染,目前GB/T 14233.2标准中细菌内毒素试验要求需超净工作台,医疗器械法规和药典未对背景环境要求做明确规定。
2.11 实验室的布局和运行
(1)总体原则
实验室布局设计的基本原则是既要最大可能防止微生物的交叉污染,又要防止检验过程对环境和人员造成危害。应充分考虑到微生物实验室操作规范和试验室安全的要求。通常,实验室划分成洁净或无菌操作区域和活菌操作区域,同时根据试验目的不同,在空间或时间上有效分隔不相容或相互产生干扰的试验活动,将交叉污染的风险降到最低。根据相应功能,无菌检查室和微生物限度检查室在设计上应遵循《医药工业洁净厂房设计规范》GB50457-2008,而阳性对照(试验)室还应部分参考《生物安全实验室建筑规范》GB 50346-2011规定。
(2)国家局规范性文件要求
医疗器械生产企业的无菌检测实验室原则上应设3间万级下的局部百级洁净室,用作无菌室、阳性对照室和微生物限度室。无菌检测实验室原则上应当和洁净生产区分开设置,有独立的区域、单独的空调送风系统和专用的人流物流通道及实验准备区等[7]。
(3)三地省局具体规定(见表2)
以上为三地省局对《医疗器械生产质量管理规范(试行)》的三室设置的进一步解释和说明,比较三者同异,相同的是三室空调系统与产品生产区分开,无菌检验室与微生物限度室的环境背景,阳性对照室不应利用回风,阳性室不作背景的硬性要求。不同的是对无菌检验室与微生物限度室合用问题,广东局未允许合用,北京和上海局规定在特定情况下可以;对生物安全柜和洁净工作台的配备要求北京局与其他两省局不同。其实三地省局都遵循一个总体原则,企业的环境控制合理,符合《规范》要求,切合行业现状。既能保证《规范》的严肃性和全面性,也突出了合理性。

表2.
综合上述条款,并结合《医药工业洁净厂房设计规范》GB50457-2008,具体实施应满足以下要求:新建实验室应当三室分开,无菌检查室、微生物限度室、阳性对照室净化空调系统应与产品生产区分开,不共用同一回(排)风道。无菌检查室、微生物限度检查室应保持相对正压,确保干扰物不向室内流动,避免影响实验结果;阳性对照室应保持相对负压,确保污染物不向室外扩散,避免危害人员安全。
对北京、上海两地,已有改造难度大的实验室无菌检验室、微生物限度室合用,更准确的理解是有条件下的合用。当使用同一人流通路时,包括检查室、更衣室和缓冲间,进行无菌检查或限度检查,则有严格前提条件,即不可同时开展操作,需设定时间间隔,实施前必须进行清场和消毒,防止污染,造成假阳性,上述工作必须经过充分的验证,并形成文件严格执行。
2.12 器具及工作服洗涤、存放要求
《医药工业洁净厂房设计规范》条款5.1.9中规定:空气洁净度100级、10000级医药洁净室(区)的设备、容器及工器具宜在本区域外清洗,其清洗室的空气洁净度等级不应低于100000级。设备、容器及工器具洗涤后应干燥,并应在与使用该设备、容器及工器具的医药洁净室(区)相同的空气洁净度等级下存放。无菌洁净室(区)的设备、容器及工器具洗涤后应及时灭菌,灭菌后应在保持其无菌状态措施下存放。5.1.10无菌洁净区域内不应设置清洁工具洗涤和存放室。按照以上规定,对于无菌检查室和微生物限度检查室的设备、容器及工器具洗涤,企业可利用生产车间洗涤室或单独建立洗涤室,并安置专用干燥和灭菌设备。
条款5.1.11规定:无菌工作服的洗涤和干燥设备宜专用。洗涤干燥后的无菌工作服应在空气洁净度100级单向流下整理,并应及时灭菌。《医疗器械生产质量管理规范无菌医疗器械实施细则》附录中规定:无菌工作服的整理、灭菌后的贮存在10000级洁净室(区)内。按照以上规定,后者为法规要求,有更高强制性,无菌检查室和微生物限度检查室的无菌工作服洗衣间应为10000级,在10000条件下整理封袋,然后灭菌,有条件的企业可在100级下整理封袋。灭菌后的无菌工作服的贮存应在10000级条件下。
建议无菌服经清洗后装入透气袋内在双扉脉动真空灭菌柜进行灭菌(目前此种灭菌柜带有干燥功能,避免二次污染)。
2.13 人员更衣流程
实验室应人物流分开,避免交叉污染。人员在更衣过程中应遵循:换鞋→脱外衣→洗手→穿无菌内衣→手消毒→穿无菌外衣→换无菌鞋→手消毒→戴无菌手套[11]。
3.实例分析:
3.1 例一:(见图1)
此微生物检验室设计存在如下问题:
(1)阳性对照室、无菌操作室、限度检查室共用一更、二更。阳性对照室、微生物限度检查室的样品及衣物可能带菌,污染无菌室,可能出现假阳性结果;
(2)虽然设双层传递窗,但未能实现人物流分开,人员经二更进出阳性对照室、无菌检查室、限度检查室进而和阳性间传递窗进出物料路线存在交叉,有造成污染的风险;
(3)阳性对照室、无菌操作室、限度检查室共用同一走廊,虽然可以用压差梯度进行控制,但是洁净间气流非绝对层流,也存在室间污染的可能,应尽量避免;
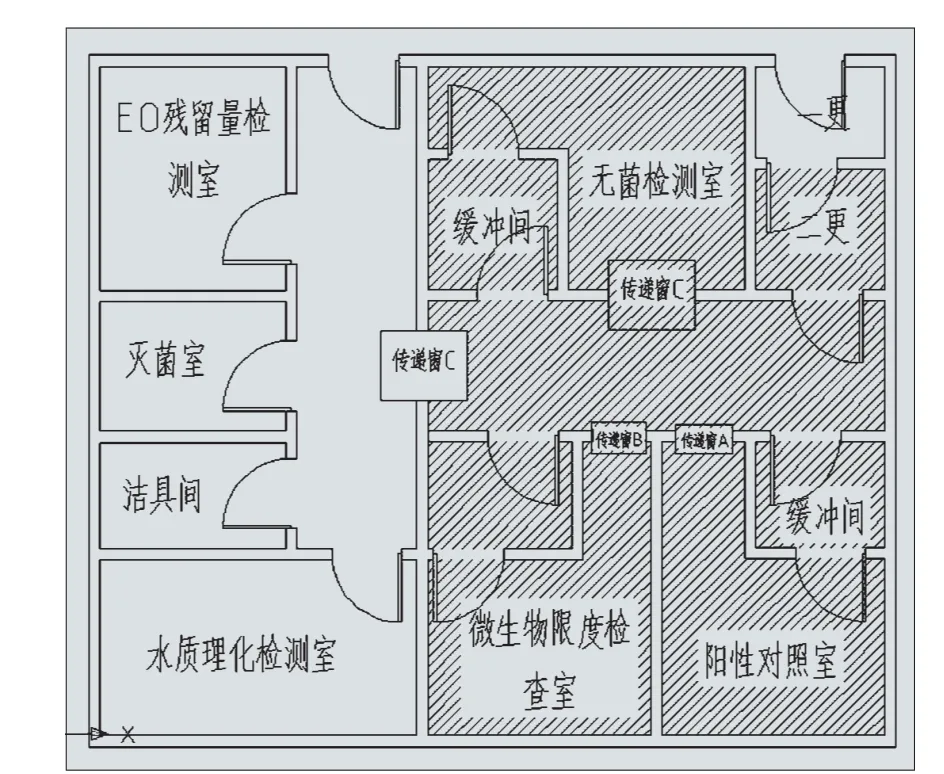
图1.
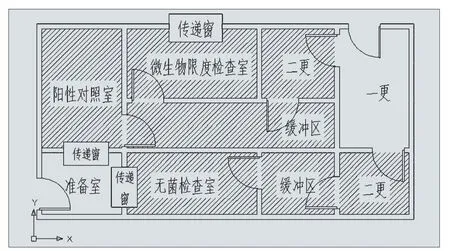
图2.
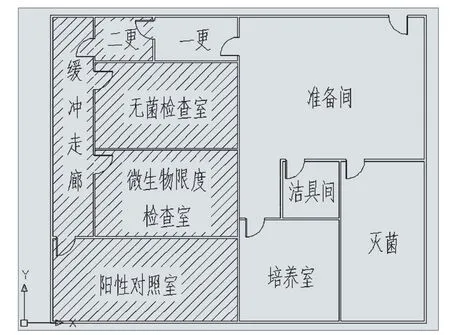
图3.
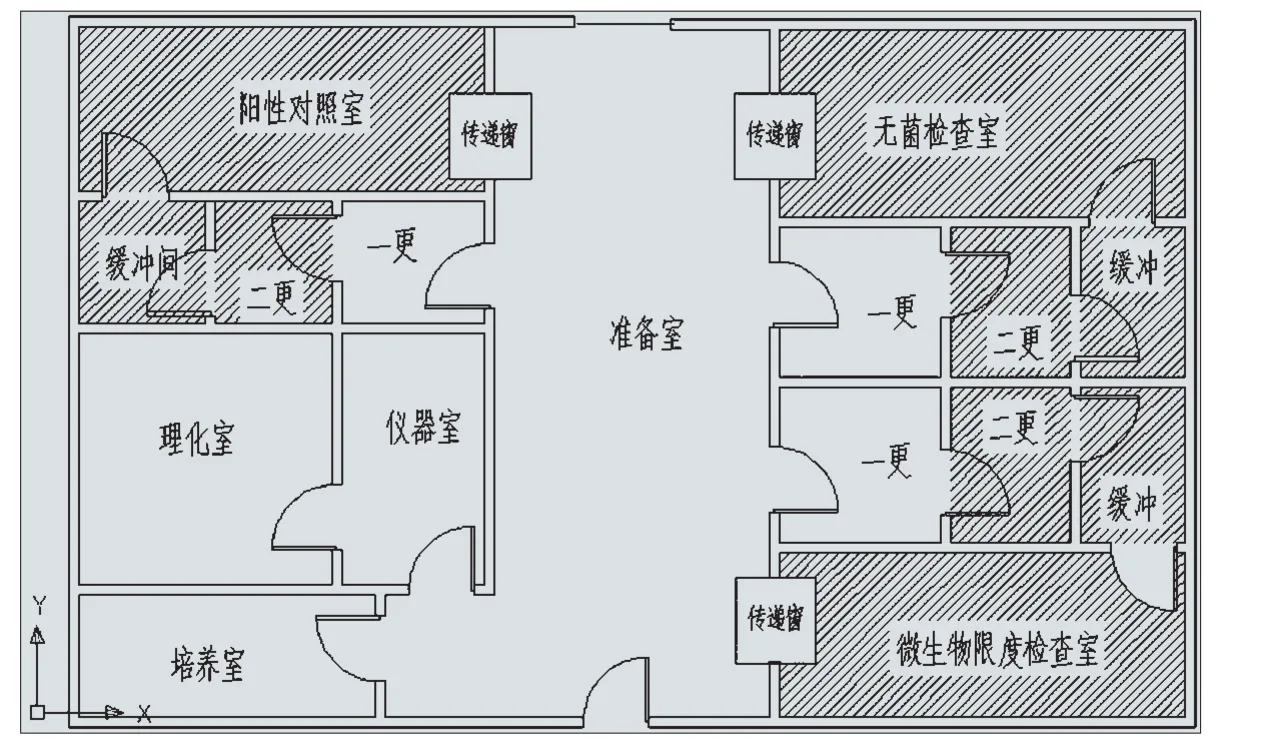
图4.
(4)未设准备室、培养室。
3.2 例二:(见图2)
这是一家改造难度大,需两室合用的微生物实验室,设计存在问题是阳性对照室与微生物限度检查室共用人物流通道,容易造成污染,后期建议企业将阳性检查室与无菌检查室进行对调,同时对送、排风系统进行改造,更好的降低了污染风险。但后期必须要做好清场和验证工作。
3.3 例三 :(见图 3)
这是一家企业的微生物实验室设计方案,为了节省空间,三室共用同一人流通道(二更、缓冲),人员的工作服所携带的污染物不可避免的带入到共用部分,但基于将污染风险降到最低的原则,建议企业不采用此种设计,应做到三室人流、物流分开设计,如无法实现,也应做到阳性室与其他两室人流分开,其他两室共用人流通道也应做到时间上的分隔,并进行充分验证,验证可接受后形成文件并严格执行,从管理上将实验的交叉污染可能性降到最低。
3.4 例四:(见图4)
上图为设计较为合理的微生物实验室(企业生产品种为无菌纱布)。
[1] 卫生部.人间传染的病原微生物名录[Z].卫科教发[2006]15号,2006
[2] 中国药用微生物菌种保藏管理中心.CPCC菌种检索系统[EB/OL].http://www.cpcc.ac.cn/junzhong.php?id=3556&highlight=. [2012-09-24].
[3] 中国科学院微生物研究所. 标准菌种目录.[EB/OL]. http://www.cgmcc.net/index.php/Zypt/index/ptzyh/1511C0002100006448. [2012-09-24].
[4] 中国科学院微生物研究所. 标准菌种目录.[EB/OL]. http://www.cgmcc.net/index.php/Zypt/index/ptzyh/1511C0002300001476. [2012-09-24].
[5] 中华人民共和国国家质量监督检验检疫总局等. GB 19489—2008.实验室生物安全通用要求[S].北京.中国标准出版社,2009.
[6] 中华人民共和国住房和城乡建设部.GB 50346-2011. 生物安全实验室建筑规范[S].北京. 建筑工业出版社,2012.
[7] 国家食品药品监督管理局.关于印发医疗器械生产质量管理规范(试行)及其配套文件有关问题的通知[Z] 国食药监械[2011]54号,2011.
[8] 北京市药品监督管理局.医疗器械生产质量管理体系相关问题的解答[J].首都医药,2011,(10):6-8
[9] 上海市食品药品监督管理局.有关医疗器械生产质量管理规范生产实施细则中的问题问答和解释[EB/OL]. http://www.shfda.gov.cn/gb/node2/node3/node4/node2425/node2428/userobject1ai22302.html. [2010-08-13].
[10] 广东省食品药品监督管理局. 实施《医疗器械生产质量管理规范》有关问题的解释[EB/OL]. http://www.gdda.gov.cn/publicf i les/business/htmlf i les/gdfda/cmsmedia/document/doc16865.doc . [2012-09-24].
[11] 中华人民共和国住房和城乡建设部等. GB 50457—2008.医药洁净厂房设计规范条文说明[S].北京.中国计划出版社,2009.76
