菜籽粕混合菌固体发酵脱毒条件的响应面优化研究
2013-08-22兰时乐毛小伟肖调义王红权邓元元
兰时乐 毛小伟 肖调义 王红权 邓元元 谭 斌
(湖南农业大学,长沙410128)
菜籽粕在我国的年产量在600万t左右[1],是一种潜在营养价值很高的植物蛋白质资源[2-3]。由于菜籽粕中含有硫代葡萄糖甙,在芥子酶作用下 产 生 唑 烷 硫 酮(OZT)、异 硫 氰 酸 酯(ITC)等有毒物质以及植酸、单宁等抗营养因子,其中OZT、ITC等能损害动物甲状腺功能,可能造成牲畜中毒死亡[4]。据齐广海等[5]预测,到2020年中国蛋白质饲料的供需缺口将达到4 800万t。因此,研究开发绿色、安全的可部分或全部替代鱼粉等的蛋白质饲料,无疑会对我国畜牧业的发展起到积极的推动作用。为改善菜籽粕的饲用价值,国内外许多研究工作者进行了大量的研究。菜籽粕脱毒的方法主要有物理、化学及微生物发酵等脱毒方法[6-7]。由于物理和化学脱毒法投资大、技术发展不成熟或直接影响饲料的适口性等,均难以工业化生产。采用微生物固态发酵对菜籽粕脱毒并应用于动物养殖的研究,国内外已有大量报道[8-12],主要集中在脱毒菌种的筛选和混菌发酵条件的简单优化[13-14]。基于菜籽粕固态发酵脱毒过程影响因素较多,且将菜籽粕发酵脱毒后作为畜禽和水产养殖大宗饲料的生产过程参数优化的报道较少,因此确定其最优发酵脱毒过程参数尤为重要。本研究采用混合菌剂固体发酵菜籽粕,生产无毒菜籽粕饲料。采用Box-Behnken试验设计完成整个优化过程,确定其最佳发酵脱毒条件,以降低菜籽粕中硫代葡萄糖苷的含量。
1 材料与方法
1.1 试验材料
1.1.1 发酵菌种
发酵菌种由本实验室自行研制,主要由枯草芽孢杆菌(Bacillus subtilis)、纳豆芽孢杆菌(Bacillus natto)、地衣芽孢杆菌(Bacillus licheniformis)、侧胞芽孢杆菌(Bacillus lateraporus)、丁酸梭状芽孢杆菌(Clostridium butyricum)及酵母菌(Saccharomyces cerevisiae)组成,各菌种的比例为1∶1∶1∶1∶2∶1。粉末状固体,活菌数>1010CFU/g。
1.1.2 培养基
菌种活化培养基(牛肉膏蛋白胨培养基):牛肉膏0.5%,蛋白胨1%,氯化钠0.5%,琼脂1.5%~2.0%,pH 7.0~7.2,121℃灭菌25min。
液体种子培养基:牛肉膏0.5%,蛋白胨1%,氯化钠0.5%,葡萄糖5%,pH 7.0~7.2,45 ℃灭菌25min。
固态发酵培养基主要成分包括菜籽粕、麦麸、葡萄糖、硫酸铵,由湘北水产饲料有限公司提供。菜籽粕的硫代葡萄糖苷含量为3.74mg/g。
1.2 试验方法
1.2.1 菌种培养
斜面菌种培养:将保存于冰箱的斜面菌种接种于新鲜斜面培养基上,37℃恒温培养36h。
液体菌种培养:将培养36h的斜面菌种分别接种于液体菌种培养基中,37℃、150r/min条件下振荡培养18~24h。
1.2.2 固态发酵脱毒培养
按比例称取粉碎至20目的菜籽粕和麦麸10kg于塑料桶中(容积为15L),将葡萄糖和硫酸铵溶于水后加入菜籽粕中,调节含水量和pH,按要求接入培养好的液体菌种,搅拌均匀,置于不同温度下静置发酵5d,发酵过程中通过翻料和通风控制发酵温度。
1.2.3 发酵条件研究
1.2.3.1 单因素试验设计
以葡萄糖和硫酸铵添加量、料水比、接种量、起始pH、发酵温度及发酵时间为单因素,考察其对硫代葡萄糖苷降解率的影响。每组试验设3个重复。
分别在固体发酵培养基中加入0、0.5%、1.0%、1.5%、2.0%和2.5%的葡萄糖,其他条件不变,发酵结束后测定发酵物料中的硫代葡萄糖苷的含量,并计算其降解率。
分别在固体发酵培养基中加入0、0.5%、1.0%、1.5%、2.0%和2.5%的硫酸铵,其他条件不变,发酵结束后测定发酵物料中的硫代葡萄糖苷的含量,并计算其降解率。
调节起始料水比分别为1.00∶0.35、1.00∶0.40、1.00∶0.45、1.00∶0.50、1.00∶0.55、1.00∶0.60 和1.00∶0.65,其他条件不变,发酵结束后测定发酵物料中的硫代葡萄糖苷的含量,并计算其降解率。
用稀酸或稀碱分别调节发酵培养基的pH为5.5、6.0、6.5、7.0、7.5、8.0和8.5,在 上 述 获 得 适宜的发酵条件基础上,发酵结束后测定发酵物料中的硫代葡萄糖苷的含量,并计算其降解率。
分别选择30、35、40、45、50和55℃作为发酵温度,其他条件不变,发酵结束后测定发酵物料中的硫代葡萄糖苷的含量,并计算其降解率。
将培养好的固体菌种按3%、4%、5%、6%、7%、8%的接种量接入固体发酵培养基中,其他条件不变,发酵结束后测定发酵物料中的硫代葡萄糖苷的含量,并计算其降解率。
根据发酵温度、料水比、起始pH、接种量、葡萄糖和硫酸铵添加量对硫代葡萄糖苷的降解效果结果,研究发酵时间对硫代葡萄糖苷降解效果的影响。
1.2.3.2 最佳发酵条件研究
在单因素试验基础上,采用Design Expert 7.1.6软件,根据 Box-Benhnken试验设计原理,选取影响较大的接种量、发酵温度、料水比和发酵时间4因素,建立硫代葡萄糖苷降解率与各因素之间的数学模型,通过计算来优化最佳的发酵条件,以确定菜籽粕发酵脱毒的最佳条件。
1.2.4 测定方法
将发酵好的菜籽粕于55~60℃条件下烘干,粉碎至80目后进行相关指标测定。
硫代葡糖糖苷降解率按照王宁惠[15]的方法进行测定,计算公式为:
硫代葡糖糖苷降解率(%)=(发酵前硫代葡糖糖苷
含量-发酵后硫代葡糖糖苷含量)/发酵前硫代葡糖糖苷含量×100。
2 结果与分析
2.1 单因素试验
单因素试验筛选最适葡萄糖添加量、硫酸铵添加量、起始pH、料水比、发酵时间、发酵温度等对硫代葡萄糖苷降解率的影响。
2.1.1 葡萄糖添加量对硫代葡萄糖苷降解率的影响
由表1可见,随着葡萄糖添加量的增加,硫代葡萄糖苷降解率也随之增加,当葡萄糖添加量为1.0%时,硫代葡萄糖苷降解率到达77.31%,但葡萄糖添加量超过1.0%,硫代葡萄糖苷降解率明显下降。其主要原因是葡萄糖添加量过大,改变了发酵培养基的碳氮比(C/N),从而影响了微生物酶的合成和分泌。

表1 葡萄糖添加量对硫代葡萄糖苷降解率的影响Table 1 Effects of glucose addition on degradation rate of glucosinolate %
2.1.2 硫酸铵添加量对硫代葡萄糖苷降解率的影响
由表2可见,硫酸铵添加量为0.5%时,硫代葡萄糖苷降解率最高,达到77.53%,故选择硫酸铵最适添加量为0.5%。

表2 硫酸铵添加量对硫代葡萄糖苷降解率的影响Table 2 Effects of(NH4)2SO4addition on degradation rate of glucosinolate %
2.1.3 料水比对硫代葡萄糖苷降解率的影响
由表3可见,随着料水比的增加,硫代葡萄糖苷降解率增加,当料水比为1.00∶0.55时,硫代葡萄糖苷降解率为81.38%。但料水比超过1.00∶0.55,硫代葡萄糖苷降解率明显下降。水是微生物进行生命活动不可缺少的营养物质,但物料中含水量太低,培养基中营养物质不能得到充分的溶解而影响微生物对其的吸收和利用;而物料中含水量太高时,导致培养基的通透性降低而影响氧气的传递,同样影响微生物的生长和代谢,进而影响硫代葡萄糖苷的降解。
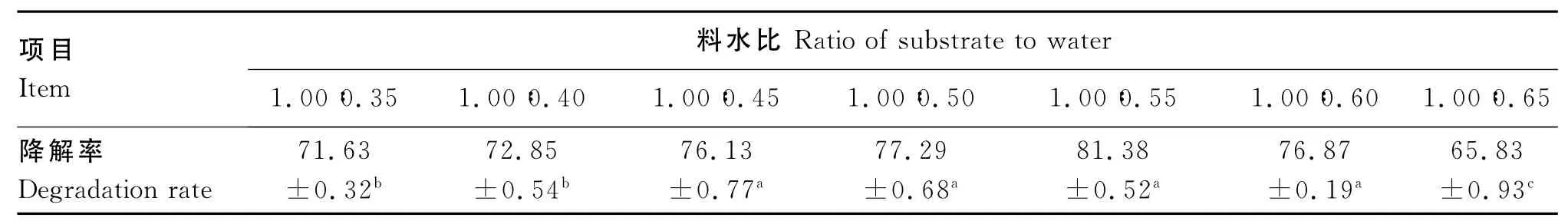
表3 料水比对硫代葡萄糖苷降解率的影响Table 3 Effects of the ratio of substrate to water on degradation rate of glucosinolate %
2.1.4 起始pH对硫代葡萄糖苷降解率的影响
培养基的酸碱度是影响微生物生长和代谢的主要因素之一,适宜的酸碱度有利于微生物对营养物质的吸收利用及代谢。由表4可知,培养基酸碱度过高或过低都对硫代葡萄糖苷降解率有较明显的影响,当起始pH为6.0时,硫代葡萄糖苷的降解率达到79.04%。
2.1.5 发酵温度对硫代葡萄糖苷降解率的影响
不同的微生物都有其适宜的生长温度和酶最佳反应温度,在混合菌发酵中必须都处在一个适宜的温度才能发挥各菌的优势,否则达不到混菌发酵的目的。由表5可见,当发酵温度为45℃时,硫代葡萄糖苷降解率最高,达到82.34%,温度升高,硫代葡萄糖苷降解率下降。
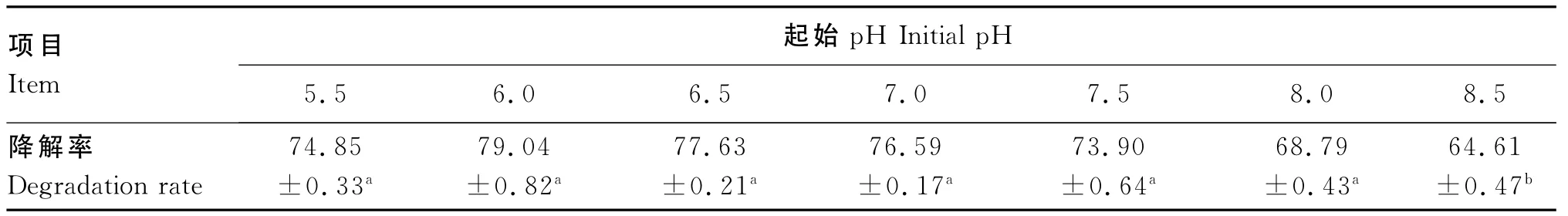
表4 起始pH对硫代葡萄糖苷降解率的影响Table 4 Effects of initial pH value on degradation rate of glucosinolate %

表5 发酵温度对硫代葡萄糖苷降解率的影响Table 5 Effects of cultural temperature on degradation rate of glucosinolate %
2.1.6 接种量对硫代葡萄糖苷降解率的影响
由表6可知,随着接种量的增大,硫代葡萄糖苷降解率增加,当接种量为7%时,硫代葡萄糖苷降解率为82.32%。因为适宜的接种量可以缩短菌种生长的延迟期,使降解硫代葡萄糖苷的酶系提前合成和分泌,但过大的接种量会导致培养基中的营养物质过快消耗,且代谢副产物的积累较多,从而改变微生物生长和代谢的环境条件,影响酶系的合成。因此,采用7%的接种量较为适宜。

表6 接种量对硫代葡萄糖苷降解率的影响Table 6 Effects of inoculation amount on degradation rate of glucosinolate %
2.1.7 发酵时间对硫代葡萄糖苷降解率的影响
由表7可见,发酵前期是菌种生长期,硫代葡萄糖苷降解率随发酵时间的延长提高较快,至发酵168h,硫代葡萄糖苷降解率达93.16%,发酵144h后,硫代葡萄糖苷降解率增加较为缓慢。主要原因是随发酵时间延长,培养基中营养物质逐步消耗,微生物生长和代谢速度变慢,酶分泌量减少,导致硫代葡萄糖苷降解率增加量降低。综合考虑,选择适宜的发酵时间为144h。

表7 发酵时间对硫代葡萄糖苷降解率的影响Table 7 Effects of fermentation time on degradation rate of glucosinolate %
2.2 响应面发酵条件优化
2.2.1 响应面试验设计及结果分析
基于单因素试验结果,选取接种量、发酵温度、料水比和发酵时间对硫代葡萄糖苷降解率影响较大的4个因素,硫代葡萄糖苷降解率为响应值,每个因素取3个水平,进行响应面分析设计和试验,进一步优化各因素的参数值。各因素水平的编码表见表8。
经软件Design Expert 7.1.6设计响应面分析试验,结果见表9。
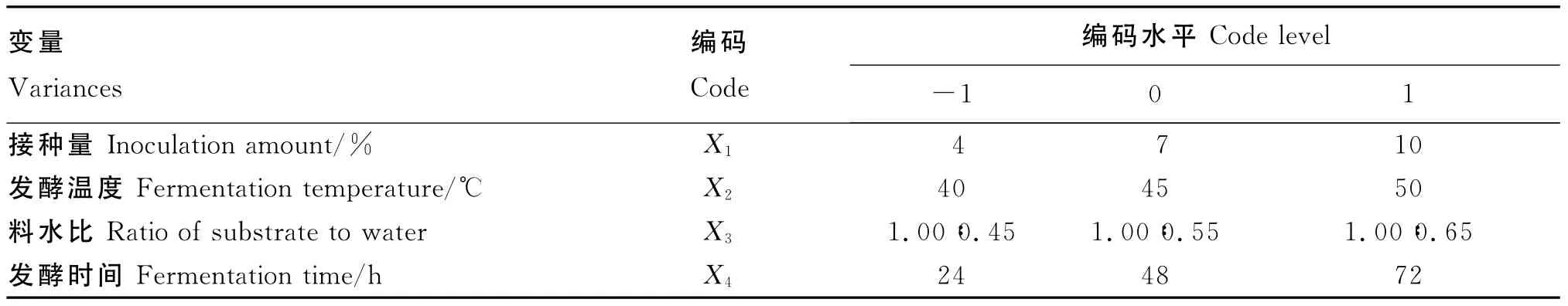
表8 试验设计因素水平及编码Table 8 Design of experimental factors and codes
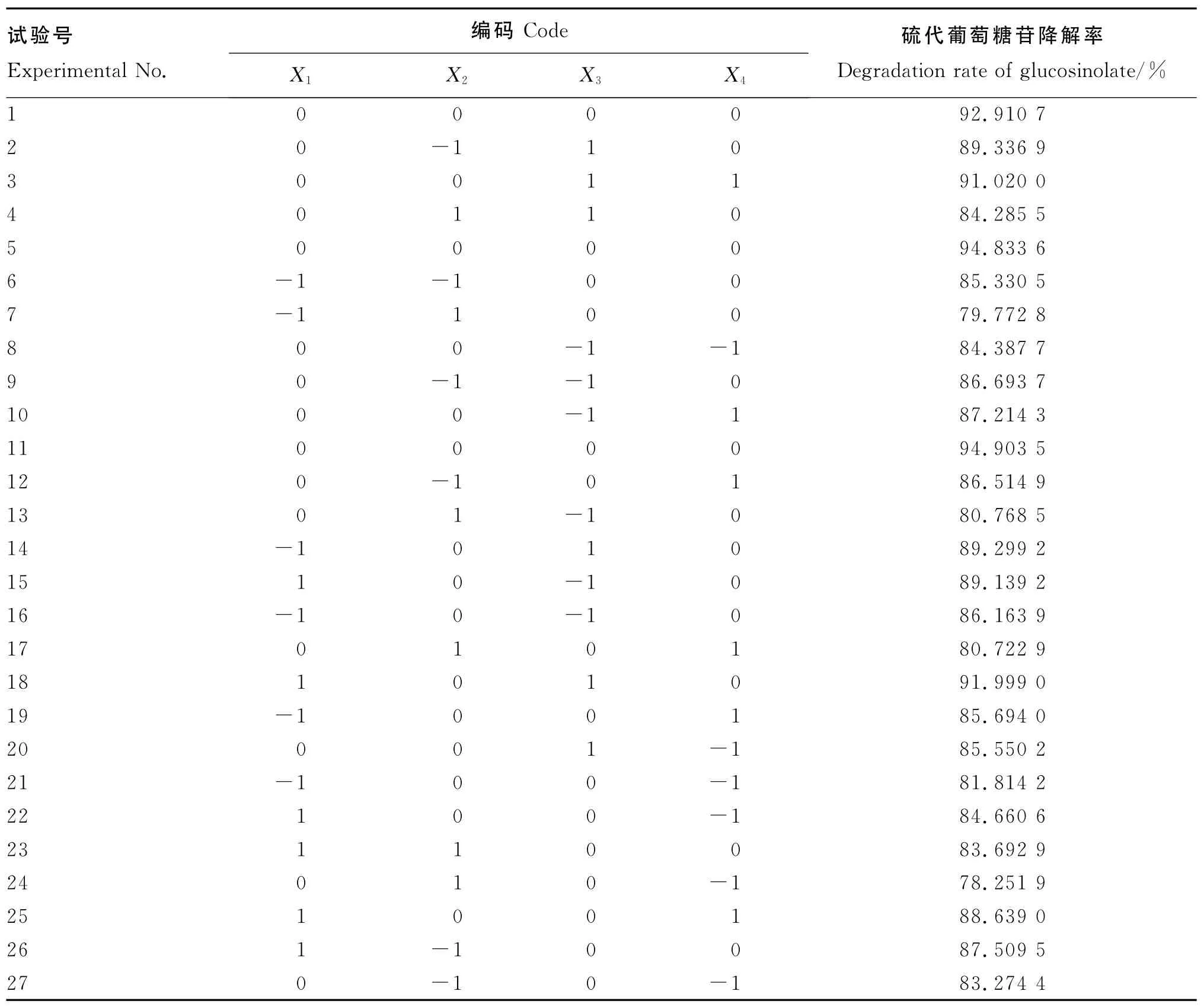
表9 Box-Benhnken响应面试验设计及结果Table 9 Box-Benhnken response surface design and results
根据表9试验结果,采用 Design-Expert 7.1.6软件对试验结果进行分析。由表10可知,X1、X2、X3、X4、X21、X22、X23、X24对 硫 代 葡 萄 糖 苷 降 解 率(Y)的影响极显著(P<0.000 1),说明接种量、发酵温度、料水比和发酵时间是发酵过程中的重要因素,但交互作用不显著(P>0.05)。失拟项不显著(P>0.05),说明数据中没有异常点,模型适当。
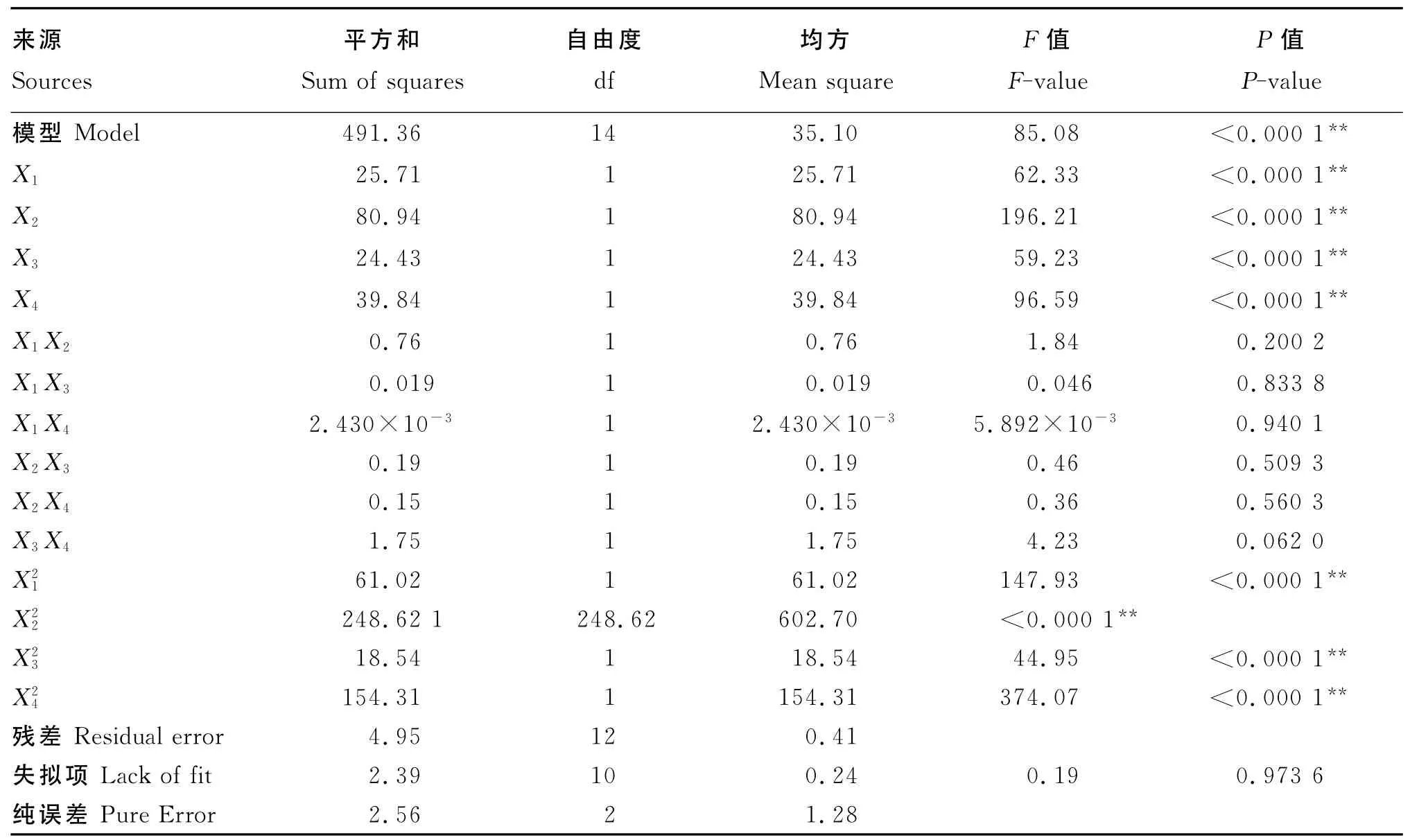
表10 响应面结果方差分析Table 10 Analysis of variance of experimental results of response surface
用Design-Expert 7.1.6软件分析模型的可信 度,结果见表11。

表11 二次回归方程的方差分析Table 11 Analysis of variance of the quadratic model
根据响应面系数的回归分析,得到该次模型的拟合方程为:Y=94.215 9+1.463 8 X1-2.597 1X2+1.427 0X3+1.822 2X4+0.435 3X1X2-0.068 9X1X3+0.024 7X1X4+0.218 5X2X3-0.192 4 X2X4+0.660 8 X3X4-3.382 6 X21-6.827 7 X22-1.864 7 X23-5.378 9 X24。回归方程的方差分析结果见表10、表11。从表10、表11可以看出,回归模型极显著(P<0.001),失拟项不显著(P=0.973 6),表明回归方程拟合度良好;回归方程的复相关系数为0.990 0,表明99.00%的硫代葡萄糖苷降解率变化可由此模型解释,与实际情况拟合很好;校正相关系数为0.978 4。硫代葡萄糖苷降解率变异系数为0.74%,信噪比为34.328,说明模型可信度较高。该方程为菜籽粕混合菌发酵脱毒提供了一个合适的模型,因此可用上述模型代替真实试验点对混合菌发酵菜籽粕脱毒进行分析和预测。
2.2.2 响应面分析
采用Design Expert 7.1.6软件对回归模型进行规范分析,接种量、发酵温度、料水比和发酵时间4个因素交互影响硫代葡萄糖苷降解率的响应面图和等高线图见图1~图6。

图1 发酵温度和接种量对硫代葡萄糖苷降解率影响的相应面图和等高线图Fig.1 Response surface and contour graph of the effects of fermentation temperature and inoculation amount on degradation rate of glucosinolate
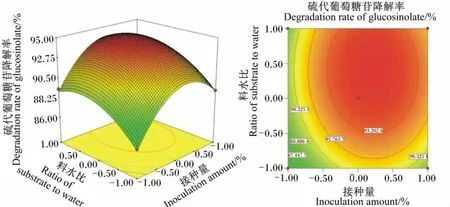
图2 料水比和接种量对硫代葡萄糖苷降解率影响的相应面图和等高线图Fig.2 Response surface and contour graph of the effects of ratio of substrate to water and inoculation amount on degradation rate of glucosinolate
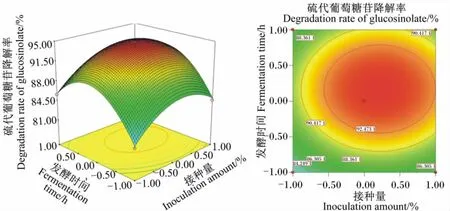
图3 发酵时间和接种量对硫代葡萄糖苷降解率的影响相应面图和等高线图Fig.3 Response surface and contour graph of the effects of fermentation time and inoculation amount on degradation rate of glucosinolate
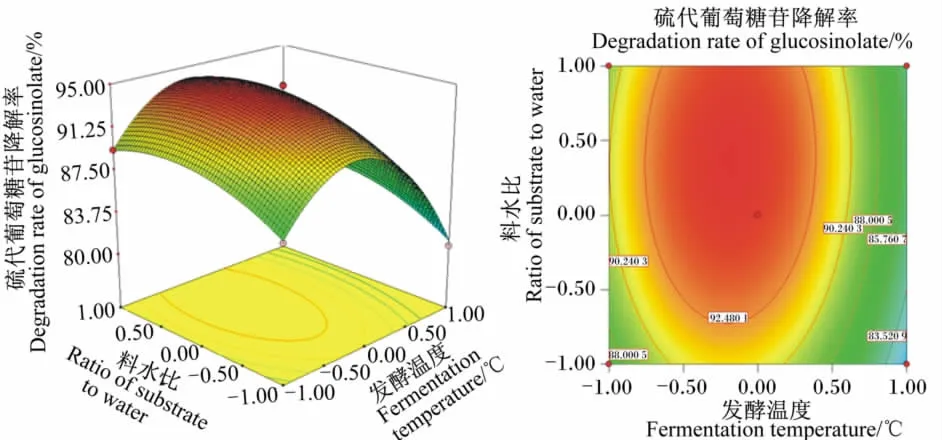
图4 发酵温度和料水比对硫代葡萄糖苷降解率影响的相应面图和等高线图Fig.4 Response surface and contour graph of the effects of fermentation temperature and ratio of subtrate to water on degradation rate of glucosinolate
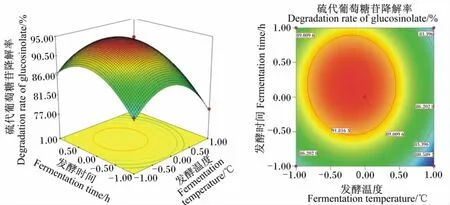
图5 发酵温度和发酵时间对硫代葡萄糖苷降解率影响的相应面图和等高线图Fig.5 Response surface and contour graph of the effects of fermentation temperature and fermentation time on degradation rate of glucosinolate
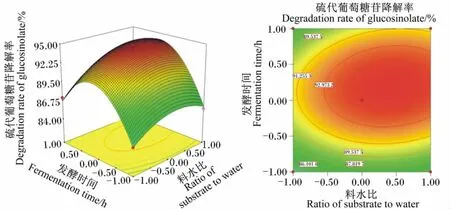
图6 发酵时间和料水比对硫代葡萄糖苷降解率影响的相应面图和等高线图Fig.6 Response surface and contour graph of the effects of fermentation time and ratio of substrate to water on degradation rate of glucosinolate
等高线的形状可以反映出因素之间交互效应的强弱,圆形表示两因素不显著,而椭圆则表示较为显著[16]。当发酵时间和接种量处于最佳水平时,发酵温度和接种量的交互作用见图1。
由图1可以看出,随着发酵温度升高,硫代葡萄糖苷降解率先上升后迅速下降;随着接种量增加,硫代葡萄糖苷降解率先上升后下降,说明发酵温度和接种量存在显著的交互作用。当发酵温度和发酵时间处于最佳水平时,料水比和接种量的交互作用见图2。由图2可以看出,随着料水比和接种量的增加,硫代葡萄糖苷降解率呈先迅速上升后下降的趋势,但接种量较大时,硫代葡萄糖苷降解率较料水比增加下降明显,说明二者对硫代葡萄糖苷降解率有显著的影响。当发酵温度和料水比处于最佳水平时,发酵时间和接种量的交互作用见图3。由图3可以看出,随着发酵时间和接种量的延长和增加,硫代葡萄糖苷降解率呈先迅速上升后明显下降趋势,说明二者对硫代葡萄糖苷降解率有极显著的影响,二者交互作用形成的曲面为抛物面,也说明发酵时间和接种量之间存在交互作用。当发酵时间和接种量处于最佳水平时,发酵温度和料水比的交互作用见图4。由图4可以看出,当发酵温度较低时,硫代葡萄糖苷降解率随着发酵温度的升高而升高,而发酵温度超过+0.5水平时,硫代葡萄糖苷降解率迅速下降;硫代葡萄糖苷降解率随料水比增加而升高,在接近+1.0水平时有所下降。这说明发酵温度和料水比对硫代葡萄糖苷降解率有显著的影响。当接种量和料水比处于最佳水平时,发酵温度和发酵时间的交互作用见图5。由图5可以看出,随着发酵温度和发酵时间的提高和延长,硫代葡萄糖苷降解率呈先迅速上升后迅速下降的趋势,说明二者对硫代葡萄糖苷降解率有极显著的影响。当发酵温度和接种量处于最佳水平时,发酵时间和料水比的交互作用见图6。由图6可以看出,发酵时间和料水比交互作用显著。
2.2.3 显著因素水平优化
运用Design Expert 7.1.6对回归模型进行进行规范性分析,寻求最大硫代葡萄糖苷降解率的稳定点及对应的因素水平,结合图1~图6给出的回归方程的三维响应面图以及等高线图可知,回归模型存在稳定点,稳定点即最大值。对回归方程分别求一阶偏导等于零,结果如下:
1.4638-6.765 2 X1+0.435 3 X2-0.068 8 X3+0.024 7 X4=0,
-2.597 1+0.435 3 X1-13.655 3 X2+0.218 5 X3-0.192 4 X4=0,
1.4270-0.068 9 X1+0.218 5 X2-3.729 4 X3+0.660 8 X4=0,
1.8222+0.024 7 X1-0.192 4 X2+0.660 8 X3-10.757 9 X4=0。
解方程组得到模型的最佳因素编码为:X1=0.204 1,X2=-0.180 1,X3=0.403 4,X4=0.197 8,将其代入回归方程,得到预测硫代葡萄糖苷降解率最大值为94.925 1%。各个编码所对应的 X1、X2、X3、X4实际取值为接种量为7.7%,发酵温度为44.1℃,料水比1.000∶0.585,发酵时间52.6h。
2.2.4 模型的验证
为了验证模型的有效性,根据优化试验所得的各因素优化值,即接种量7.7%,发酵温度44℃,料水比1.000∶0.585,发酵时间53h条件下进行菜籽粕脱毒发酵试验,重复3次试验,测得的硫代葡萄糖苷降解率平均值为94.850 6%(表12)。与理论预测值94.925 1%接近,相对误差为0.078%,可见该模型能较好地预测菜籽粕发酵脱毒情况。
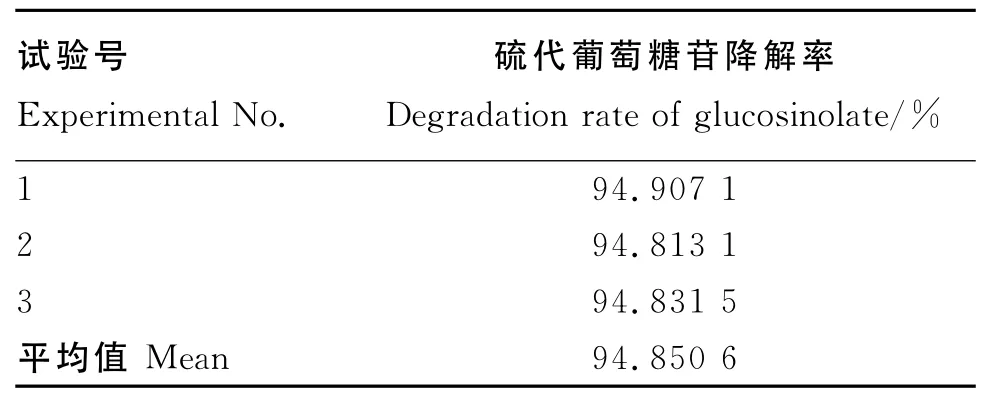
表12 响应面试验的验证Table 12 Certification of response surface experiment
3 讨 论
本文通过优化菜籽粕作为主要基质混合菌种固体发酵脱毒生产畜禽及水产养殖饲料的发酵过程参数,建立了关键因子影响硫代葡萄糖苷的二次多项数学模型,系统研究并确定了菜籽粕固体发酵脱毒的工艺条件,为实现菜籽粕微生物发酵脱毒工业化生产提供了理论依据。通过响应面试验设计得到了接种量、发酵温度、料水比和发酵时间对硫代葡萄糖苷降解率影响的数学模型:Y=94.215 9+1.463 8 X1-2.597 1 X2+1.427 0 X3+1.822 2 X4+0.435 3 X1X2-0.068 9 X1X3+0.024 7 X1X4+0.218 5 X2X3-0.192 4 X2X4+0.660 8X3X4-3.382 6X21-6.827 7X22-1.864 7X23-5.378 9 X24。统计分析结果表明,该模型的相关系数R2=0.978 4,模型与实际情况符合很好,证明该模型能反映出4个因子对混合菌固体发酵菜籽粕硫代葡萄糖苷降解率的影响。硫代葡萄糖苷降解率变异系数为0.74%,信噪比为34.328,说明试验的可靠性较高,此模型能较好地反映试验结果。
微生物发酵菜籽粕脱毒的关键是菌种选择,不同微生物菌种对硫代葡糖糖苷的降解能力不同,筛选优良的微生物菌种是影响菜籽粕脱毒效果的首要条件。在国内外所采用的微生物脱毒法中,大多是采用单一或复合菌种进行固体发酵[9,13,17-22],除了微 生 物 菌 种 的 影 响 外,固 体 发 酵过程中基质的含水量、pH、辅料添加、通气量、温度、培养基的组成等对发酵效果有着很大的影响[23-24]。蒋玉琴等[9]利用乳酸菌、酵母菌、少孢子根霉菌混合培养得到的复合菌系发酵菜籽粕,在pH 4.7、含水量85%~90%条件下发酵32h,硫代葡萄糖苷降解率达71.6%;陆豫等[10]使用白地霉和米曲霉脱毒菜籽粕,在料水比1∶2,29℃发酵47 h,硫代葡萄糖苷降解率达97.0%;孙林等[25]比较植物乳杆菌、枯草芽孢杆菌、蜡样芽孢杆菌及酪酸梭状芽孢杆菌对硫代葡萄糖苷降解情况,其中以植物乳杆菌降解效果最好,适宜条件下48h硫代葡萄糖苷降解率可达85.19%;李延海等[26]利用白地霉K对菜籽饼进行微生物发酵脱毒试验研究,ITC、OZT含量分别降低了83.81%、83.19%。本研究结果表明,在单因素试验结果基础上,选用接种量、料水比、发酵温度和发酵时间采用响应面法对发酵条件进行优化,菜籽粕中硫代葡萄糖苷降解率达94.850 6%,高于国内外报道的有关菜籽粕发酵脱毒的文献资料结果。
4 结 论
① 菜籽粕脱毒的最优条件为:接种量7.7%,发酵温度44.1℃,料水比1.000∶0.585,发酵时间52.6h,硫代葡萄糖苷降解率最高为94.925 1%。
② 通过验证试验,测得硫代葡萄糖苷平均降解率为94.850 6%,与理论预测值相比,相对误差仅为0.078%,说明模型能较好地预测混合菌固体发酵菜籽粕脱毒的实际情况,具有较强的生产指导意义。
[1] 蒋新正.我国大豆、菜籽、花生等油料、油脂、饼粕的供需情况分析[J].中国油脂,2002,27(6):73-74.
[2] 张宗舟.发酵法菜籽饼脱毒机理研究[J].中国医学生物技术应用杂志,2004,3(3):34-38.
[3] LEWIS A J,BAYLEG H S.Bioavailability of nutrients for animals:amino acids,minerals and vitamins[M].New York:Academic Press Inc.,1997:35-65.
[4] TRIPATHI M K,MISHRA A S.Glucosinolates in animal nutrition:a review[J].Animal Feed Science and Technology,2007,132(1/2):1-27.
[5] 齐广海,武书庚,李东.加入 WTO我国饲料工业科技发展战略与方向(上)[J].饲料广角,2002(3):33-35.
[6] 苏李伟.菜籽饼微生物脱毒生产高效蛋白饲料的可行性分析[J].新疆畜牧业,1998(4):32-33.
[7] 张宗舟,赵萍,岳达昌.菜籽饼去毒方法分析与评价[J].甘肃农业大学学报,1991(4):433-436.
[8] ROZAN F,VILIAUME C,BAU H M.Detoxication of rapeseed meal by rhizopusoligosorus sp-t3-a first steptowards rapeseed protein concentrate[J].Intemational Journal of Food Science &Technology,1996,3l(1):85-90.
[9] 蒋玉琴,李荣林,邵明减,等.复合菌脱毒菜籽饼粕及其应用研究Ⅰ:不同处理条件下复合菌体系发酵对菜籽饼粕硫甙的降解[J].江苏农业学报,1999,5(2):104-106.
[10] 陆豫,余勃.发酵菜籽粕脱毒工艺优化研究[J].食品科学,2007,28(10):267-27l.
[11] CHIOU P W S,CHEN C,YU B.Effects of Aspergillus oryzae fermentation extract on in situ degradation of feedstuffs[J].Asian-Australasian Journal of Animal Sciences,2000,13(8):1076-1083.
[12] FRANKE K,MEYER U,WAGNER H,et a1.Influence of various iodine supplementation levels and two different iodine species on the iodine content of the milk of cows fed rapeseed meal or distillers dried grains with solubles as the protein source[J].Journal of Dairy Science,2009,92:4514-4523.
[13] 叶龙祥,牛兴亮.菜籽粕混菌发酵脱毒研究[J].粮食与食品工业,2010,17(4):41-44.
[14] 何国菊,李学刚,赵海伶.菜籽饼粕脱毒工艺参数的研究[J].中国油脂,2003,28(12):23-26.
[15] 王宁惠.油菜籽(饼粕)中硫代葡萄糖甙总量速测方法-氯化钯法[J].青海农林科技,2009(3):58-59.
[16] 毋锐琴,杜双奎,李志西,等.细菌纤维素发酵培养基的优化及超微观结构分析[J].生物工程学报,2008,24(6):1068-1074.
[17] LENZ J,HOFER M,KRASENBRINK J B,et al.A survey of computational and physical methods applied to solid-state fermentation[J].Applied Microbiology and Biotechnology,2004,65:9-17.
[18] DE REU J C,ZWIETERING M H,ROMBOUTS F M,et al.Temperature control in solid substrate fermentation through discontinuous rotation[J].Applied Microbiology and Biotechnology,1993,40:261-265.
[19] 谢建坤,张强.菜籽饼发酵菌株筛选研究[J].江西农业学报,1994,6(1):75-81.
[20] 钟世荣,余伯良,林琦.菜籽饼粕与酱油渣混合发酵生产蛋白饲料的研究[J].粮食与饲料工业,2001(8):27-29.
[21] 张宗周.菜籽饼生物脱毒的微生物筛选复配、脱毒机理与应用效果研究[D].博士学位论文.兰州:甘肃农业大学,2003.
[22] VIG A P,WALIA A.Beneficial effects of rhizopus oligosporus fermentation on reduction ofglucosinolates,fiber and phytic acid in rapeseed(Brassicanapus)meal[J].Bioresource Technology,2001,78:309-312.
[23] RAKARIYATHAM N,SAKORN P.Biodegradation of glucosinolates in brown mustard seed meal(Brassicajuncea)by Aspergillus sp.NR-4201in liquid and solid-state cultures[J].Biodegradation,2002(13):395-399.
[24] BAU H M,VILLAUME C,LIN C F,et a1.Effect of solid-state fermentation using Rhizopus oligosporus sp.T-3on elimination of antinutritional substances and modification of biochemical constituents of defatted rapeseed meal[J].Journal of the Science of Food and Agriculture,1994,65(3):315-322.
[25] 孙林,李吕木,张邦辉,等.多菌种固态发酵菜籽粕的研究[J].中国粮油学报,2009,24(1):85-89.
[26] 李延海,耿二强.用微生物发酵脱毒菜籽粕[J].中国饲料,1997(17):35-36.
