32P-玻璃微球瘤内注射抗肿瘤作用及对外周血白细胞的影响
2013-08-22陈金凤王振兴曾雅静广东省东莞市中心血站523930
陈金凤,王振兴,曾雅静(广东省东莞市中心血站 523930)
上世纪80年代中期,有研究将32P做成玻璃微球用于治疗肿瘤,其主要特点是可在肿瘤局部形成点状内照射放射源,所载高能量核素不泄漏进入血液,具有瘤内血管局部栓塞致肿瘤缺血缺氧坏死的作用,应用前景十分广阔。本研究采用小鼠肿瘤模型实验,探讨32P-玻璃微球(32P-GMS)抑制肿瘤的效果及其对外周血细胞计数的影响,间接反映该治疗方法对机体免疫系统、骨髓组织的影响,从而为放射性同位素肿瘤内注射治疗肿瘤提供实验数据。
1 材料与方法
1.132P-GMS 由成都中核高通同位素股份有限公司提供。为灰褐色微球,粒径46~76μm,密度为2.0~2.5g/cm3。32P溶出度30d之内小于0.1%。放射纯β射线,放射性核纯度为99%,其中γ射线含量小于2%。放射性比活度为550~3 700 MBq/g(15~100mCi/g)。32P放射性半衰期为14.28d,平均能量为0.69MeV(最大能量1.71MeV)。在实体瘤组织内的最大穿透距离为8.0mm,平均距离为3.2mm。使用前须将32PGMS与超液化碘油(约100mg/mL)充分振荡混匀,制备成混悬液后使用。
1.2 实验小鼠及瘤株
1.2.1 清洁级实验小鼠 周龄6~8周,体质量(20±2)g,雌雄各半,由广东医学院实验动物中心提供。
1.2.2 小鼠S180肉瘤细胞 广东医学院天然药物实验中心传代保存并提供。
1.3 主要仪器 净化工作台(SW-CJ-1D型)由苏州净化设备厂提供,电子天平(AEG-220)由日本SHIMADZU公司提供,全自动血细胞计数仪(BC-3000PLUS)由深圳迈瑞公司提供,电热鼓风干燥箱(CS-101-2AB)由重庆银河试验仪器有限公司提供。
1.4 方法
1.4.1 实验分组 采用随机区组法将实验小鼠随机分为对照组、肿瘤模型组和低、中、高3个不同剂量32P-GMS实验组,每组8只。对照组小鼠每只在腹腔内注射0.5mL生理盐水,肿瘤模型组小鼠每只在实体瘤中心注射0.5mL生理盐水,低、中、高剂量32P-GMS实验组分别在实体瘤中心注射终浓度为0.74、3.7、18.5MBq/mL的32P-GMS混悬液各0.5mL。
1.4.2 肿瘤模型的建立 将传代保存的S180肉瘤细胞无菌接种于小鼠腹腔;7d后,选择生长良好的小鼠,采用颈椎脱臼法处死小鼠。然后将小鼠置于75%的酒精中浸泡消毒5min,取出小鼠置操作台上,用医用镊子牵拉起小鼠腹壁皮肤,用5mL医用注射器穿刺入小鼠腹腔空腔内,缓慢采集腹水,注射器内可见乳白色浓稠腹水,然后用无菌生理盐水按照1∶4的比例稀释腹水,取少量稀释后的腹水于离心管中,加入锥虫蓝染色,染色后用计数盘在显微镜下计数活细胞数,活细胞数大于98%方可使用。如果达到使用要求应尽快在超净工作台接种于实验小鼠右腋窝皮下,接种量0.2mL/只,于30min内完成。然后每天观察记录小鼠的活动情况,第7天取眼球静脉血后,脱臼处死,完整剥取肿瘤组织。
1.4.3 外周血白细胞分类计数 各实验组小鼠第7天取眼球静脉血,取血量0.5mL/只,用白细胞稀释液稀释计数,并做血涂片,瑞姬氏染色,计算淋巴细胞占白细胞的百分率。
1.4.4 肿瘤抑制率 不同剂量32P-GMS组小鼠给药后第7天称重,处死后完整剥离肿瘤组织并称瘤重,计算抑瘤率。抑瘤率=(对照组瘤重-不同剂量32P-GMS组瘤重)/对照组瘤重×100%。
1.5 统计学处理 采用SAS8.0统计学软件,计量资料采用方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠活动情况 每天观察记录各实验组小鼠的基本状况,与对照组比较,肿瘤模型组及不同剂量组小鼠的活动明显减少,行动迟缓,精神差,被毛疏松,无光泽,呼吸困难,饮食饮水减少。肿瘤内注射32P-GMS后的各组小鼠体质量增加相对缓慢,饮食饮水略有增加,整体情况略有好转。
2.2 抑瘤作用32P-GMS能明显抑制小鼠S180肉瘤的生长,高剂量实验组抑瘤率达32.4%,不同剂量32P-GMS实验组与肿瘤模型组比较差异有统计学意义(P<0.01)。肿瘤模型组瘤块明显增大,界限不清,质地较软,剥离困难,有的肿瘤浸润至胸骨、锁骨及腋窝后侧等处。不同剂量32P-GMS实验组瘤体相对缩小,肿瘤界限清晰,质地较硬,容易剥离,不同剂量32PGMS实验组的平均抑瘤率分别为15.2%、20.4%、32.5%,抑瘤率与剂量呈正相关。不同剂量32P-GMS实验组抑瘤率均高于模型组(P<0.05或P<0.01),结果见表1。
表1 32P-GMS对小鼠S180肉瘤的抑制作用(±s,n=8)
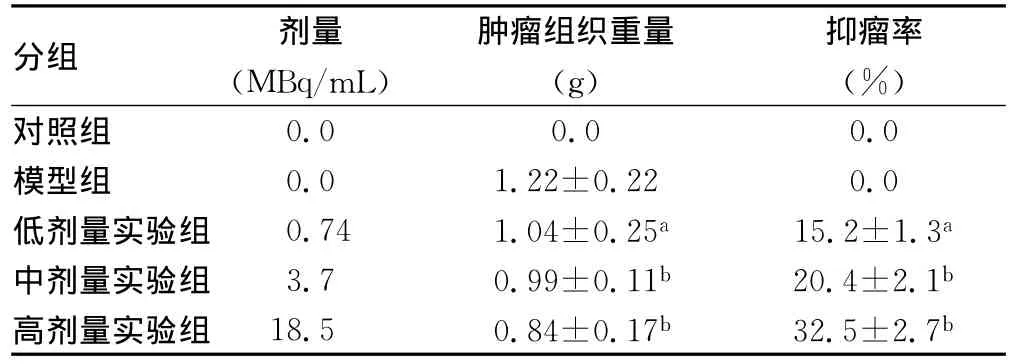
表1 32P-GMS对小鼠S180肉瘤的抑制作用(±s,n=8)
注:与模型组比较,aP<0.05,bP<0.01。
分组 剂量(MBq/mL)肿瘤组织重量(g)抑瘤率(%)对照组0.0 0.0 0.0模型组 0.0 1.22±0.22 0.0低剂量实验组 0.74 1.04±0.25a 15.2±1.3a中剂量实验组 3.7 0.99±0.11b 20.4±2.1b高剂量实验组 18.5 0.84±0.17b 32.5±2.7b
2.3 治疗前后小鼠体质量变化 体质量变化反映了小鼠整体功能状态。由表2可以看出,32P-GMS作用后所有小鼠体质量均有不同程度的增加。对照组小鼠体质量增加明显,模型组小鼠体质量增加缓慢,模型组及不同剂量32P-GMS实验组小鼠体质量明显低于对照组(P<0.01),低、中、高剂量组小鼠体质量明显高于模型组(P<0.01)。
表2 32P-GMS对S180肉瘤小鼠体质量的影响(±s,n=8)
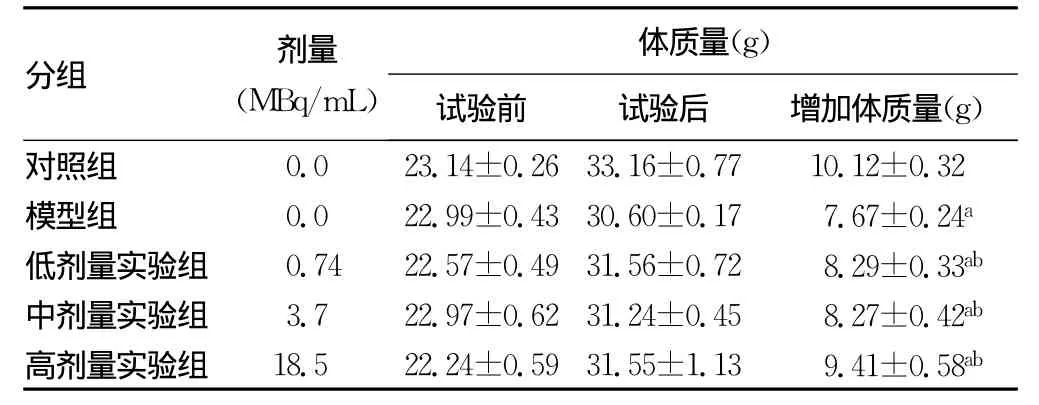
表2 32P-GMS对S180肉瘤小鼠体质量的影响(±s,n=8)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.01。
分组 剂量(MBq/mL)体质量(g)试验前 试验后 增加体质量(g)对照组0.0 23.14±0.26 33.16±0.77 10.12±0.32模型组 0.0 22.99±0.43 30.60±0.17 7.67±0.24a低剂量实验组 0.74 22.57±0.49 31.56±0.72 8.29±0.33ab中剂量实验组 3.7 22.97±0.62 31.24±0.45 8.27±0.42ab高剂量实验组 18.5 22.24±0.59 31.55±1.13 9.41±0.58ab
表3 32P-GMS治疗对肿瘤小鼠白细胞的影响(±s,n=8)
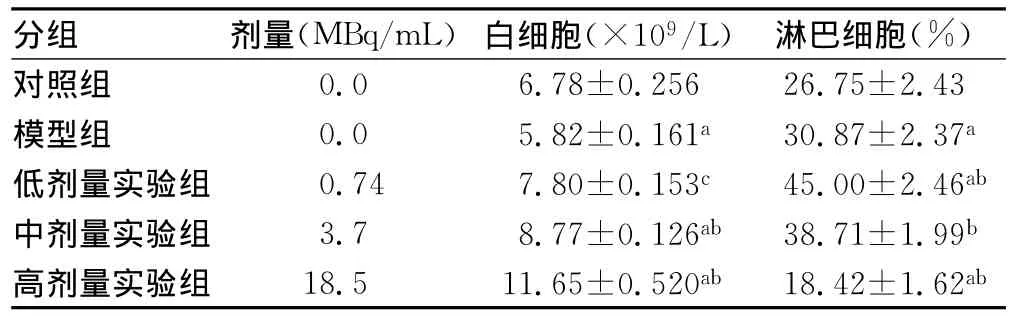
表3 32P-GMS治疗对肿瘤小鼠白细胞的影响(±s,n=8)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.01。
分组 剂量(MBq/mL)白细胞(×109/L)淋巴细胞(%)对照组0.0 6.78±0.256 26.75±2.43模型组 0.0 5.82±0.161a 30.87±2.37a低剂量实验组 0.74 7.80±0.153c 45.00±2.46ab中剂量实验组 3.7 8.77±0.126ab 38.71±1.99b高剂量实验组 18.5 11.65±0.520ab 18.42±1.62ab
2.432P-GMS对肿瘤小鼠外周血白细胞的影响 白细胞水平能及时地反映机体对辐射的早期应急反应。由表3可见,随注射剂量的增加,白细胞呈明显的上升趋势。模型组及中、高剂量组小鼠白细胞数明显高于对照组(P<0.01或P<0.05),不同剂量组小鼠白细胞数明显高于模型组(P<0.01或P<0.05);32P-GMS照射后,模型组及低、中剂量组淋巴细胞百分率明显高于对照组,高剂量试验组肿瘤小鼠淋巴细胞百分率明显低于对照组和模型组(P<0.01);低剂量组肿瘤小鼠淋巴细胞百分率明显高于模型组(P<0.01)。
3 讨 论
放射性核素内照射是肿瘤放射治疗的一种重要途径,尤其对手术不能切除的恶性肿瘤,放射性核素内照射治疗临床效果非常明显,正在成为肿瘤治疗的另一重要发展方向。Nakhgevany等[1]报道总结了肿瘤内照射治疗药物应具备的特点:(1)β射线,能量高,纯度高,不含γ射线;(2)药物局部点状分布,不被正常组织吸收,放射活性局限在肿瘤局部,无其他不良反应;(3)半衰期适合,能量多能在短期内释放,小剂量可将各类肿瘤细胞杀死,且易于辐射防护。32P-GMS具备以上特点,所以是一种理想的肿瘤内照射放射性核素材料。32P-GMS具有内照射和栓塞双重功能,在肝癌、胰腺癌、脑胶质瘤的动物实验和临床应用中均有报道[2-5],应用32P-GMS治疗后,均发现其能使肿瘤体积缩小,且无其他不良反应。本次实验结果显示各剂量组小鼠瘤内注射32P-GMS治疗7d后,瘤体明显缩小,抑瘤率与照射剂量呈正效应机制,且肿瘤向周围组织浸融明显减少,说明32P-GMS有很强的抗肿瘤作用。射线抗肿瘤的机制主要包括直接导致肿瘤细胞生物大分子成分破坏;其次是产生高毒高氧化的各种自由基和过氧化物,这些物质可导致肿瘤细胞死亡[6];第三是受照射细胞释放的一些活性物质或信号分子诱导未受照射细胞凋亡[7],或通过细胞间通讯连接介导这一过程[8]。国内实验结果提示,内照射可促进或加速肿瘤细胞凋亡,且随着剂量的增加,凋亡指数增高[9],本次研究结果与此一致。
32P的有效射程可以达到正常组织,对正常组织能够产生辐射效应,最为直接的是对血细胞的影响。从实验结果来看,白细胞计数明显上升,是急性辐射损伤的特征;淋巴细胞分类百分率也有明显的变化,32P-GMS低剂量组有淋巴细胞增加的趋势,类似于低辐射免疫功能增强的理论;而高剂量组则有明显的淋巴细胞百分率下降,可能是低剂量照射出现即时增殖反应,高剂量辐射产生了辐射免疫功能抑制。是否在一定低剂量范围内或短时间的辐射能够增强免疫功能,有待进一步研究。在本实验的低剂量和高剂量32P-GMS组之间有淋巴细胞的辐射损伤最大临界值,超过此值淋巴细胞发生增殖抑制。外周血淋巴细胞主要为T淋巴细胞,其功能减弱将导致白细胞介素-2、干扰素-γ等细胞因子生成降低,自然杀伤细胞、细胞毒T淋巴细胞、肿瘤浸润淋巴细胞的杀伤能力下降,最终导致机体抗瘤功能下降。其机制是肿瘤细胞受到电离辐射后,FasL表达增强,激活的细胞毒T淋巴细胞也表达FasL,可通过Fas分子启动致死性信号转导,使表达Fas的细胞凋亡[10]。
放射治疗是一个较为庞大的系统工程,涉及患者、设备、射线特征及与机体相互作用产生的生物效应,而这种生物效应的管理很重要[11]。放射性核素内照射治疗在保证对实体瘤治疗有效的前提下,更重要的是保证治疗对象产生正向的生物效应,避免负向生物效应的危害,及内照射核素不泄漏到机体其他部位,避免对机体产生辐射损伤或影响机体免疫系统的功能;其次,玻璃微球不能代谢,当肿瘤组织经治疗痊愈后,残留的玻璃微球仍具有放射性,对周围正常组织仍有辐照损伤,且已成为机体的异物,对机体的正常生理功能必将产生影响。可见,肿瘤内照射治疗需要利用其局部照射的作用,与此同时,开发一种经过一段时间后可以被组织吸收代谢的生物材料作为载体将成为新的研究方向。
[1]Nakhgevany KB,Mobini J,Bassett JG,et al.Nonabsorbable radioactive material in the treatment of carcinomas by local injections[J].Cancer,1988,61(5):931-940.
[2]Zhang DS,Liu L,Jin LQ,et al.Effect of phosphorus-32 glass microspheres on human hepatocellular carcinoma in nude mice[J].World J Gastroenterol,2004,10(11):1551-1554.
[3]Wu WG,Zhang CQ,Yuan SZ,et al.Experimental study of intra-tumor injection of radionuclide32P to treat pancreatic carcinoma[J].Chin J Pract Surg,2000,20(6):356-358.
[4]Jiang Z,Liu L,Fang W,et al.Hepatoartery radioembolism chemotherapy in treatment of hepatic carcinoma[J].Pract J Cancer,2001,16(6):634-636.
[5]Zhang XR,Zheng L,Chen DF,et al.Efficacy of selective internal radioembolization with phosphorus-32glass microspheres combining with hepatic arterial em bolization on advanced liver Cancer[J].Chinese J Hepatology,2003,11(6):337.
[6]Homas T,Thomast J.Polyamines in cell growth and cell death:molecular mechanisms and therapeutic applications[J].Cell Mol Life Sci,2001,58(2):244-258.
[7]Lyer R,Lehnert BE.Factors underlying the cell growth related bystander responses to alpha particles[J].Cancer Res,2000,60(5):1290-1298.
[8]Eymour C,Mothersl LC.Cell communication and the bystander effect[J].Radiat Res,1999,151(4):505-506.
[9]王永跃,王大章,郑光勇.(32)磷玻璃微球组织内照射对肿瘤细胞凋亡影响的实验研究[J].华西口腔医学杂志,2001,9(2):116-117.
[10]Lee JU,Hosotani R,Wada M,et al.Role of Bcl-2family proteins(Bax,Bcl-2and Bcl-X)on cellular susceptibility to radiation in pancreatic Cancer cells[J].Eur J Cancer,1999,35(9):1374-1380.
[11]蔡长青,廖万清,刘文哲,等.放射治疗质量保证的管理[J].现代医院,2006,6(12):111-112.
