不同冻存液冻存慢病毒转染后稳转肝癌细胞株HepG2的效果比较*
2013-08-14陆会平冯振博莫伟嘉
李 佳,陆会平,冯振博,莫伟嘉
(广西医科大学第一附属医院病理科,南宁 530021)
在细胞培养过程中,经常需要冻存一部分细胞,避免培养细胞表型的改变而导致重复实验条件不一的状况,并为进一步的实验保存状态良好的细胞。细胞一般采用液氮低温保存,冻存及复苏时必须遵循“慢冻快融”的原则。本课题组在冻存慢病毒转染肝癌细胞株HepG2细胞时,尝试了多种不同配方的细胞冻存液,最后筛选出一种理想的可用于液氮保存慢病毒转染后HepG2细胞的冻存液。
1 材料与方法
1.1 材料与仪器 细胞株HepG2细胞及其慢病毒转染后稳转细胞株为本实验室保存。完全DMEM培养基由南京凯基生物科技发展有限公司提供,胎牛血清(FBS)由杭州四季青提供,胰酶由碧云天生物技术研究所提供,甘油和二甲基亚砜(DMSO)由北京索莱宝科技有限公司提供。-20℃冰箱由海尔电器公司提供,-80℃超低温冰箱由日本三洋公司提供,普通高速离心机由德国Eppendorf公司提供,酶标仪 Model-450由美国Bio-Rad公司提供,液氮罐为本实验室保存。
1.2 方法
1.2.1 冻存方法 常规胰酶消化细胞,用完全培养基终止消化,轻轻吹打细胞成单细胞悬液,1000r/min离心1min后弃去上清液,分组加入以下冻存液:分别采用甘油和DMSO为保护剂,按以下配方各配备4种比例冻存液。(1)A液,DMEM∶FBS∶保护剂=7∶2∶1;(2)B液,DMEM∶FBS∶保护剂=6∶3∶1;(3)C液,DMEM∶FBS∶保护剂=5∶4∶1;(4)D液,DMEM∶FBS∶保护剂=0∶9∶1。然后轻轻混匀,冻存前统一调整细胞密度到1×106个/毫升,将细胞悬液移至冻存管,每管1.5mL,梯度降温冻存,将冻存管置于4℃冰箱30min,-20℃60~120min后转移至-80℃过夜(16h),转至液氮保存。
1.2.2 细胞的复苏 从液氮中取出冻存管,迅速置于40℃水浴箱中快速摇动,使其迅速融化后,将细胞悬液加入已放置4 mL含10%FBS的完全DMEM培养基的培养瓶中,轻轻混匀后置于37℃,5%CO2培养箱培养。
1.2.3 倒置相差显微镜下观察 复苏细胞6~8h后换液,在倒置相差显微镜下观察复苏后细胞的存活情况,按已贴壁细胞即为存活细胞,未贴壁细胞为死亡细胞的原则,观察复苏后细胞的存活率。
1.2.4 MTT法 将各组细胞接种于96孔板,2×103个/孔,每组细胞均做5个复孔,分别于种板后24、48、72、96h加入20μL MTT溶液,继续培养4h后,小心吸尽培养液,每孔加入150μL DMSO,振荡10min后上酶标仪检测490nm处吸光度值,绘制生长曲线。
1.3 统计学处理 采用SPSS13.0统计软件进行统计学分析,计量资料用表示,组间比较用单因素方差分析,组间两两比较用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 倒置相差显微镜下观察的细胞存活率 采用甘油作为冻存保护剂时,转染的细胞存活,且冻存液比例为0∶9∶1(DMEM∶FBS∶甘油)时,细胞存活率明显高于其他3组,差异有统计学意义(F=14.811,P=0.001);未转染细胞的存活率均达到60%及以上,不同比例的冻存液组间差异无统计学意义(F=1.473,P=0.293)。采用DMSO作为冻存保护剂时,转染组细胞存活率为0%,未转染细胞的存活率均达到60%及以上,不同比例的冻存液组间差异无统计学意义(F=0.890,P=0.487)。见表1。
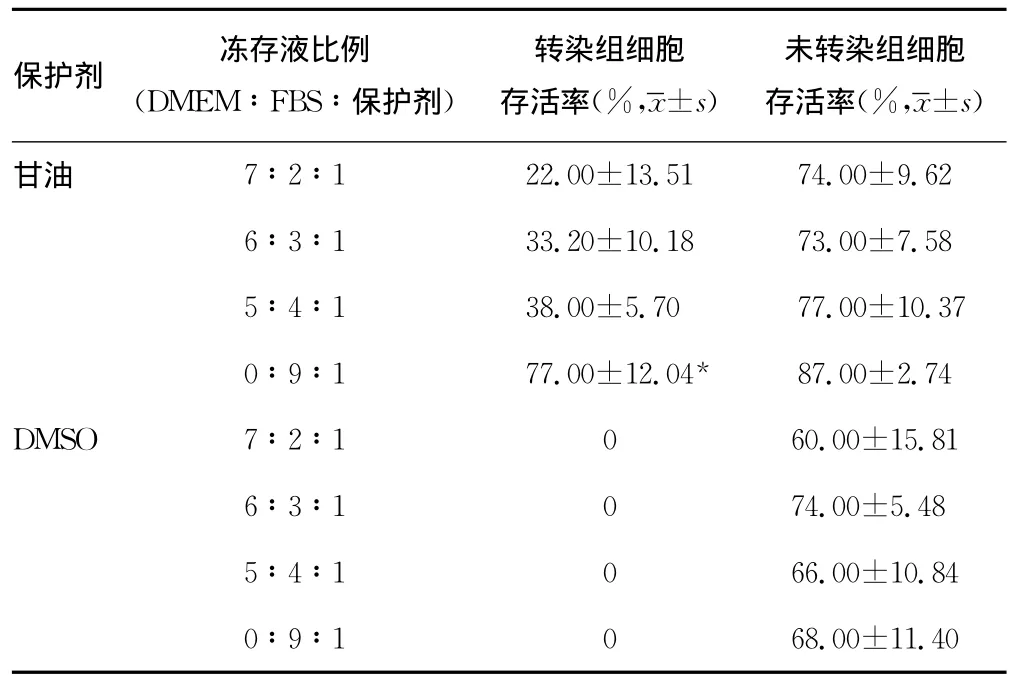
表1 倒置相差显微镜下观察的细胞复苏后的存活率
2.2 MTT法检测冻存细胞复苏后的生长情况 两组细胞在不同比例冻存液冻存复苏后的生长情况见图1。图中结果显示转染后细胞以甘油作为冻存保护剂细胞存活(图1A),且冻存液中血清含量越高,复苏后细胞的增殖能力越强(P<0.05);而用DMSO作为冻存保护剂冻存的转染细胞复苏后成活率几近于0%(图1B)。无论是以DMSO还是以甘油作为冻存保护剂,HepG2细胞复苏后都能存活,且复苏后均具有较好的增殖能力(图1C,图1D)。
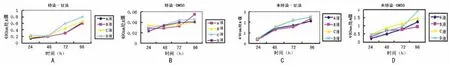
图1 各组细胞复苏后生长曲线图
3 讨 论
目前认为细胞处在对数生长期时最适合冻存,而细胞冻存需要遵循“慢冻”的原则[1]。除此之外,冻存液的成分及其比例对细胞冻存、复苏效果也起着很重要的作用,其中冻存保护剂和血清是在细胞冻存过程中最为重要的两个因素。
Wastts等[2]认为冻存细胞时一定要加入保护剂。如果直接冻存,细胞内形成的冰晶会导致胞内蛋白质、酶变性,溶酶体膜损伤,细胞核内DNA受损[3],从而引起细胞死亡。因此,减少细胞内冰晶的形成是减少细胞损伤的关键[4]。冻存保护剂除了可以减少降温过程中胞内外冰晶的形成,还可降低“溶质效应”。目前最常用的冻存保护剂有DMSO、甘油、聚乙烯吡咯烷酮(PVP)等。其中,DMSO相对分子质量小、渗透性强,通过降低冻存液冰点和细胞内外的电解质浓度,改变细胞膜的通透性,保护细胞免受冷冻损伤[5-6]。Chesne等[7]报道,DMSO与甘油等冻存保护剂相比较,具有更好的保护作用。但DMSO具有一定的细胞毒性[8],高浓度不利于细胞的冷冻保护。Diener等[9]认为10%DMSO 为最佳冻存剂浓度[9]。然而,于丽敏[10]报道,对耐药的肿瘤细胞株进行冻存时,使用10%~15%的甘油(占冻存液百分比)作为保护剂,细胞存活率明显高于用DMSO作为保护剂的,此结果与本实验结果相同。是否在肿瘤细胞受到外界损伤后(药物刺激、慢病毒感染等),细胞对DMSO敏感性提高,无法抵御其细胞毒性,进而影响复苏效果,这其中的机制仍有待研究。
FBS中含有丰富的细胞生长所必需的营养物质,是细胞培养中最天然的培养基[11]。若含DMSO的冻存液中血清浓度低则细胞复苏后活力低,原因可能是FBS可以中和DMSO的毒性,以及血清中的纤维粘连素有助于细胞贴壁[12-13]。本实验结果也表明血清浓度对复苏后细胞的活力有一定的影响,冻存液中血清含量越高,复苏后细胞的增殖能力越强。
总而言之,细胞冻存对实验的顺利进展至关重要。由本实验结果可知,冻存慢病毒转染后稳转肝癌细胞株HepG2的最佳冻存液为90%FBS+10%甘油。望本研究结果能给其他课题组的细胞冻存提供一种借鉴的方法。
[1]帅志强,朱海,吕自力,等.几种冻存细胞的方法比较[C].浙江:中国畜牧兽医学会动物繁殖学分会第12届学术研讨会,2004:155.
[2]Watts P,Grant MH.Cryopreservation of rat hepatocyte monolayer cultures[J].Hum Exp Toxicol,1996,15(1):30-37.
[3]Novicki DL,Irons GP,Strom SC,et al.Cryopreservation of isolated rat hepatocytes[J].In Vitro,1982,18(4):393-399.
[4]杨景山.医学细胞化学与细胞生物技术[M].北京:北京医科大学中国协和医科大学联合出版社,1990:430-441.
[5]Lucci CM,Kacinskis MA,Lopes LH,et al.Effect of different cryoprotectants on the structural preservation of follicles in frozen zebu bovine(Bos indicus)ovarian tissue[J].Theriogenology,2004,61(6):1101-1114.
[6]Cuello C,Sanchez-Osorio J,Alminana C,et al.Effect of the cryoprotectant concentration on the in vitro embryo development and cell proliferation of OPS-vitrified porcine blastocysts[J].Cryobiology,2008,56(3):189-194.
[7]ChesnéC,Guillouzo A.Cryopreservation of isolated rat hepatocytes:a critical evaluation of freezing and thawing conditions[J].Cryobiology,1988,25(4):323-330.
[8]Li Y,Lu RH,Luo GF,et al.Effects of different cryoprotectants on the viability and biological characteristics of porcine preadipocyte[J].Cryobiology,2006,53(2):240-247.
[9]Diener B,Oesch F.Cryopreserved and hypothermically stored rat liver parenchymal cells as metabolizing system in the Salmonella mutagenicity assay[J].Mutat Res,1995,335(3):309-316.
[10]于丽敏.二甲基亚砜与甘油两种冻存保护液对细胞保护作用的比较[J].大连医科大学学报,1995,17(1):6-7.
[11]司徒镇强,吴军正.细胞培养[M].4版.西安:世界图书出版公司,2001:44.
[12]鄂征.组织培养和分子细胞学技术[M].北京:北京出版社 ,1994:54-55.
[13]王亨,韩超,邱昌伟,等.体外培养奶牛乳腺上皮细胞的形态学观察[J].中国兽医杂志,2007,43(6):15-17.
