甲醛对小鼠肝脏毒性作用的研究
2013-08-14李亚琳
李亚琳
(渭南师范学院化学与生命科学学院,陕西渭南714000)
液体腹腔染毒方法能准确的掌控化学毒剂的剂量,所以能客观的估计甲醛剂量与肝脏损伤程度的关系。因此,本试验通过小鼠腹腔注射不同浓度的甲醛溶液,观察小鼠行为变化,测定小鼠肝脏的脏器系数及肝细胞的活力,并通过石蜡切片观察小鼠肝细胞的病理性变化,探讨甲醛对小鼠的肝脏组织及细胞的毒性作用,为研究甲醛引起的人类疾病提供一定试验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性昆明鼠,2周龄,体重为20 g±2g,购自第四军医大学实验动物中心。试验期间小鼠自由饮水、进食。
1.1.2 试剂 生理盐水,甲醛溶液,伊红,苏木精,台盼蓝染液,700、800、950mL/L乙醇溶液,无水乙醇,福尔马林溶液,蛋白甘油,盐酸乙醇,二甲苯,石蜡,中性树胶。
1.1.3 仪器 超净工作台,恒温水浴箱,电子天平,解剖工具一套,染缸,切片机,恒温箱,烤片机,光学显微镜,电子显微成像仪。
1.2 方法
1.2.1 分组 试验前观察1周,然后随机将试验小鼠分为对照组和3个染毒组,每组9只,染毒组浓度分别为2mg/kg(低)、20.00mg/kg(中)和200.00 mg/kg(高),同时设置9g/L生理盐水阴性对照组[4]。
1.2.2 染毒方法 在无菌条件下,染毒组注射不同浓度的甲醛溶液,临用时配制。采用腹腔注射的方式,每天上午10:00注射一次,每次注射0.1mL。对照组腹腔注射等体积的生理盐水。持续注射10d~30d,分别在注射后第10、20、30天每组处死3只小鼠,同时观察行为变化。
1.2.3 行为观察 每日观察并记录小鼠的食量、饮水量、外观体征及行为活动等变化。
(4)兼职偏好:学生兼职会优先选择家教类兼职,其次会选择服务类与代理类兼职,这几类兼职一般收入较高,且能发挥自身价值。
1.2.4 肝组织的脏器系数 每只小鼠称重后脱臼处死并迅速取出肝脏,用电子天平准确称量肝脏重量,计算肝脏的脏器系数。脏器系数=肝脏质量(mg)/体重(g)。
1.2.5 小鼠肝细胞离体活力检测 通过台盼蓝染色鉴别死细胞与活细胞。台盼蓝排斥法实验原理:当细胞损伤或死亡时,细胞膜不再具有选择透过性,台盼蓝可以穿过变性的细胞膜,进入细胞内,与细胞中解体的DNA结合,使其着色,细胞变蓝。而活细胞的细胞膜具有通透性,能阻止台盼蓝染料进入细胞内,细胞为无色。
1.2.5.1 小鼠细胞悬液的制备 ①颈椎脱臼法处死小鼠,迅速取出肝脏。
②用冰冷的生理盐水反复冲洗,清洗其表面的血迹,再用擦镜纸包裹肝脏轻微挤压除去肝脏内部的血细胞,以排除计数过程中血细胞的干扰。
③将肝脏置于生理盐水溶液中,用眼科剪将肝脏剪成糜状(约1mm3的组织块),然后加入离心管中。
④将细胞悬液进行离心(800r/min,5min),取上清液用于细胞检测。
1.2.5.2 离体细胞活力检测的试验步骤 用生理盐水调整肝细胞悬液中的细胞密度到5×105个/mL。取适量肝细胞悬液加入等体积4g/L台盼蓝溶液,快速用血球计数板分别计数活细胞和死细胞。并计算细胞存活率:存活率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.6 肝组织的形态及病理学观察
1.2.6.1 肝组织的形态的肉眼观察 将小鼠脱臼处死,打开腹腔,取出肝脏组织,生理盐水反复冲洗后,观察其形态、颜色等变化。
1.2.6.2 小鼠肝脏组织石蜡切片的制作 取新鲜肝脏组织,用生理盐水反复冲洗后,置于福尔马林溶液中固定,过夜,常规脱水石蜡包埋,制作切片,切片厚7μm,苏木精-伊红(HE)染色,光学显微镜下观察组织形态特征的变化。
1.2.7 统计学分析 表中数据代表3次重复试验的平均值(±sD),结果用成组数据平均数比较的t检验分析,有效数据定为P<0.05。
2 结果
2.1 小鼠行为变化
甲醛对小鼠机体的影响是多方面的。本试验发现,甲醛染毒初期,以刺激症状为主,表现为抓鼻,抓耳朵,挠嘴;随染毒时间加长,出现兴奋,躁动不安,站立;再后来表现为群聚,少动。整个染毒期间,高浓度组小鼠与对照组小鼠相比,食量减少,饮水量减少。
2.2 小鼠肝组织的脏器系数
随着染毒剂量的增加以及染毒时间的延长,小鼠肝脏的脏器系数逐渐变小。低浓度组与对照组比较无显著差异,而中、高浓度组与对照组比较差异较显著(P<0.05)(图1A,图1B)。
2.3 小鼠离体肝细胞活力检测
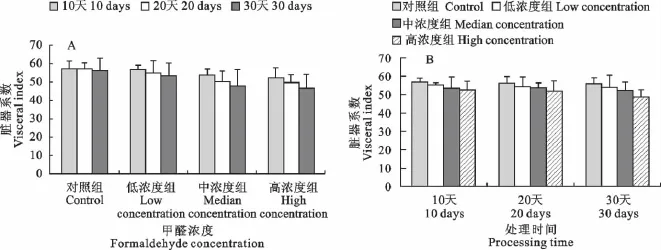
图1 甲醛处理对小鼠肝脏脏器系数的影响Fig.1 Effect of formaldehyde on the visceral index of mice liver
随着染毒剂量的增加以及染毒时间的延长,小鼠离体肝细胞存活率逐渐变小。与对照组相比,低浓度组具有显著差异性(P<0.05),而中、高浓度组差异极显著(P<0.01),30天处理组与10天处理组比较也具有显著性差异(P<0.05)(图2A,图2B)。
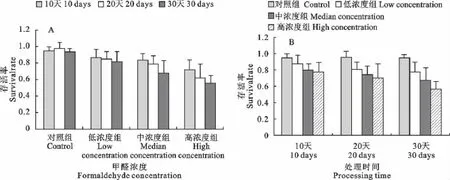
图2 甲醛处理对小鼠离体肝脏细胞存活率的影响Fig.2 Effect of formaldehyde on the survival rate of hepatocytes in vitro
2.4 小鼠肝脏的病理学观察
甲醛染毒后,肉眼观察,小鼠的肝脏表面变得粗糙,颜色变白,并出现黑色的小点或小斑。随着甲醛浓度的增大、染毒时间的延长,病变加重。光学显镜下观察,对照组小鼠肝脏组织细胞形态正常,无任何病理变化,而其他染毒组小鼠肝脏组织均在不同程度上变得松散(图3)。在低浓度组小鼠的肝细胞中,有少数的细胞核裂解,细胞出现微小形变(图3B);中浓度组的小鼠肝脏组织中,可见多数细胞核裂解和形变(图3C);而高浓度组的小鼠肝脏细胞中,绝大多数细胞核裂解,细胞明显形变(图3D)。
3 讨论
3.1 小鼠行为变化
甲醛具有毒性,能对小鼠的行为产生一定的影响,且溶液浓度越高,染毒时间越长,其毒性效应越明显。水迷宫试验和定位航行试验均表明,气态甲醛可影响小鼠的空间学习记忆能力,使其在试验中错误次数增加,且浓度越高染毒时间越长,其错误次数越多[13-14]。本试验也说明高浓度和长时期染毒,小鼠的食量、饮水量相对于对照组明显减少,并且出现懒惰,少动,群聚,粪便不成形,毛发缺少光泽等现象。

图3 不同浓度甲醛染毒处理30d后小鼠肝脏组织的病理改变(400×)Fig.3 Mouse liver pathological changes by different formaldehyde concentration treated for 30days(400×)
3.2 小鼠肝组织的脏器系数
脏器系数可以直观、灵敏、有效的反映动物的营养状态和脏器受损伤的情况,是一种非特异性指标,可综合地反映有毒物对机体和靶器官的毒性效应。脏器系数的变化常可较好地反映化学毒物对该脏器的毒性综合情况,也是寻找毒物作用靶器官的重要线索。在排除体重变化对脏器系数变化影响的情况下,脏器系数的异常,可证明脏器病理组织学改变的可能性[15]。
本试验中,高浓度染毒小组的脏器系数明显低于对照组,其差异具有统计学意义。说明甲醛可能增加了肝脏的代谢负荷,也可能间接导致肝脏器官的损坏,使其代谢能力降低,影响了对附加生理或生化负荷的代偿能力。
本研究证明,随着染毒时间的延长,即使是低浓度的甲醛溶液,也会对小鼠的肝脏产生轻微的毒性作用,引起少数肝细胞形态结构的改变,但不会导致明显的生理病变。在本试验(连续注射30d)结束时,未发现低浓度的甲醛溶液对小鼠的肝脏产生明显的病理作用。低剂量甲醛染毒多长时间会导致小鼠肝脏明显的病理效应,需要进一步验证。
3.3 小鼠离体肝细胞活力检测
细胞活力的检测对于鉴定细胞存活情况、细胞的生理生化活性等具有重要的意义。在本试验中,离体细胞的活力检测不仅可以了解离体肝细胞的存活情况,还可以检测不同浓度的甲醛溶液对小鼠肝组织的损伤以及肝细胞的存活率的影响。与对照组相比,低浓度组的肝细胞存活率无明显变化,而中浓度、高浓度组差异性显著。
3.4 小鼠肝脏的病理学观察
肉眼观察,对照组小鼠肝脏颜色正常,富有光泽,皮下脂肪白而亮,无任何病理性变化。2.00 mg/kg的甲醛溶液对小鼠肝脏的毒性作用不明显,可能是因为肝脏具有解毒作用,而该浓度的甲醛剂量在小鼠肝脏的解毒范围之内,尚未引起显著的毒性效应就被排出体外,故低浓度组与对照组小鼠的肝脏无明显差异。而中浓度组、高浓度组小鼠的肝脏出现了明显的病理变化,肝脏颜色发暗,无光泽,其表面有黑色的小点或小斑。光镜下观察,对照组小鼠肝组织细胞无异常变化。随着甲醛染毒浓度的增高以及时间的延长,肝脏病理损伤程度也随之增加,细胞从开始的水肿、变性到后来的细胞核分裂继而坏死。低浓度组小鼠肝脏损伤较轻,与对照组相比,镜下未见明显异常改变。以前有研究表明,高浓度甲醛染毒导致小鼠肝组织细胞浊肿,汇管区慢性炎细胞浸润,肝细胞胞浆疏松化,少数肝细胞有气球样变性,点灶状坏死,大多数肝细胞核裂解,呈现大量病理性核分裂像,细胞变形显著[16]。本试验中,在光镜下可见中、高浓度组小鼠肝细胞病理性核分裂明显,细胞明显变形,与前人研究结果一致。张武全等认为脂质过氧化物的产生可能是甲醛导致肝脏损伤的机制之一,甲醛可能通过脂质过氧化而引起细胞膜和其他膜结构的破坏,导致膜受体、膜免疫功能失常,最终导致肝脏损伤[17]。
综上所述,随着甲醛染毒时间的延长和染毒剂量的增加,其对小鼠肝脏组织的损伤越严重,小鼠肝脏的脏器系数越低,肝细胞离体存活率也降低,肝脏组织病理性变化越明显。本试验为进一步研究甲醛对人体组织的病理性伤害提供了一定的试验基础。
[1] 赵 晖,王 地,于 萍,等.建筑环境中甲醛毒性的早期生物效应[J].建筑科学,2011(11):67-70.
[2] 张晓勇,黄 卫,司 蔚,等.室内空气污染现状及控制研究[J].环境科学与管理,2006(6):48-50.
[3] WHO.International Agency for Research on Cancer,classifies formaldehyde as carcinogenic to humans[R].Press Release№153,2004,June 15.
[4] Duong A,Steinmaus C,McHale C M,et al.Reproductive and developmental toxicity of formaldehyde:a systematic review[J].Mutat Res,2011,728(3):118-138.
[5] Wang H X,Zhou D X,Zheng L R,et al.Effects of paternal occupation exposure to formaldehyde on reproductive outcomes[J].J Occup Environ Med,2012,54(5):518-524.
[6] 薛来俊,晓开提·依不拉音,张彦红.甲醛染毒小鼠肝脏、肾脏、脾脏的病理变化[J].中国职业医学,2007,34(3):197-198.
[7] 童志前,韩婵帅,苗君叶,等.内源性甲醛异常蓄积与记忆衰退[J].生物化学与生物物理进展,2011(6):95-99.
[8] 程文文,李 兰,胡传禄,等.气态甲醛致小鼠骨髓细胞DNA-蛋白质交联的研究[J].生态毒理学报,2010(2):112-117.
[9] 吴成秋.居室空气甲醛与苯污染的生殖和胚胎发育毒性及其作用机制研究[D].湖南长沙,中南大学,2010.
[10] 武 阳.甲醛遗传毒性与氧化损伤研究[D].湖北武汉:华中师范大学,2010.
[11] Paget-Bailly S,Cyr D,Luce D.Occupational exposures and cancer of the larynx-systematic review and meta-analysis[J].J Occup Environ Med,2012,54(1):71-84.
[12] National Toxicology Program.Final report on carcinogens background document for formaldehyde[R].Rep Carcinog Backgr Doc,2010,(10-5981):1-512.
[13] Malek F A,Mvritz K U,Fanghdel J.A study on the effect of exhalative formaldehyde exposure on water labyrinth test performance in rates[J].Anatomischer Anzeiger,2003,185:227-285.
[14] 杨在明,袭著革,杨丹凤,等.气态甲醛吸入染毒对小鼠水迷宫学习成绩及海马神经递质的影响[J].环境与健康杂志,2006,23(5):402-404.
[15] 黄雅卿,张文昌,李煌元.氟对雌性大鼠体重变化和卵巢脏器系数的影响[J].职业与健康,2003,19(7):7-9.
[16] 万 勇.甲醛与苯对雌性小鼠造血系统的遗传毒性及肝脏毒性的研究[D].新疆乌鲁木齐:新疆医科大学,2009.
[17] 张武全,孙少华,杨 迪.慢性吸入甲醛对小鼠肝脏的氧化性损伤[J].环境与职业医学,2005,22(5):429.
