动物内源性多肽CGA-N46生物信息学分析
2013-08-14李瑞芳卢研博陈士华张慧茹熊前程
李瑞芳,卢研博,陈士华,张慧茹,王 彬,熊前程
(河南工业大学生物工程学院,河南郑州450001)
抗菌肽(antimicrobial peptides)又称抗微生物肽或肽抗生素,是动物界和植物界的先天免疫系统的主要效应分子,原指昆虫体内经过诱导产生的分子量在4ku左右、具有抑菌性质的碱性多肽物质。从目前的研究来看,抗菌肽广泛存在于多种生物体内,具有广谱抗菌、抗肿瘤、抗病毒活性,构成机体的“第二防御体系”。因此,抗菌肽是存在于动植物、昆虫、微生物等生物体内,具有抗菌活性的肽类物质。研究发现,抗菌肽水溶性好、分子质量小、呈强碱性、热稳定性高、无免疫原性,有着与传统抗生素完全不一样的产生途径和作用机制,病原菌不易对其产生耐药性[1]。一般情况下,抗菌肽只作用于原核细胞和发生病变的真核细胞,而对常态的真核细胞几乎没有作用[2]。因此,抗菌肽有望被研发成替代抗生素的药物,亦有可能成为无毒或低毒的抗肿瘤新药[3]。肽类抗生素为新型药物的设计提供了一个很有代表性的范例[4]。
嗜铬粒蛋白(chromogranin A,CGA)是存在于动物神经和内分泌细胞的由439个氨基酸组成的可溶性蛋白[5]。CGA N端衍生多肽对真菌和细菌表现出不同的抑制作用,其中CGA N端31位~76位氨基酸肽段(CGA-N46)具有较强抗真菌的功能[6]。为揭示CGA-N46的抗真菌作用、副作用及选择性毒力的基本原理,本实验室正在对CGA-N46抗真菌作用机制进行研究。利用生物信息学软件,对CGA-N46的理化性质、结构特征等进行分析,通过与已有抗菌肽进行比对,推测CGA-N46的作用机制。
1 材料与方法
1.1 材料
1.1.1 CGA-N46氨基酸序列 NH2-PMPVSQE CFETLRGHERILSILRHQNLLKE LQ-DL ALQGAKERAHQQ-COOH。
1.1.2 软件和工具 ProtParam、TMpred和WoLF PSORT 工具,GOR4、SIMPA96、Signal3.0 Server、NetPhos 2.0Server和NetOGlyc 3.1Server软件,SWISS-Model程序。
1.2 方法
1.2.1 CGA-N46理化性质分析 利用http://www.expasy.ch/tools/网站ExPASy分析系统中的ProtParam工具分析CGA-N46氨基酸序列,对其氨基酸组成、电荷分布、电荷聚集区域、等电点、稳定性、亲水性和半衰期等理化参数进行分析。
1.2.2 CGA-N46二级结构预测 利用http://pbil.ibcp.fr/网站的secondary structure prediction软件中的GOR4、SIMPA96方法综合观测CGAN46的二级结构。
1.2.3 CGA-N46跨膜区和信号肽分析 参照文献[7],利用 http://www.ch.embnet.org/software/TMPRED_form.html网站SWISS-PROT的跨膜蛋白数据库Tmbase的分析工具TMpred和http://www.cbs.dtu.dk/services/SignalP/网站Signal3.0 Server软件分析CGA-N46氨基酸序列,预测其跨膜区段和取向。
1.2.4 CGA-N46进入细胞后的细胞内定位 参照文献[8],利用网站http://psort.hgc.jp/form2.html的WoLF PSORT工具基于其氨基酸序列预测蛋白质亚细胞定位点。
1.2.5 CGA-N46糖基化和磷酸化位点分析 利用http://www.cbs.dtu.dk/services/NetOGlyc/网站的NetOGlyc 3.1Server软件和http://www.cbs.dtu.dk/services/NetPhos/网 站 的 NetPhos 2.0 Server软件分析CGA-N46的糖基化和磷酸化位点。
1.2.6 CGA-N46三维空间结构分析 利用http://swissmodel.expasy.org/repositoru/网 站 的SWISS-Model程序预测CGA-N46的三级结构。
2 结果
2.1 CGA-N46的理化性质
CGA-N46共有46个氨基酸,其氨基酸组成见表1。由软件分析可知,CGA-N46内部没有二硫键,带负电荷氨基酸(Asp+Glu)总数为6个,带正电荷氨基酸(Arg+Lys)总数为6个,总体电荷分布情况为:000000-00-00+00-+00000+00000+-00-000000+-+0000。该蛋白质等电点为7.38,分子质量为5 363.1u(5.363ku)。

表1 CGA-N46氨基酸组成Table 1 Amino acid composition of CGA-N46
分析CGA-N46的稳定性,发现该蛋白质不稳定指数为75.91,为不稳定蛋白。蛋白质疏水性的预测在蛋白质组学研究中不可缺少,一般根据该蛋白质的GRAVY值来预测。GRAVY值的范围在2与-2之间,负数表示该蛋白质为亲水蛋白,正数表示该蛋白质为疏水蛋白。CGA-N46总平均亲水性为-0.674,因而为亲水蛋白。软件分析得知,CGAN46在哺乳动物、酵母中的半衰期都大于20h。
2.2 CGA-N46的二级结构预测
利用 GOR4、SIMPA96方法综合观测CGAN46的二级结构,分析可知,在CGA-N46的二级结构中,α螺旋占总体二级结构的80.43%,无规则卷曲占总体二级结构的19.57%,因此,CGA-N46总体呈现α螺旋形式。其二级结构预测如图1所示。
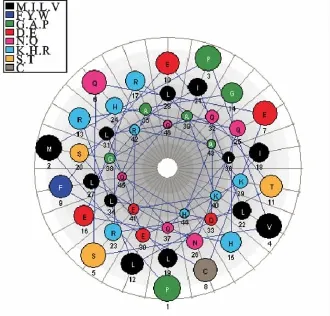
图1 CGA-N46二级结构预测Fig.1 Secondary structure prediction of CGA-N46
2.3 CGA-N46的跨膜区和信号肽预测
利用SWISS-PROT的跨膜蛋白数据库Tmbase的分析工具TM pred分析CGA-N46氨基酸序列,预测CGA-N46的跨膜结构。预测结果表明,CGAN46没有跨膜的可能性,即没有跨膜区。利用SignalP-NN软件预测CGA-N46的信号肽序列,分析显示该蛋白质没有信号肽。跨膜区和信号肽预测结果表明,CGA-N46是位于细胞质中的胞浆蛋白。
2.4 CGA-N46在细胞内的定位
预测结果再现了该蛋白的信号肽序列、核定位信号、跨膜区定位、信号序列识别、线粒体定位信号、膜拓扑结构等信息,结果表明CGA-N46进入细胞之后主要分布于细胞核(52.2%),其他的依次为细胞 质 (26.1%)、细 胞 骨 架 (17.4%)和 线 粒 体(4.3%)。
2.5 CGA-N46糖基化位点和磷酸化位点预测
蛋白质糖基化(O-Glycosylated)对蛋白质功能具有重要影响,如许多重要的细胞表面蛋白、识别蛋白和分泌蛋白都带有一个或数个糖基。利用NetO-Glyc 3.1Server软件分析CGA-N46糖基化位点。预测结果表明,CGA-N46没有糖基化位点。
磷酸化(phosphorylation)是蛋白质翻译后广泛存在的一种化学修饰,是调节酶或蛋白质活性的重要步骤。利用 http://www.cbs.dtu.dk/services/NetPhos/网站的 NetPhos 2.0Server软件分析CGA-N46磷酸化位点,结果如表2所示。预测结果表明,CGA-N46有2个磷酸化位点,分别位于第5位丝氨酸和第11位的苏氨酸。

表2 CGA-N46磷酸化位点预测Table 2 Phosphorylation site prediction of CGA-N46
2.6 CGA-N46三维空间结构
利用SWISS-Model程序预测CGA-N46的三级结构,结果在PDB数据库中没有找到有效的模板,表明对该类蛋白质空间结构的研究不多。
3 讨论
研究发现,动物抗菌肽多为带阳离子电荷两亲α-螺旋构型的多肽,其电荷特性便于其与负电荷的细胞膜表面相互作用,通过毯式模型或孔洞模型杀死真菌[9]。通过生物信息学分析发现,CGA-N46虽然属于α螺旋构型的多肽,但与常见抗菌肽不同,CGA-N46呈电中性,等电点7.38,不能采用等电点为4.62的cathelicidins家族蛋白的作用机制[10],从带负电的脂多糖位置处转移阴离子,使细胞壁发生紊乱,或与细胞壁表面带负电荷的磷壁酸通过静电引力结合,使抗菌肽穿过细胞壁靠近细胞质膜,对细胞质膜起作用。也不能通过静电引力结合在带负电荷的磷脂双分子膜上,形成栅栏模型、毯式模型或胶束状结构,破坏细胞膜或细胞器生物膜达到抗菌的目的[11]。CGA-N46甘氨酸、脯氨酸含量低,也不会像脯氨酸含量高达33%的抗菌肽apidaecin与一种或几种和蛋白合成相关的成分结合并发挥作用,起到杀菌效果[12]。
CGA-N46为亲水性、α螺旋,含有一个半胱氨酸,可能会通过形成分子间二硫键,如抗菌肽β-defensin-3[13],通过抑制细菌或真菌细胞壁的形成,使细菌或真菌不能维持正常的细胞形态而使其生长受阻,并导致细胞壁穿孔,最终杀死细菌或真菌。CGA-N46没有跨膜区,为胞浆蛋白。因此,CGAN46可能在细胞内存在靶位点,作用于细胞内某些生物分子,通过影响其结构与功能而起到杀菌作用。
近几十年来,真菌感染现象已是非常普遍,免疫缺陷病人更甚,其感染真菌的病死率逐年上升。而当前,耐药性是真菌感染性疾病治疗面临的一个重要问题,即多数患者对常规的抗生素产生了耐药性[14]。因此,寻找效性好、风险性低的新型抗生素刻不容缓。抗菌肽采用不同的机制杀死真菌而不引起菌体产生耐药性,被认为是传统抗生素的最优替代品[15]。CGA-N46是一种新型抗菌肽,其抗真菌作用机制也许不止上述预测的几个方面。因此,阐明CGA-N46的作用机制还需要通过同位素标记、基因缺失等实验手段,并结合先进的生物物理仪器进行分析研究。同时,CGA-N46的其他生物学活性还有待进一步深入研究。
[1] 魏照征,田 健,伍宁丰,等.抗菌肽构效关系及其表达策略研究进展[J].生物技术通报,2011(2):7-11.
[2] 祝 骥,高 飞,易 喻,等.抗菌肽的研究进展[J].生命科学,2008,20(4):605-607.
[3] 孟 硕,王凤山.抗肿瘤活性抗菌肽的研究进展[J].中国生化药物杂志,2011,32(3):241-244.
[4] Fedders H,Podschun R,Leippe M.The antimicrobial peptide Ci-MAM-A24is highly active against multidrug-resistant and anaerobic bacteria pathogenic for humans[J].Int J Antimicrob Ag,2010,36(8):264-266.
[5] 李瑞芳,熊前程.嗜铬颗粒蛋白A研究进展[J].生命科学研究,2010,14(4):350-354.
[6] 李瑞芳,张添元,罗进贤,等.嗜铬粒蛋白N区抗真菌活性片段研究[J].中山大学学报,2006,45(2):64-67.
[7] 陈士华,吴兴泉,曹 健.罗伊氏乳杆菌亚油酸异构酶的生物信息学分析[J].河南工业大学学报:自然科学版,2011,32(2):45-48.
[8] 冯媛媛,侯 佩,李颖楠,等.番茄ARF2蛋白的生物信息学分析与亚细胞定位[J].生物化学与生物物理进展,2012,39(1):51-58.
[9] Wang Y,Jiang Y,Gong T,et al.High-level expression and novel antifungal activity of mouse Beta defensin-1mature peptide inEscherichiacoli[J].Appl Biochem Biotech,2010,160(1):213-221.
[10] Kosciuczuk E M,Lisowski P,Jarczak J,et al.Cathelicidins:family of antimicrobial peptides[J].Mol Biol Rep,2012,39:10957-10970.
[11] Amiche M,Galanth C.Dermaseptins as models for the elucidation of membrane-acting helical amphipathic antimicrobial peptides[J].Curr Pharm Biotechnol,2011,12:1184-1193.
[12] Bolintineanu D,Hazrati E,Davis H T,et al.Antimicrobial mechanism of pore-forming protegrin peptides:100pores to killE.coli[J].Peptides,2010,31(1):1-8.
[13] Harder J,Bartels J,Christophers E,et al.Isolation and characterization of humanβ-defensin-3,a novel human inducible peptide antibiotic[J].J Biol Chem,2001,276(8):5707-5713.
[14] Asoodeh A,Azam A G,Chamani J K.Identification and characterization of novel antibacterial peptides from skin se-cretions of euphlyctis cyanophlyctis[J].Int J Pept Res T-her,2012,18:107-115.
[15] Chapuis H,Slaninova J,Bednarova L,et al.Effect of hydrocarbon stapling on the properties of a-helical antimicrobial peptides isolated from the venom of hymenoptera[J].Amino Acids,2012,43:2047-2058.
