皮毛中5种病毒基因芯片检测方法的研究
2013-08-14李苗云冯松凯
徐 超,李苗云,冯松凯
(1.河南出入境检验检疫局,河南郑州450003;2.河南农业大学食品科学技术学院,河南郑州450002)
在牛、羊等动物皮毛中可以携带蓝舌病病毒(Bluetongue virus,BTV)、口蹄疫病毒(Foot and mouth disease virus,FMDV)、山羊痘病毒(Goatpox virus,GPV)、绵羊痘病毒(Sheeppox virus,SPPV)、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)等5种病毒。这几种病毒通过皮毛传播的风险较高,动物感染后,病死率高,并将迅速形成暴发和流行趋势,对家畜和皮毛相关从业人员健康造成重大危害。目前,我国已经成为世界上最大的皮毛进口国,进口皮张来源广泛,进出口批次量大频繁,急需一种能对皮毛携带病毒高通量、快速筛查的方法。但迄今为止,国内外只有少量对皮毛携带一种或两种病毒检测方法的研究,检测方法主要依靠经典的血清学方法和PCR技术[1-4],已经无法适应对进口皮毛进行快速、大批量筛查检测的要求。为此,本研究采用基因芯片技术,根据BTV、FMDV、GPV、SPPV和BVDV等5种病毒的特异性序列设计多条引物和探针,研究同时检测5种病毒的基因芯片检测方法。
1 材料与方法
1.1 材料
1.1.1 毒株 牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV),绵羊痘病毒(Sheeppox virus,SPPV),山羊痘病毒(Goatpox virus,GPV)HN-1株,伪狂犬病病毒(Pseudorabies virus,PRV)HN-3株,猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)HN-2株,禽流感病毒(Avian influenza virus,AIV)HN-1株,新城疫病毒(Newcastle disease virus,NDV)HN-5,蓝舌病病毒(Bluetongue virus,BTV)和O型口蹄疫病毒(Foot and mouth disease virus serotype O,FMDV/O),均由河南出入境检验检疫局技术中心微生物实验室保存。
1.1.2 主要试剂 MasterMix Taq酶、TIANscript M-MLV逆转录酶,100bp DNA Marker,TIANprep Mini普通质粒小提试剂盒,TIANgel Midi普通琼脂糖凝胶DNA回收试剂盒,购自天根生化科技(北京)有限公司;DNA Maker DL 1 500和DL 600,购自北京索莱宝科技有限公司;MiniBEST病毒核酸提取试剂盒,pMDTM18-T Vector试剂盒,X-Gal,IPTG,EcoRⅠ酶和HindⅢ酶,购自宝生物工程(大连)有限公司;蓝舌病病毒(BTV),口蹄疫病毒(FMDV),山羊痘病毒(GPV),绵羊痘病毒(SPPV),牛病毒性腹泻病毒(BVDV)核酸检测试剂盒购自广州维伯鑫生物科技有限公司;晶芯○R基因芯片点样液、光学级氨基基片,购自博奥(北京)生物有限公司。
1.1.3 仪器 SmartArrayerTM48芯片点样仪,BioMixerTMⅡ芯片杂交仪,晶芯SlideWasher芯片洗干仪,晶芯LuxScanIM10K芯片扫描仪,博奥北京生物有限公司生产;LabCycler Standard梯度PCR仪,德国SENSO公司生产;BioSpec-nano微量核酸蛋白仪,日本岛津公司生产;GBOX-HR-E-M型全自动凝胶成像分析系统,英国昊维特公司生产。
1.2 方法
1.2.1 引物和探针的设计 在NCBI上查找BTV、FMDV、GPV、SPPV、BVDV等5种病毒的基因组序列并进行序列分析。选择GenBank登录号为 GU954426.1,GU125646.1,EF517961.1,AY077834.1和GU395536.1作为参考序列,使用Prime 5.0软件分别设计5种病毒的多重PCR引物和相应的寡核苷酸探针。每种病毒的上游引物5′端标记TAMARA荧光基团。探针长度小于35bp的探针5′端加T至35bp。引物和探针的合成、标记均由宝生物工程(大连)有限公司完成,具体序列见表1。

表1 基因芯片检测引物和探针序列Table 1 Primers and probe sequences of the gene chip detection
1.2.2 5种病毒目的基因的克隆和鉴定 参照MiniBEST核酸提取试剂盒说明书提取BTV、FMDV、BVDV、GPV和SPPV病毒核酸,用表1的引物分别进行PCR扩增。回收目的PCR产物,TA克隆于pMD18-T质粒。挑选阳性重组体,用EcoRⅠ和HindⅢ单、双酶切鉴定,并进行序列测定。
1.2.3 基因芯片检测方法的建立和优化
1.2.3.1 基因芯片的制备 以晶芯○R基因芯片点样液稀释各探针至终浓度为30μmol/L,用Smart-ArrayerTM48芯片点样仪将各探针阵列点样于空白基片。每张基片设12个矩阵,每个矩阵为11×11阵列。矩阵布局为:第1行和第1列为点样质控探针,各11个重复点;第2行和第11行为杂交质控探针,各10个重复点;第10行依次为点样液和空白对照,各5个重复点;第3行前5个探针点为BTV探针1;第5行前5个探针点为FMDV探针1;第7行前5个探针点为GPV探针3,后5个探针点为SPPV探针3;第8行前5个探针点为BVDV探针3,其他位置为未检测出阳性信号点样探针点。点样完毕,将制备的芯片80℃固定探针2h~3h后,4℃保存备用。
1.2.3.2 多重PCR方法的建立 分别提取5种病毒核酸,以BTV、FMDV、BVDV病毒核酸为模板,建立三重RT-PCR方法,采用25.0μL反应体系。反应体系为:逆转录酶1.0μL,2×TaqPCR MasterMix 12.5μL,上游引物各(20μmol/L)0.5μL,下游引物各(20μmol/L)0.5μL,模板各2.0μL,补水至25.0μL。反应条件为:42℃反转录30min;94℃预变性5min;94℃1min,55℃1min,72℃1 min,共30个循环;72℃延伸10min。以GPV、SPPV病毒核酸为模板,建立双重PCR方法,采用25.0μL反应体系,双重PCR反应体系为:2×TaqPCR MasterMix 12.5μL,上游引物(20μmol/L)各0.5μL,下游引物(20μmol/L)各0.5μL,模板各2.0μL,补水至25.0μL。PCR反应条件为:94℃预变性5min;94℃1min,43℃1min,72℃1min,共30个循环;72℃延伸10min。
1.2.3.3 基因芯片的杂交与洗涤 取42℃预热的含470mL/L甲酰胺的杂交液8μL(1 000mL/L甲酰胺3.75μL、20×SSC 2.25μL、100g/L SDS 0.3 μL、50× Denhardt’s 1.5μL,水0.2μL)与7μL PCR产物混匀,95℃变性10min,迅速冰浴5min。参照晶芯○R基因芯片杂交盒说明,将杂交样品点加到基因芯片每个阵列中。在芯片杂交仪中42℃、5 RPM摇转杂交4h。杂交完毕,在芯片清洗仪中使用洗液Ⅰ(2× SSC,20g/L SDS)42℃振荡洗涤3 min,重复3次;洗液Ⅱ(0.2×SSC)洗涤3次;超纯水清洗2次后,300r/min离心甩干后备检。
1.2.3.4 病毒基因芯片扫描与分析 预热芯片扫描仪,选择Cy3通道扫描杂交的基因芯片,Lux-Can3.0软件记录、分析荧光信号强度。
1.2.3.5 基因芯片杂交液和杂交时间的优化 选择不同甲酰胺浓度的4种杂交液,参照1.2.3.3方法以病毒PCR产物与制备的基因芯片分别杂交30min、1 h、2h和4h,杂交过夜,扫描、记录杂交信号,根据杂交信号的强度选择最佳杂交条件。杂交液配方为:杂交液a(配方见1.2.3.3)、杂交液b(3× SSC、2g/L SDS、250g/L甲酰胺、5×Denhardt’s)、杂交液c(5×SSC、25g/L甲酸胺、2g/L SDS)和杂交液d(20×SSC 1.5μL,100g/L SDS 0.25μL)。
1.2.4 特异性试验 MiniBEST病毒核酸提取试剂盒分别提取1.1材料中9种病毒核酸。使用表1中病毒特异性引物参照方法1.2.2对9种病毒进行扩增后,PCR产物分别与制备基因芯片杂交,观察、记录结果。
1.2.5 敏感性试验 用微量核酸蛋白仪分别测定BTV、FMDV、GPV、SPPV、BVDV等5种病毒重组质粒浓度,用超纯水做100倍梯度稀释,共做5个稀释度,按照方法1.2.2扩增后,与制备的基因芯片杂交,研究基因芯片的敏感性。
1.2.6 稳定性试验 以BTV、GPV和BTV、GPV、SPPV三重PCR产物分别与4℃避光1个月、2个月、4个月和6个月的基因芯片杂交,了解制备的病毒基因芯片的稳定性。
1.2.7 方法对比试验 选择151份皮毛样品,随机添加构建的5种病毒质粒,室温条件下放置12h~24h,采用酚氯仿法提取皮毛样品中的核酸,按照
1.2.3.3 步骤与制备的病毒基因芯片进行杂交,同时用维伯鑫病毒核酸检测试剂盒进行平行检测,与病毒基因芯片检测结果进行比较。
2 结果
2.1 病毒重组质粒克隆和鉴定结果
分别提取BTV、FMDV、GPV、SPPV和BVDV等5种病毒核酸,PCR扩增后,20g/L琼脂糖凝胶电泳检测,电泳条带大小分别为221、136、256、157、214 bp,结果和设计的扩增目的片段大小一致(图1)。对阳性克隆质粒鉴定发现,EcoRⅠ和HindⅢ单、双酶切片段大小与设计扩增片段大小一致。测序分析发现构建的BTV、FMDV、GPV、SPPV和BVDV的重组质粒与病毒参考序列高度同源,同源性分别为98%、96%、98%、96%、96%,说明重组质粒构建成功。
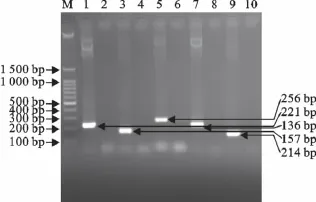
图1 5种病毒PCR扩增结果Fig.1 PCR amplification results of the 5viruses
2.2 多重PCR扩增结果
提取5种病毒阳性克隆质粒为模板,进行BTV、FMDV、BVDV三重RT-PCR扩增,产物大小分别221、136、214bp,与设计目的片段大小一致(图2);建立的GPV、SPPV双重PCR产物电泳条带大小分别为256bp、157bp,预期设计电泳条带大小一致(图3)。
2.3 基因芯片方法建立和优化
2.3.1 杂交探针筛选 依据基因芯片杂交特异性和敏感性试验结果中各病毒检测探针荧光信号强度,筛选出检测5种病毒特异性寡核苷酸探针,BTV探针1、FMDV探针1、GPV探针3、SPPV探针3、BVDV探针3。
2.3.2 基因芯片杂交条件优化 分别选择4种不同的杂交液和不同的杂交时间,参照1.2.3.3方法以BTV PCR产物与基因芯片杂交,根据杂交信号的强度,结果发现,选择杂交液a,在42℃、5RPM条件下杂交4h杂交信号最强。

图2 BTV、FMDV、BVDV三重PCR扩增结果Fig.2 Triplex PCR amplification results of BTV,FMDV and BVDV
2.4 方法的特异性试验
以提取的9种病毒核酸为模板,PCR扩增后,每种病毒的扩增产物分别与制备基因芯片杂交。发现扩增的BTV、FMDV、GPV、SPPV和BVDV产物在相应检测探针位点出现绿色荧光信号,扩增PRV、PRRS、AIV、NDV的未出现杂交信号(图4)。结果表明,各病毒探针之间无交叉反应,制备的芯片具有很强的特异性。

图3 GPV、SPPV双重PCR扩增结果Fig.3 Duplex PCR amplification results of GPV and SPPV
2.5 方法的敏感性试验
用微量核酸蛋白仪测定BTV、FMDV、GPV、SPPV和BVDV阳性重组质粒浓度。以倍比稀释的核酸为模板,按照1.2.3.3方法与基因芯片进行杂交。结果表明,病毒基因芯片可检测到BTV、FMDV、GPV、SPPV、BVDV阳性杂交信号核酸最低浓度分别约为20、10、10、10、20拷贝。
2.6 方法的稳定性试验
与4℃避光保存的病毒基因芯片进行杂交,结果发现三组病毒PCR产物与至少保存6个月的病毒基因芯片杂交仍能出现阳性荧光信号。将阳性杂交芯片在室温条件下避光保存3个月,5个月和6个月,结果发现保存6个月杂交芯片仍有很强的荧光信号。

图4 病毒基因芯片检测特异性结果Fig.4 Specificity of microarray in detecting viral pathogens
2.7 方法比对结果
用酚氯仿法从放置24h构建的模拟阳性皮毛样品中提取病毒核酸,按照1.2.3.3方法与制备的基因芯片进行杂交后。皮毛样品2号芯片检测结果为BTV、FMDV和BVDV阳性,皮毛样品26号芯片检测结果为BTV和GPV阳性,皮毛样品32号芯片检测结果为FMDV阳性(图5)。用维伯鑫5种病毒核酸检测试剂盒分别对皮毛样品2号、26号和32号核酸进行检测,结果一致(图6)。对151份阳性皮毛样品检测结果和维伯鑫5种病毒核酸检测试剂盒检测结果检测符合率为100%。

图5 病毒基因芯片检测皮毛样品结果Fig.5 Results of microarray in detecting fur samples

图6 维伯鑫病毒检测试剂盒检测皮毛样品结果Fig.6 Results of Vipoyion specific kit in detecting fur samples
3 讨论
在牛、羊等动物皮毛携带的常见病毒中,BTV、FMDV、GPV和SPPV属于动物高风险疫情疫病病毒,BVDV属于动物中等风险疫情疫病病毒。这几种病毒通过皮毛及其相关制品传播的风险较高,动物一旦感染,病死率较高,并且极难消除,一旦形成暴发和流行趋势,将对我国畜牧业以及经济发展造成重大影响,同时对家畜和皮毛相关从业人员健康造成重大危害。我国作为进口动物皮毛及其制品最多的国家,这5种病毒一旦传入我国,将对我国对外贸易和畜牧业发展产生重大打击,因此需要加强对进口皮毛及其制品携带病毒的检测。目前,对皮毛中携带病毒检测依然使用传统的技术方法,主要依靠血清学方法和PCR技术,这些方法难以实现对皮毛样品的高通量检测,也不可能对携带的病毒进行快速筛选。本研究采用荧光标记5种病毒的上游引物,在多重PCR的基础上建立动物皮毛中携带5种病毒的基因芯片检测技术。该方法能够同时对5种病毒进行检测,特异性强,灵敏度高,可以实现高通量对皮毛样品的快速诊断,适合进出境检验检疫部门批量样品检测的需求。
在基因芯片方法建立的过程中,探针的设计和选择至关重要。使用寡核苷酸片段与标记的目的片段杂交是一种常见的芯片检测技术平台。寡核苷酸探针在病毒核酸序列中的位置,探针的长度以及Tm值都会影响芯片检测的特异性、敏感性和杂交信号的强度[5-7]。相关的报道表明15bp~18bp短核苷酸探针可以区分亲缘关系较近的病毒。本研究考虑到探针在玻璃基片上的空间位租效应,将碱基长度不到35bp的探针在其5′端增加T碱基至35 bp。试验的结果也证实,该方法设计的寡核苷酸探针特异性好,荧光信号强于未加T碱基的其他探针。在基因芯片杂交过程中,杂交液中甲酰胺浓度、杂交温度以及杂交时间三者紧密结合,共同影响着基因芯片杂交的特异性和敏感性。不适当的杂交条件影响芯片杂交信号的强度,甚至出现假阳性杂交信号[8-9]。一般首先选择当杂交液中含500mL/L甲酰胺时,在42℃条件下进行杂交反应。本研究选择4种不同浓度甲酰胺杂交液进行优化,同时对杂交温度以及杂交时间进行优化,最终确定基因芯片的最佳杂交条件,检测最高灵敏度达到约20个拷贝数。
尽管基因芯片技术因其高通量、微型化以及自动化等方面的优越性而受到广泛的关注[10-12],但是作为一种新兴技术还存在着许多亟待解决的问题,如由于该技术具有很高的敏感性,对杂交环境(杂交条件以及实验环境)有很高的要求,同一种基因芯片类型,在不同的试验环境中其特异性和敏感性不同,在本实验室条件下,前期的杂交试验当中遇到过类似的问题。总之,本试验建立的基因芯片检测方法能够有效的检测动物皮毛中携带的5种病毒,同时该技术对于环境以及其他临床样品中病毒的污染和传播检测提供了一个技术平台。
[1] Bora D P,Venkatesan G,Bhanuprakash V,et al.TaqMan real-time PCR assay based on DNA polymerase gene for rapid detection of Orf infection[J].J Virol Meth,2011,178(1-2):249-252.
[2] Batten C A,Bachanek-Bankowska K,Bin-Tarif A,et al.Bluetongue virus:European Community inter-laboratory comparison tests to evaluate ELISA and RT-PCR detection methods[J].Vet Microbiol,2008,129(1-2):80-88.
[3] Stenfeldt C,Belsham G J.Detection of foot-and-mouth disease virus RNA in pharyngeal epithelium biopsy samples obtained from infected cattle:Investigation of possible sites of virus replication and persistence[J].Vet Microbiol,2012,154(3-4):230-239.
[4] Dubovi E J.Laboratory diagnosis of bovine viral diarrhea virus[J].Biologicals,2012,6(4):1-6.
[5] Southern E,Mir K,Shchepinov M.Molecular interactions on microarrays[J].Nat Gene,1999,21(1):5-9.
[6] Ratushna V J,Weller,Gibas C.Secondary structure in the target as a confounding factor in synthetic oligomer microarray design[J].BMC Genomics,2005,6(1):31.
[7] Tian J,Ma K,Saaem I.Advancing high-throughput gene synthesis technology[J].Molecular Bio Systems,2009,7(5):714-722.
[8] Guo Z,Guilfoyle R A,Thiel A J,et al.Direct fluorescence analysis of genetic polymorphisms by hybridization with oligonucleotide arrays on glass supports[J].Nucleic Acids Res,1994,22(24):5456-5465.
[9] Rodaree K,Maturos T,Chaotheing S,et al.DNA hybridization enhancement using piezoelectric microagitation through a liquid coupling medium[J].Lab on a Chip,2011,6(11):1059-1064.
[10] Brown P O,Botstein D.Exploring the new world of the genome with DNA microarrays[J].Nat Gene,1999,21(1):33-37.
[11] Yoo S M,Lee S Y.Diagnosis of pathogens using DNA microarray[J].Rec Patents on Biotechnol,2008,2(2):124-129.
[12] Huguenin A,Moutte L,Renois F.Broad respiratory virus detection in infants hospitalized for bronchiolitis by use of a multiplex RT-PCR DNA microarray system[J].J Med Virol,2012,84(6):979-985.
